刺苋和苋属的实时荧光PCR鉴定
林晓佳,吴 姗,陈吴健,任 琰,沈旭芳
(浙江省检验检疫科学技术研究院,浙江 杭州 310016)
当外来物种在非原产地新生态环境中建立种群,进一步传播扩散改变或威胁本地生物多样性且带来一定危害与影响的时候,就成为外来入侵物种(Alien invasive species)[1]。中国国土广袤,幅员辽阔,自然地理条件复杂,无论栖息地类型还是结构均呈现多样化的特征,几乎适宜任何外来物种归化[2]。植物入侵一般比动物入侵更频繁,更常见,入侵物种数量更大,危害程度更高[3]。植物入侵意味着外来植物可能取代土著植物,导致土著植物多样性降低,最终导致生态系统多样性的改变[4]。据调查研究显示,中国外来入侵植物约 500种,主要为菊科Compositae,豆科Leguminosae,禾本科Gramineae,苋科Amaranthaceae等,优势属中较为突出的是苋科苋属Amaranthus[1]。该属的刺苋A. spinosus,反枝苋A. retroflexus,长芒苋A. palmeri属于杂草,种子细小,结实量极大,且具有化感潜力[5]。刺苋原产热带美洲,目前中国、日本、印度、中南半岛、马来西亚、菲律宾等地皆有分布。我国19世纪30年代在澳门发现,现已成为我国热带、亚热带和暖温带地区的常见杂草,广布于陕西、河北、北京、山东、安徽、浙江、广东、香港、台湾等二十余个省市。刺苋胞果边熟边开裂,散落种子于土壤中,入侵旷地、园圃、农耕地等,常大量孳生危害旱作农田、蔬菜地及果园,严重消耗土壤肥力[6],对生长在其周围植物的萌发和光合速率都会有一定的影响,降低多种作物的生长和产量[5]。成熟植株有刺因而清除比较困难,并伤害人畜。2010年被我国环保部列入“中国第二批外来入侵物种名单”,成为我国第二批十种外来入侵杂草之一[6]。
入侵生物的传播途径主要有3种。有意识引进,即人为引进具有一定经济价值、实用价值的物种,最后演变为入侵种;无意识引进,即随着贸易、运输、旅游等活动而传入的物种演变而成的入侵种;自然入侵,即通过物种自身的扩散能力或者借助自然条件而实现的入侵[7]。据悉,中国外来入侵植物中约 50%是由于检疫人员疏漏,随贸易品、运输工具等方式引进,即无意识引进。但随着贸易全球化,人为活动范围的扩大,进出口贸易量的与日俱增,对检疫工作提出了更高的要求。而检疫工作中面临的业务量大、鉴定专家匮乏,特别是植物物种鉴定通常以传统的形态学鉴定为主,若植物以种子、果实等形态出现,或形态学信息不足等都会使鉴定面临困难[8]。利用分子生物学手段,通过检测物种DNA序列中特异性的片段,是解决形态学鉴定不足的有效方法之一,也为快速检疫鉴定携带或夹带的植物样本或种子提供有效的解决方案。实时荧光 PCR方法是基于传统PCR法的基础上,设计具有物种特异性的引物和探针,通过特异性引物的扩增,鉴定该物种是否为目标物种,同时结合具有荧光标识的探针实现同步扩增同步检测,提高检测效率。本研究基于植物叶绿体基因的保守片段,研究了刺苋和苋属植物的实时荧光PCR快速鉴定方法。
1 材料和方法
1.1 供试样品
供试植物样品包括苋科苋属7种(包含刺苋的9个不同地理种、长芒苋的2个不同地理种和其它5种)和苋科非苋属8种,以及苋科外植物3种共27个样品(表1)。2014-2015年7-8月,在浙江、江苏及广东等地粮库周边、农舍周围、村道边和田间等地采集相关植物样品,每个采集地点每种样品均随机采集3株,将其放入塑料样品保鲜袋中,带回实验室后放置于-70℃冰箱保存、备用。种子样品是2015年从进口大豆中截获,置于4℃冰箱中保存、备用。

表1 供试样品Table 1 Samples for test
1.2 基因组DNA提取
每株植物样品取2 g叶片,用液氮研磨后混匀,再取其中0.2 g;每个种子样品随机抽取10粒,用液氮研磨后混匀,再分别采用QIAGE N DNeasy Plant Mini Kit(美国)试剂盒提取,得到的DNA溶解在50 μL去离子水中。所得DNA样品置于-20℃冰箱保存、备用。
1.3 特异性引物探针的设计与合成
引物和探针的设计是基于叶绿体的PsbA基因(Genbank登录号:DQ006133.1),通过Primer 5软件选取了ASP-1和ASP-2两组具有刺苋特异性的引物探针(表2)。本研究所用的TaqMan实时荧光PCR引物和探针由杭州擎科梓熙生物技术有限公司合成。

表2 引物探针序列Table 2 Primers and probes designed for detection of A. spp.
1.4 TaqMan实时荧光PCR
实时荧光PCR反应体系如下:10 μL Premix Ex Taq(Takara,中国),上游引物(10 pmol·μL-1)0.4 μL,下游引物(10 pmol·μL-1)0.4 μL,探针(10 pmol·μL-1)0.4 μL,取上述提取得到DNA液2 μL,用去离子水补足体积至20 μL。阴性对照反应用2 μL的去离子水替代DNA进行反应。应用荧光定量PCR仪lightcycle 480(Roche,美国)进行反应,反应程序为(1)95℃,10 s;(2)95℃,5 s;58~62℃(每2℃为一个梯度进行优化),23 s;40个循环。在特异性和灵敏度验证实验中,real-time PCR反应都重复3次,Ct值表示结果(Ct值表示每个反应管内荧光信号到达设定的域值时所经历的循环数),SD表示标准差。
1.5 引物的特异性和灵敏度验证
1.5.1 特异性验证 对27个样品进行荧光PCR检测,以验证所设计引物探针的特异性(表3)。同时设置了3个PCR退火温度(58℃,60℃,62℃),以比较不同温度下的荧光PCR反应特异性。
1.5.2 灵敏度验证 以初始浓度为6.7 ng·μL-1的衢州刺苋DNA为材料,用去离子水对上述DNA进行2倍稀释,共得到12个浓度的DNA样本进行荧光PCR检测,以验证引物探针ASP-1与ASP-2的灵敏度(表4)。其中DNA的初始浓度通过核酸浓度仪(Nanodrop 1000)测定获得,其余样品的浓度则通过2倍梯度稀释推算得到[9]。
1.6 数据分析
荧光PCR反应完成后,用仪器自带的软件lightcycle 480 software release计算并得到Ct值。根据重复3次的Ct值,利用Excel 2007软件计算相应的标准差(SD)。取3次结果的平均值,平均Ct值>35.0或无Ct值可判为阴性,Ct值≤35.0可判为阳性。
2 结果与分析
2.1 引物探针特异性验证
设计的两组引物探针经特异性验证后显示,不同的扩增温度对引物探针的特异性存在影响。58℃时,ASP-1不仅能在刺苋中扩增出相应条带,同时也能在苋属植物中扩增到目的片段,但当温度提高到60℃时,特异性有所升高,当温度设定为62℃时,只有目标物种得到阳性结果(表3)。对苋属具有特异性的引物探针组合ASP-2而言,当扩增温度设定为58℃时,在非苋属植物中也出现了非特异性扩增,但当温度设为 60℃和 62℃时,分别都只有在目标苋属植物中得到了阳性结果,但在60℃时,得到的Ct值低于62℃时的结果,相比较60℃时检测的灵敏度较高。因此,ASP-1适合作为刺苋的实时荧光 PCR特异性鉴定引物探针,其最佳扩增温度 62℃;ASP-2适合作为苋属的实时荧光PCR特异性鉴定引物探针,其最佳扩增温度为60℃。
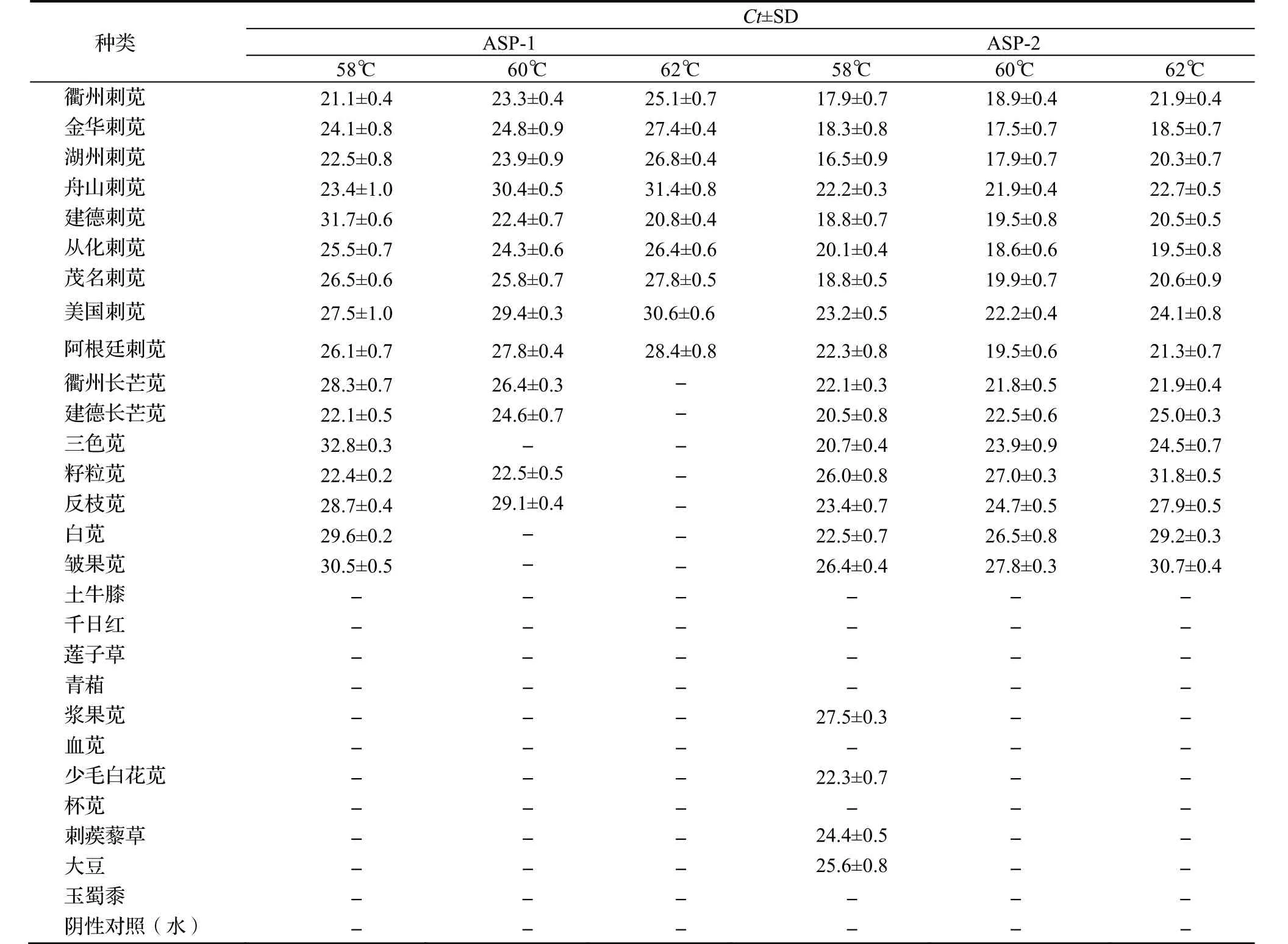
表3 引物探针特异性验证Table 3 Specificity verification for the primers and probes
2.2 引物探针灵敏度验证
验证结果显示(表4),当DNA浓度稀释至0.03 ng·μL-1时,ASP-1得到的Ct值为32.2,当浓度降至0.02 ng·μL-1时,Ct值已经低于检测限。该引物探针的灵敏度为0.03 ng·μL-1。而ASP-2的灵敏度则相对高,当检测用DNA的浓度降低至0.01 ng·μL-1时,得到的Ct值为33.8,DNA浓度进一步降低至0.005 ng·μL-1时才出现阴性结果。

表4 引物探针灵敏度验证Table 4 Sensitivity verification for the primers and probes
3 结论与讨论
目前国内对刺苋和苋属的研究主要集中在其形态结构、化学成分、生理生化和适生性分析,如姜建萍等研究了刺苋的显微结构[10];李洁运用多种色谱学方法深入而系统地研究了刺苋的化学成分,并依据其化学成分进行生物活性研究,从而评价刺苋的生物活性与化学成分之间的关系[11];陶爱林等利用基因克隆技术,同时采用生物信息学软件MULTIPREDSWISS-MODEL在线软件对所得基因编码蛋白进行抗原性评估及三级结构模拟[12];黄飞龙等采用原核系统高效表达刺苋花粉过敏原 Prf23的条件及免疫学鉴定[13];李妮亚等和崔聪淑等分别对刺苋种子的萌发特性和野生刺苋种子休眠特性及其发芽方法进行了研究[14-15];朱慧等采用全挖法对粤东地区的皱果苋、刺苋、空心莲子草Alternanthera philoxeroides 3种入侵植物在两种不同生境下的种群构件生物量结构特征进行测量和比较[16];郑卉等基于包括刺苋在内的4种苋属杂草已有的分布点数据,使用GARP和Maxent两个模型对其在中国的适生区进行预测[17]。王秋实结合历史标本信息和野外调查,对中国苋属植物进行了详细的经典分类学研究,同时对其入侵风险进行了评估[1]。而对刺苋和苋属快速分子鉴定的研究目前尚未有报道。
目前检疫鉴定杂草的常用分子生物学方法主要有以下几种:限制性内切酶片段长度多态性(RFLP)、随机扩增多态性(RAPD)、扩增片段长度多态性(AFLP)、简单重复序列(SSR)、单核苷酸多态性(SNP),以及应用较多的DNA条形码技术。如Transue等对33个籽粒苋材料进行了RAPD解析,结果与传统形态学分类吻合[18];陈景堂等利用RAPD技术研究了亚洲和中南美洲产的苋属植物7种14个品系遗传关系[5]。但上述5种方法中,前4种更多的用于种属间的聚类分析比较,较少用于对某一样本的种属鉴定,只有“DNA条形码技术”则可直接用于种属鉴定。所谓“DNA条形码技术”就是利用1段至几段标准的、易扩增的、种间差异显著大于种内差异的DNA片段来鉴别物种的新技术[19]。该方法已被应用到锦葵科Malvaceae植物[20]、苍耳属Xanthium spp.植物[21]、毒麦属Lolium spp.植物[22]以及银毛龙葵Solanum elaeagnifolium[23]等的鉴定。
本研究在DNA条形码的基础上,比较了matK,rpoC1,rpoB,accD及PsbA等基因在苋属内的序列异同(略),最后在PsbA上找到了适合苋属及属内刺苋鉴定的引物和探针序列,建立了一种能快速、灵敏、准确地鉴定刺苋及苋属植物的新方法——实时荧光PCR鉴定方法。该方法对刺苋的检测灵敏度可达到0.03 ng·μL-1;苋属的检测灵敏度则可达到0.01 ng·μL-1,足以满足日常鉴定的检测需求。同时该方法从DNA抽提到获取实时荧光PCR图谱,整个过程可在3 h内完成,能达到快速鉴定入侵杂草刺苋和苋属植物的目的。实时荧光PCR方法适用于植物任何生长周期和生长部位,不受实验材料存活状态的影响;同时可对疑似目标植物残体进行快速准确鉴定,弥补了形态学鉴定方法的不足,可作为形态鉴定的辅助方法,可快速准确有效地对刺苋及苋属植物进行鉴定。
[1] 王秋实. 中国苋属植物的经典分类学研究及其入侵风险评估[D]. 上海:华东师范大学,2015:1.
[2] 马金双. 中国外来入侵植物调研报告[M. 北京:高等教育出版社,2014:7-924.
[3] 闫小玲,寿海洋,马金双. 中国外来入侵植物研究现状及存在的问题[J]. 植物分类与资源学报,2012,03:287-313.
[4] 万方浩,郭建英,张峰. 中国生物入侵研究[M]. 北京:科学出版社,2009:1-316.
[5] 陈景堂,刘志增,池书敏. RAPD技术在几个苋属植物遗传分类中的应用研究[J]. 西北植物学报,2001,21(5):872-878.
[6] 中国环境保护部,中国科学院. 中国第二批外来入侵物种名单[Z]. 北京:环发〔2010〕4号,2010-1-7. http://www.zhb.gov.cn/gkml/hbbbwj/201001/t20100126_184831.htm.
[7] 田旭飞. 辽宁省主要入侵植物DNA条形码技术体系构建[D]. 沈阳:沈阳农业大学,2016:1-2.
[8] 伏建国,杨晓军,钱路,等. 植物DNA条形码技术在出入境检验检疫领域的应用[J]. 植物检疫,2012,6(2):64-69.
[9] PEGELS N,GONZÁLEZ I,GARCÍA T,et al. Avian-specific real-time PCR assay for authenticity control in farm animal feeds and pet foods[J].Food Chem,2014,142:39-47.
[10] 姜建萍,高雅,朱意麟,等. 刺苋的显微结构研究[J]. 时珍国医药,2007,18(11):2812-2813.
[11] 李洁. 刺苋的化学成分及生物活性研究[D]. 厦门:厦门大学,2012:1-76.
[12] 陶爱林,刘林川,王永飞,等. 刺苋花粉泛过敏原Profilin的抗原性评估与三级结构分析[J]. 中华微生物学和免疫学杂志,2008,28(7):616-620.
[13] 黄飞龙,马三梅,陶爱林,等. 刺苋花粉过敏原Prf23的表达优化及其免疫学鉴定[J]. 免疫学杂志,2009,25(5):612-613.
[14] 李妮亚,吴艳,李雷,等. 红瓜、刺苋种子的萌发特性[J]. 海南师范学院学报:自然科学版,2001,14(2):14-16.
[15] 崔聪淑,卢新雄,陈辉王,等. 野生苋种子休眠特性及发芽方法研究[J]. 种子,2001,2(114):55-75.
[16] 朱慧,马瑞君. 粤东地区苋科入侵植物种群的构件生物量结构[J]. 西南农业学报,2010,23(3):876-880.
[17] 郑卉,何兴金. 苋属4种外来有害杂草在中国的适生区预测[J]. 植物保护,2011,37(2):81-86.
[18] TRANSUE DK,FAIRBANKS D J,ROBISON LR,et al. Species identification by RAPD analysis of grain amaranth genetic resources[J]. Crop Sci,1994,34:1385-1389.
[19] 魏霜,袁俊杰,刘玉莉,等. 检疫性杂草分子鉴定研究进展[J]. 检验检疫学刊,2014(5):71-74.
[20] 王珂,陈科力,刘振,等. 锦葵科植物DNA条形码通用序列的筛选[J]. 植物学报,2011,46(3):276-284.
[21] 胡伟毅,汪连军,盛志超. DNA条形码基因ITS,ITS2和rbcl在苍耳属可采用相同PCR条件[J]. 安徽农业科学,2013,41(16):7070-7071.
[22] 陈冬美. 毒麦属6个种的分子检测检疫应用研究[D]. 长沙:湖南农业大学,2007.
[23] 张伟,范晓虹,邵秀玲,等. DNA条形码在检疫性杂草银毛龙葵鉴定中的应用研究[J]. 植物检疫,2013,27(3):60-65.

