针刺疗法对腹泻型肠易激综合征大鼠Nrf2-Keap1-ARE信号通路的影响*
李湘力,胡 涛,刘小宁,蔡敬宙,柯 姗
(1.广州市第一人民医院,广东 广州 510180;2.武汉市儿童福利院,湖北 武汉 430060)
肠易激综合征(Irritable bowel syndrome,IBS)是以腹痛或腹部不适,大便习惯改变,并伴有一系列胃肠道症状及精神症状而肠道缺乏明显病理性改变为特征的功能紊乱性疾病,其中以腹泻型肠易激综合征(Irritable bowel syndrome with diarrhea,IBS-D)多见[1]。最近国内外一系列重要临床研究结果认为针灸对治疗和缓解IBS-D症状有着明显的成效[2-4],然而其更加深入的分子生物学机制研究还十分有限。
本研究利用Wistar大鼠建立IBS-D模型,并针刺穴位,观察针刺对IBS-D的缓解作用以及体内Nrf2-Keap1-ARE通路表达情况,并利用siRNA技术,沉默大鼠体内Nrf2基因,探讨此通路在IBS-D的保护作用。
1 材料与方法
1.1 动物及分组
4周龄Wistar大鼠50只,雄性,体质量100~120 g,由广州医科大学动物实验中心提供,所有动物均依据动物实验伦理委员会的要求进行实验。在适应性喂养1周后,50只Wistar大鼠随机分为IBS-D模型组、药物致泻模型+强行应激法(Chronic and acute stress,CAS)刺激组、CAS+针刺组、CAS+针刺+Nrf2 siRNA(Nrf2sh)组和正常组,每组10只。
1.2 主要仪器与试剂
Bio-Rad CFX96 System PCR仪(美国伯乐公司);0.30 mm×15 mm华佗牌一次性无菌针灸毫针(苏州医疗用品厂有限公司);RNAiso Plus试剂盒(日本Takara公司);5-HT、NPY试剂盒(北京百奥莱博科技有限公司);MDA、GSH/GSSG试剂盒(南京建成生物工程研究所);SOD试剂盒(日本同仁化学公司);ROS试剂盒(上海碧云天生物技术研究所);Real-time PCR 相关试剂盒(上海基尔顿生物科技有限公司);相关Western-blot一抗及二抗(美国Abcom or Cell signaling公司)。
1.3 造模方法
大鼠通宵光照12 h→45℃环境温度刺激5 min→饮水剥夺24 h→4℃低温环境3 min→鼠尾夹刺激1 min→水平振动(120/min)刺激40 min→食物剥夺24 h,持续3周[5],获得IBS-D模型大鼠。大鼠在CAS刺激前1 h灌胃番木液(6 g/kg),其后实施CAS刺激 (模型强化),操作步骤可根据相关研究[6-7],以获得药物致泻+CAS模型大鼠。
1.4 各组处理方法
CAS+针刺组:10只,CAS刺激后,根据李忠仁编写的《实验针灸学》选取穴位,双侧取穴:ST25(天枢)、ST36(足三里)和LR3(太冲),针刺深度3 mm,留针30 min,每隔10 min行针1次。
CAS+针刺+Nrf2sh组[8]:10只大鼠,参照Genebank中,鼠Nrf2基因mRNA序列,按照siRNA序列设计原则进行设计:从mRNA中AUG起始密码下游75-100碱基位置开始,寻找“AA”二连序列,并记录下其3′端19个碱基序列,选择G:C在40~55%之间的靶序列。并利用BLAST软件和相应的基因组数据库比较潜在的siRNA靶序列,排除和其他编码序列/EST同源的序列,选择3条siRNA序列和1条随机对照序列。慢病毒载体构建siRNA,分别设计4对引物并进行体外构建(NFE2L2-HOMO-1498: 5′GCCCAUUGAUGUUUCUGAUTT&3′AUCAGAAACAUCAAUGGGCTT、NFE2L2-HOMO-934: 5′CCCGUUUGUAGAUGACAAUTT&3′AUUGUCAUCUACAAACGGGTT、NFE2L2-HOMO-2226:5′GCACCUUAUAUCUCGAAGUTT&3′ACUUCGAGAUAUAAGGUGCTT和NC-siRNA:5′UUCUCCGAACGUGUCACGUdTdT&3′ACGUGACACGUUCGGAGAAdTdT),额外取Wister大鼠1只,使用微量注射器取对照病毒稀释液,在鼠尾静脉处注射6 μL病毒稀释液,在注射完后12 h、24 h、72 h、7天和14天时,利用RNAiso Plus试剂盒提取肠道组织中总RNA,逆转录合成cDNA。利用Realtime-PCR结果选取沉默效果最佳的1条siRNA干扰慢病毒。再进行鼠尾静脉注射,注射3周后进行CAS刺激和针刺治疗。
正常组:10只大鼠,正常饲养,无任何物理、化学及其它额外干预。
1.5 观测指标及检测方法
利用ELISA法检测5-HT和NPY的表达水平:终末次干预后,禁食12 h,全部实验组大鼠进行深度麻醉 (乌拉坦, 6 mL/kg, i.p.)。取末端结肠检测5-羟色胺(5-HT)和神经肽Y(NPY)。操作方法严格按照试剂盒说明书进行。
末端结肠抗氧化性酶活力和脂质过氧化水平检测:取末端结肠进行蛋白定量,并利用生化试剂盒检测MDA的含量、GSH、GSSG的含量,利用WST-1法检测SOD的含量和利用DCFH荧光探针检测组织中ROS的水平。操作方法严格按照试剂盒说明书进行。
利用Real-time PCR检测Nrf2信号通路基因表达水平:取末端结肠,4条基因的扩增引物见表1,按以下两步法 PCR 扩增标准程序进行程序的设置:Stage 1:预变性(1 Cycle)95℃ 30 s;Stage 2:PCR反应(40 Cycles)95℃ 5 s~60℃ 30 s;Stage 3:溶解曲线分析95℃ 0 s 65℃ 15 s 95℃ 0 s。反应结束后确认扩增曲线和融解曲线,此外定量时由软件直接得到Ct值,然后用2■ΔΔCt方法进行分析,制作出标准曲线,从而计算待测Nrf2、Keap-1、HO-1和JNK基因的mRNA含量。
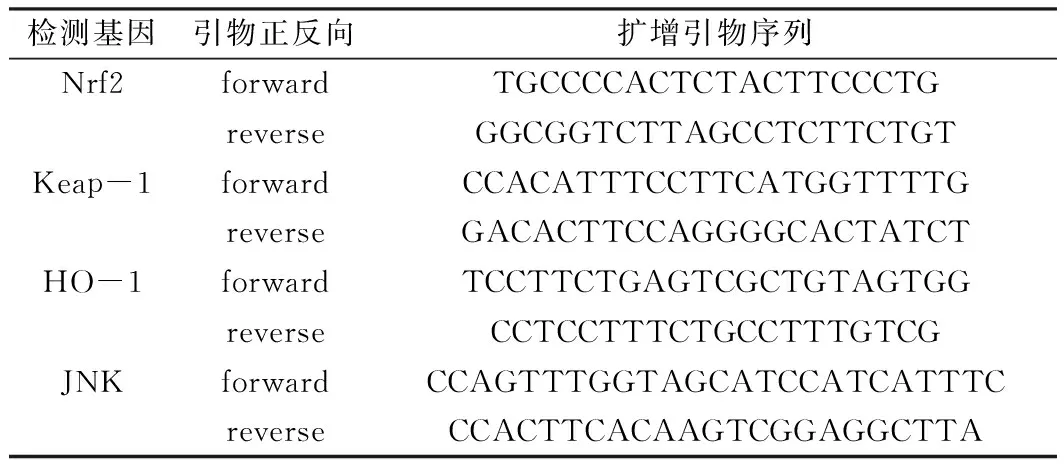
表1 引物序列信息
利用Western-blot检测Nrf2信号通路蛋白表达水平:取小鼠末端结肠约50 mg,剪碎后加入1 mL裂解液(其中RIPA:PMSF=99∶1),置于冰上充分匀浆,然后将匀浆混合物置于4℃充分裂解2 h,离心15 min(12 000 rpm,4℃)后留取上清。并用BSA法进行蛋白定量,上样量约为40 μg/μL,电泳1 h后,湿转法2 h,5%脱脂牛奶封闭,一抗(1∶1000,Cell Signaling)孵育过夜(4 ℃),二抗(兔抗鼠,1∶10 000,4 h,Cell Signaling),其后TBS-T洗脱。将PVDF膜置于吸水纸上吸干水分,而后蛋白面朝上平铺于玻璃板上,将显影液均匀而缓慢地浇于膜上,使显影液布满整个膜,约5 min后吸干发光液并将其置于暗盒中,迅速关闭暗盒。根据显影情况适当调整曝光时间,用GeneSnap进行图像拍摄,随后可使用Photoshop软件对蛋白采取半定量分析。目的蛋白的相对表达量为目的蛋白积分光密度/β-actin积分光密度。
1.6 统计学处理方法
使用SPSS 19.0统计软件包进行数据分析,实验数据使用means±SEM(standard error of the mean)表示,采用方差分析(ANOVA)和Student-Newman-Keuls多重检验(SNK-test)比较计量资料的组间差异,而计数资料则采用卡方检验(Chi-square test)和Fisher's确切概率法(Fisher's Exact Propability Test)进行统计分析。P<0.05或P<0.01表示差异具有显著性。
2 结果
2.1 各组抗氧化酶活性及脂质过氧化水平比较
通过针刺疗法后,IBS模型组、药物致泻模型+CAS刺激组和CAS+针刺+Nrf2sh组的ROS和MDA水平高于CAS+针刺组(P<0.01)和正常组(P<0.01)。其中,CAS+针刺+Nrf2sh组的MDA水平最高,说明IBS与脂质过氧化有关,并且在沉默Nrf2的表达后,脂质过氧化的水平上升。然而,药物致泻模型+CAS刺激组和CAS+针刺组之间的MDA水平没有统计学差异,可能是针刺并不是通过抑制脂质过氧化来起到作用。在抗氧化酶活性的检测中,可以观察到IBS-D模型组、药物致泻模型 + CAS刺激组和CAS+针刺+Nrf2sh组的GSH水平均低于CAS+针刺组(P<0.01)和正常对照组(P<0.01),而GSSG水平呈相反趋势(P<0.01),表明GSH的耗竭现象及低效率的氧化还原现象。此外,SOD作为生物体内捕捉阴离子最有效的抗氧化酶,在通过针刺后有较高的活性水平。结果表明:正常组和CAS+针刺组的SOD水平均高于其他组(P<0.01)。这也预示了,针刺可能是通过调节抗氧化酶来抑制IBS-D模型中的氧化性损伤。见表2。

表2 各组抗氧化酶活性及脂质过氧化水平比较
注:与正常组比较,*P<0.01;与CAS+针刺组比较,#P<0.01
2.2 各组肠神经递质表达水平比较
通过针刺治疗后,正常组和CAS+针刺组的5-HT和NPY的水平均低于其他组(P<0.01)。其中CAS+针刺+Nrf2sh组5-HT的表达最高,这也表明在IBS-D模型中Nrf2的过度抑制表达可能与过度肠蠕动有关。见表3。

表3 各组肠神经递质表达水平比较
注:与正常组比较,*P<0.01;与CAS+针刺组比较,#P<0.01
2.3 各组肠组织中Hrf2和相关通路靶点的基因及蛋白质表达水平比较
本研究中,正常组和CAS+针刺组的JNK的基因和蛋白质表达明显低于其他干预组(P<0.01)。因此,在下游的信号通路靶点中也可以观察到正常组和CAS + 针刺组的Nrf2、Keap-1和HO-1的基因和蛋白质表达均与其他干预组有差异(P<0.01)。见表4及图1。这也与本研究中抗氧化酶水平的趋势相似。因此,推测IBS-D模型中的氧化应激诱导JNK的过度表达造成了Nrf2的表达抑制,最终促成肠道氧化性损伤。

表4 各组肠组织中Hrf2和相关通路靶点的基因及蛋白质表达水平比较
注:与正常组比较,*P<0.01;与CAS+针刺组比较,#P<0.01

图1 各组大鼠Nrf2、Keap-1、JNK和HO-1的基因和蛋白质表达水平比较
3 讨论
IBS-D是一种临床常见的胃肠功能性疾病,该病易反复发作,严重影响患者生活质量。其发病机制尚未明确,西医治疗以对症治疗为主,如利用胃肠解痉药、止泻药、泻药(便秘型)、肠道动力感觉调节药、抗抑郁药和肠道菌群调节药物等来进行治疗。药物治疗虽然可以取得一定疗效,但停药后易反复,且长期服用不良反应明显[8]。
国内外研究表明针灸对治疗和缓解IBS-D有着明显的成效。有研究者[9]就针灸对IBS-D的治疗机理做出了详细的系统性回顾。认为其作用机制主要分为调节肠道蠕动能力、降低肠道的敏感性、调节脑-肠轴和神经递质的表达、调节椎体神经元的敏感性、调节肠道菌群的比例。虽然,在众多的研究中已经观察到针灸能够降低IBS-D的临床症状和改善其生化等指标[10]。然而,基于针灸对IBS-D治疗(人群和动物模型)的分子机制研究还非常有限,特别是缺乏探究针灸与具体信号通路之间关系的研究[11]。
转录因子NF-E2相关因子2(Nuclear factor erythroid2-related factor2, Nrf2) 是机体内一个重要的保护性转录分子,广泛分布于机体的各个器官中。在生理状态下,Nrf2以非活性形式存在于细胞质内;当机体处于应激状态时被激活,并通过多种途径来增强机体的抗氧化、解毒、抗凋亡等功能。其中,以Nrf2和抗氧化转录元件(ARE)为核心的Nrf2-ARE(Nrf2-Keap-1-HO-1)信号路径是Nrf2增强机体抗氧化、解毒功能最重要的保护性信号路径。在某些特定情况下,如:在长期-慢性感染中,细菌脂多糖(LPS)能够造成组织氧化性损伤(有些IBS的病因也与此极其相似),在Nrf2上调表达后,能够协同性的磷酸化细胞内血红素氧合酶-1(Hemeoxgenase-1,HO-1)的表达上调,共同降低由感染造成的细胞内氧化性损伤[12-13]。这些结果也提示了:Nrf2-Keap1-ARE通路可作为针灸治疗IBS的重要切入点。
本研究以Keap-1/Nrf2作为分子机制的切入点,结合氧化应激理论,研究针刺通过调节此信号通路的表达。经本实验研究发现,经过针刺后IBS-D大鼠抗氧化酶活性及脂质过氧化水平上升,这提示针刺可能是通过调节抗氧化酶来抑制IBS-D大鼠模型的氧化性损伤。同时,针刺治疗后,IBS-D大鼠模型5-HT和NPY的表达最高,这也表明在IBS模型中Nrf2的过度抑制表达可能与过度肠蠕动有关,因为5-HT和NPY作为是生物体内重要的神经信号递质、饱食信号递质和肠蠕动信号递质之一,起到至关重要的调节机制和反馈机制[14],但在病理因子的刺激(如凋亡、炎性因子和氧化性损伤)下,过度表达可能会导致生物体体内或器官的不正常机能。另外,本次研究中,各组肠组织中Hrf2和相关通路靶点的基因及蛋白质表达水平发生了改变,其中,JNK信号转导通路是MAPK(Mitogen-activated protein kinase)通路中重要分支,它在细胞周期、生殖、凋亡和细胞应激等多种生理和病理过程中起重要作用[15]。笔者推测IBS-D模型中的氧化应激诱导JNK的过度表达造成了Nrf2的表达抑制,最终促成肠道氧化性损伤。
本研究以Keap-1/Nrf2作为分子机制的切入点,表明了针刺通过调节此信号通路的表达,然而,由于基因表达的“空间性”和“时间性”的网络特征,针刺应用于IBS-D的治疗是否还与其他信号通路有关,还需未来更多的研究提供客观依据。
[1] 姚欣,杨云生,赵卡冰.罗马Ⅲ标准研究肠易激综合征临床特点及亚型[J].世界华人消化杂志,2008,16(5):563-566.
[2] Chao GQ,Zhang S.Effectiveness of acupuncture to treat irritable bowel syndrome:a meta-analysis[J].World journal of gastroenterology,2014,20(7):1871-1877.
[3] Zheng L,Lai Y,Lu W,et al.Pinaverium Reduces Symptoms of Irritable Bowel Syndrome in a Multicenter,Randomized,Controlled Trial[J].Clinical gastroenterology and hepatology:the official clinical practice journal of the American Gastroenterological Association,2015,13(7):1285-1292.
[4] Cramer H,Chung VC,Lauche R,et al.Characteristics of acupuncture users among internal medicine patients in Germany[J].Complementary therapies in medicine,2015,23(3):423-429.
[5] Zou N,Lv H,Li J,et al.Changes in brain G proteins and colonic sympathetic neural signaling in chronic-acute combined stress rat model of irritable bowel syndrome (IBS)[J].Translational research:the journal of laboratory and clinical medicine,2008,152(6):283-289.
[6] Huseby NE,Ravuri C,Moens U.The proteasome inhibitor lactacystin enhances GSH synthesis capacity by increased expression of antioxidant components in an Nrf2-independent, but p38 MAPK-dependent manner in rat colorectal carcinoma cells[J].Free radical research,2016,50(1):1-13.
[7] Torres-Rosas R,Yehia G,Pena G,et al.Dopamine mediates vagal modulation of the immune system by electroacupuncture[J].Nature medicine,2014,20(3):291-295.
[8] Trinkley KE,Nahata MC.Medication management of irritable bowel syndrome[J].Digestion,2014,89:253-267.
[9] 吴淑娟,潘建春.肠易激综合征发病机制研究进展[J].温州医科大学学报,2015,45(5):387-390.
[10] 柯水芳,陆敏.腹泻型肠易激综合征中医药治疗研究进展[J].光明中医,2017,32(4):612-614
[11] 徐桂兴,黄碧清,熊俊.针灸治疗肠易激综合征的系统评价[J].中华中医药学刊,2016,34(9):2171-2174
[12] Wang XR,Shi GX,Yang JW,et al.Acupuncture ameliorates cognitive impairment and hippocampus neuronal loss in experimental vascular dementia through Nrf2-mediated antioxidant response[J].Free radical biology & medicine,2015,89:1077-84.
[13] Abed DA,Goldstein M,Albanyan H,et al.Discovery of direct inhibitors of Keap1-Nrf2 protein-protein interaction as potential therapeutic and preventive agents[J].Acta pharmaceutica Sinica B,2015,5(4):285-299.
[14] 兰雄华,王旭升.马来酸曲美布汀联合双歧三联活菌治疗肠易激综合征疗效观察[J].中国现代医生,2011,49(1):109-110.
[15] 李莉,郭媛,赵晏.神经肽Y参与痛觉调制的研究进展[J].生命科学,2007,19(5):551-556.

