产黄青霉对根皮素微生物转化研究
贾秀娟,张晨曦,赵艳敏,刘岱琳,贺凌霜,晁亮
(1.中国人民武装警察部队后勤学院,天津300309;2.天津中医药大学,天津300193)
根皮素(Phloretin)化学名为3-(4-羟基苯基)-1-(2,4,6-三羟基苯基)-1-丙酮,主要分布于苹果、梨等多汁水果的果皮及根皮中,具有降血糖、心血管保护、抗氧化、抗炎、免疫抑制和美白等多种药理作用[1],受到国内外学者广泛关注。
根皮素具有丰富的生物活性,因此近年来很多学者专注于根皮素的结构改造研究。有学者利用化学合成的方法对根皮素的乙酰阿魏酸酯[2]、异烟酰基腙[3]和乙基醚化[4]等衍生物进行合成;也有学者利用生物酶对根皮素的生物转化进行研究,获得了一系列新的糖苷化产物[5],但是利用微生物菌种对根皮素进行转化的研究报道较少。本课题组前期从24种真菌中筛选出包括菌株AS3.521在内的4株真菌对根皮素具有转化作用,在此基础上通过对转化底物根皮素消耗率的测定,发现这4株菌株的转化效率也较高[6]。本期在前期工作基础上系统研究菌株AS3.521对根皮素的转化,研究结果对根皮素的生物合成和生物转化提供可以借鉴的试验基础。
1 材料与方法
1.1 材料与试剂
根皮素对照品(纯度为90%):天津市尖峰天然产物研究开发有限公司;甲醇(色谱纯)、乙腈(色谱纯)、无水乙醇(分析纯):天津市康科德科技有限公司;超纯水:天津市职业与环境危害仿制重点实验室自制;DNA Marker、2×TaqMasterMix、引物 ITS1、引物 ITS4、ddH2O:北京博迈德生物技术有限公司;BIOWESTAGAROSE琼脂糖:上海玉博生物科技有限公司;EB(Ethidium bromide)染料:北京全式金生物技术有限公司(TRANS);菌株AS3.521:天然产物实验室自有的菌种。
1.2 仪器与设备
SW-CJ-2FD双人单面净化工作台:苏州净化设备有限公司;HZQ-QX全温振荡器:哈尔滨东联电子技术开发有限公司;SB-2000旋转蒸发仪:瑞士BUCHI公司;SHB-ⅢS循环水式多用真空泵:郑州长城科工贸有限公司;FA1204B电子天平:上海精密科学仪器有限公司;高效液相色谱仪(检测器:SPD-M20A,柱温箱:CTO-20A,双泵:LC-20A,控制器:CBM-20A)、泵:Shi madzu LC-6AD、Shimadzu PRC-ODS,40 mm×250 mm,5 μm:日本岛津公司;Cosmosil C18色谱柱(4.6 mm×250 mm,5 μm):Nacalai Tesque;Bruker AV-400 核磁共振波谱仪、Bruker DRX-400 spectrometer(1H-NMR 400 MHz,13C-NMR 100 MHz):布鲁克公司;制备型高效液相色谱仪:紫外检测器:UV3000:北京创新恒通科技有限公司;微量进样器:TM#702 0.025 mL:美国Hamilton公司;Solarbio真菌基因组DNA提取试剂盒:北京索莱宝科技有限公司;GeneAmp PCR System 9700 PCR仪:美国应用生物系统公司;离心机:赛默飞世尔科技有限公司;Bio-rad琼脂糖凝胶电泳仪、Bio-rad照胶仪:北京伯乐生命科学发展有限公司;Olympus CKX41光学显微镜:日本OLYMPUS光学仪器有限公司;TU-1901双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;高速振荡器:海门市其林贝尔仪器制造有限公司;DZKW-D-2电热水浴锅:北京永光明医疗仪器厂。
1.3 试验方法
1.3.1 菌株的鉴定
将菌株接种于PDA平皿培养基上,在28℃恒温培养箱中培养,待长出成型的菌落后,观察记录菌落的形态特征。
通过ITS序列分析进行分子生物学鉴定:取生长在斜面培养基中活化后生长状态正确的供试菌株,刮取菌丝体50 mg~100 mg,利用Solarbio真菌基因组DNA提取试剂盒提取菌种DNA,并应用通用引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和 ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)对提取得到的DNA进行 PCR扩增。PCR反应体系:25 μL2×Taq Master Mix,2 μLITS4 引物,2 μLITS5 引物,1 μLDNA以及20 μL ddH2O。反应过程:94℃预处理5 min,94℃变性 30 s,56℃退火 30 s,72℃延伸 1 min;循环 30次,最后在72℃延伸10 min。PCR扩增结束后取5.0 μL PCR产物在1.0%琼脂糖凝胶中电泳,经ED染料染色后在PCR仪中进行观察。将PCR产物委托上海派森诺生物科技股份有限公司进行测序,得到的测序结果在国家生物技术信息中心(National Center of Biotechnology Information,NCBI)中 GenBank 中进行序列检索并与Genbank中基因进行比对,通过生物软件Mege7.0(Molecular Evolutionary Genetics Analysis)建立系统发育树,进行菌种鉴定。
1.3.2 菌株AS3.521孢子菌悬液的配制
向保存于固体斜面培养基中的AS3.521菌株中加入无菌水,用接种环充分刮取菌体,通过纱布过滤,制成104CFU/mL的孢子菌悬液,备用。
1.3.3 菌株AS3.521的生长曲线的建立
利用微量移液枪吸取1 000 μL上述菌悬液接种到100 mL的液体牛肉膏培养基中,用8层纱布封好瓶口,放入全温振荡器中。在28℃,转速为160 r/min下培养。每隔6小时或12小时取出一组空白培养瓶和加药样品瓶,摇匀后取出适量用紫外可见分光光度计在600nm下测定发酵液的OD值,每个样品平行测定3次,绘制生长曲线。
1.3.4 菌株AS3.521对根皮素的转化
每200 mL PDA液体培养基中加入2 mL1.3.2项下的孢子菌悬液,在28℃、160 r/min条件下培养48 h后,加入用70%甲醇溶解的根皮素溶液(10 mg/mL)6 mL,使得底物(根皮素)浓度为0.3 mg/mL,同时设置只加入6 mL甲醇溶液而无底物的发酵组作为对照组。在相同条件下继续培养3天后,减压抽滤,去除菌丝体后合并滤液即得转化产物的培养液。
1.3.5 转化产物的分离及结构鉴定
将累积的1.3.4项下的转化产物培养液用等体积水饱和正丁醇萃取3次,合并萃取液,减压浓缩至干,得到浸膏 15.2 g,利用大孔树脂 HP20(45 cm×3.7 cm)进行分离,以水,30%、50%、70%和95%乙醇梯度洗脱,得到 5 个梯度组分(组分 1~5)。组分 2(1.16 g)经硅胶柱色谱分离,二氯甲烷-甲醇(100∶0~94∶6,体积比)梯度洗脱,获得5个洗脱组分(组分6~10)。其中组分8(105.7 mg)进行反相制备液相纯化,甲醇-水(15 ∶85)洗脱获得转化产物 1(21.6 mg)。将组分 9(33.8 mg)进行反相制备液相纯化,甲醇-水(15∶85,体积比)洗脱获得转化产物 2(1.4 mg)和转化产物 3(1.8 mg)。所得转化产物分别用氘代甲醇溶解,置于核磁管中,利用核磁共振仪进行碳谱、氢谱数据测定。
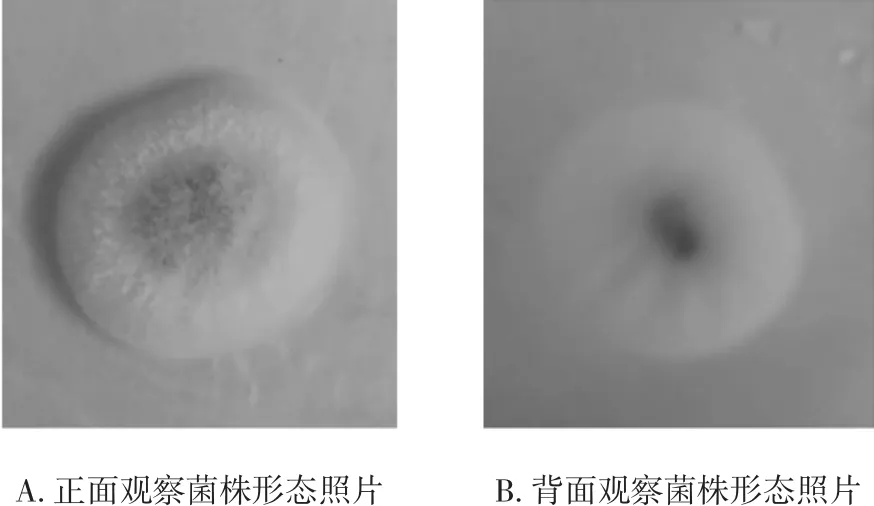
图1 菌株AS3.521菌落形态Fig.1 The forms of strain AS3.521
2 试验结果
2.1 菌株AS3.521的鉴定
菌株AS3.521在PDA固体平皿培养基中培养生长较快,3天后可见成型菌落,对其进行观察,见图1。
如图1所示,菌株呈圆形,直径1.5 cm~3 cm,边缘整齐,中间青绿色边缘有少许白色,菌丝较为紧密,呈绒状。菌落背面呈3个同心圆,中心黄褐色,外圈绿色,最外圈白色。结合《真菌鉴定手册》,初步推测菌株AS3.521属于青霉属。
菌株AS3.521的ITS测定结果表明,扩增的序列全长550 bp。将测序得到的DNA序列进行检索后选取菌株序列与AS3.521菌株序列建立系统发育树,见图2。

图2 菌株AS3.521的系统发育树Fig.2 The phylogenetic tree of strain AS3.521
如图2所示,从系统发育树中发现,菌株AS3.521与Penicillium chrysogenum位于同一分支,说明二者具有同源性,亲缘关系最为接近。并且二者在Genbank中的相似值达99%。且结合《真菌鉴定手册》的相关内容,将菌株AS3.521鉴定为产黄青霉。这和实验室最初关于菌株AS3.521的记载相一致,说明菌株AS3.521在实验室长期的菌种传代保藏过程中未发生变种。
2.2 菌株AS3.521生长曲线的建立
每隔6小时/12小时对AS3.521菌株进行OD值的测定。以时间为横坐标,OD值为纵坐标,得到AS3.521生长曲线,见图3。
从生长曲线可以发现产黄青霉菌前6 h其生长极为缓慢,6 h之后生长速度加快,从6 h~42 h是其生长的对数时期,生长较为迅速,并在42 h达到生长最大值,42 h后进入平稳期,生长较为平稳。因此,我们选择在42 h时加入底物根皮素,以使菌株AS3.521能够充分转化根皮素。
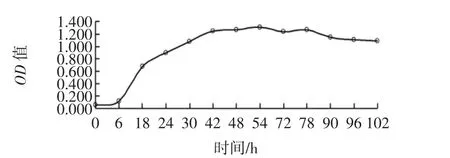
图3 菌株AS3.521的生长曲线Fig.3 The growth curve of strain AS3.521
2.3 转化产物的结构鉴定
累积得到的转化产物按“1.3.5”项下操作,通过柱色谱分离后得到3个转化产物:
化合物 1:白色粉末(甲醇),1H-NMR(400 MHz,in CD3OD),δ:7.02(2H,d,J=8.4 Hz,H-2,6),6.68(2H,d,J=8.4 Hz,H-3,5),2.8(2H,t,J=7.6 Hz,H-8),2.5(2H,t,J=7.6 Hz,H-7);13C-NMR(400 MHz,MeOH),δ:180.1(C-9),155.3(C-4),131.5(C-1),128.7(C-2,6),114.7(C-3,5),35.8(C-8),29.8(C-7)。以上核磁数据与文献[7]对照,鉴定化合物1为对羟基苯丙酸。
化合物 2:白色粉末(甲醇),1H-NMR(400 MHz,in CD3OD),δ:7.07(2H,d,J=8.3 Hz,H-2,6),6.70(2H,d,J=8.3 Hz,H-3,5);13C-NMR(400 MHz,MeOH),δ:178.2(C-7),157.3(C-4),131.3(C-2 ,6),127.3(C-1),116.2(C-3 ,5),经过与文献[8-9]数据比对,鉴定化合物2为对羟基苯甲酸。
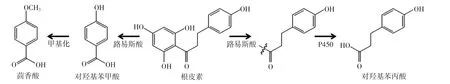
图4 转化路径的推测Fig.4 The speculation of conversation approach
化合物 3:白色粉末(甲醇),1H-NMR(400 MHz,in CD3OD),δ:7.85(2H,dd,J=6.8,1.9Hz,H-2,6),6.81(2H,dd,J=6.8,1.9 Hz H-3,5),3.83(3H,s,OCH3);13C-NMR(400 MHz,MeOH),δ:178.3(C-7),132.7(C-2,6),116.3(C-3,5),52.2(OCH3),以上波谱数据和文献[10]报道的茴香酸数据相一致,所以鉴定化合物3为茴香酸。
2.4 转化路径的推测
微生物代谢过程中会产生大量的酶,因此微生物发酵过程就是形成产酶系统的过程。基于文献,根据转化产物的结构,推测该菌种代谢中的酶[11]主要有裂解酶和甲基化酶,见图4。
如图4所示,底物根皮素在裂合酶的作用下,C=O与C-1′键断裂,并在P450氧化酶的作用下,得到产物对羟基苯丙酸。根皮素在裂合酶的作用下,C=O与其α碳连接键发生断裂,C-2′和C-6′位发生去羟基化,得到对羟基苯甲酸,之后在甲基化酶的作用下,得到产物茴香酸。
通过对转化路径的推测可以发现,菌株AS3.521产黄青霉具有很强的裂解作用,并具有甲基化酶,可以对化合物进行裂解以及甲基化作用,在以后的化合物合成过程中加以扩大应用。根皮素转化产物的液相分析见图5。
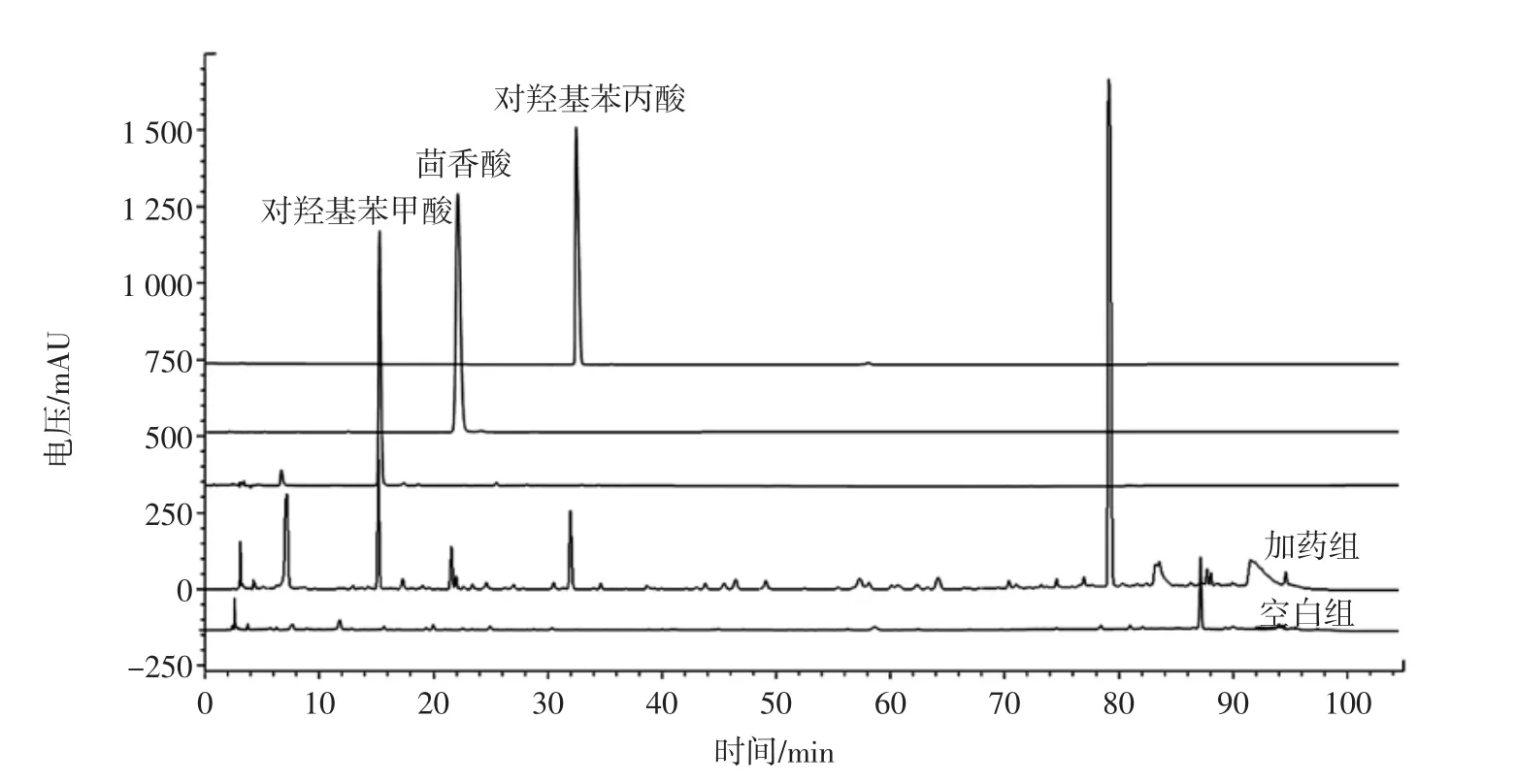
图5 根皮素转化产物的液相分析Fig.5 HPLC analysis of biotransformation compounds from phloretin
3 结论
本试验通过形态学观察、ITS序列分析以及构建系统发育树鉴定并鉴定了实验室保存的AS3.521菌株确实为产黄青霉菌,说明菌株在传代保藏过程中保存良好,未发生变种。本文详细研究了该菌种对根皮素的转化产物。首先利用测定OD值的方法建立了AS3.521产黄青霉菌的生长曲线,选取并确定了最优加入底物时间。通过定量给予培养基、孢子悬液,在28℃、160 r/min条件下培养后通过多种柱色谱结合的方法,共分离得到3个小分子裂解转化产物,本文的研究结果为利用微生物的方法对根皮素进行生物合成奠定基础。
参考文献:
[1]陆晓宇,曹耀英,叶燕霞,等.根皮素的抗炎和免疫抑制作用[J].药学学报,2009,44(5):480-485
[2]李翠苹,余燕影,曹树稳.根皮素乙酰阿魏酸酯的合成及抗氧化活性研究[J].天然产物研究与开发,2012,24(3):316-320
[3]李静,余燕影,曹树稳.根皮素异烟酰基腙的合成、表征及抗氧化活性研究[J].天然产物研究与开发,2011,23(5):824-827
[4]魏丽娜.根皮素胺乙基醚化修饰及其生物活性、安全性研究[M].西安:陕西师范大学,2015
[5]H Overwin,V Wray,B Hofer.Biotransformation of phloretin by amylosucrase yields three novel dihydrochalcone glucosides[J].Journal of Biotechnology,2015,211:103-106
[6]崔雨,赵艳敏,魏小聪,等.根皮素的微生物转化筛选及消耗率的测定[J].食品研究与开发,2016,37(8):166-169
[7]邵建华,张玉伟,王金辉,等.蓬莱菜的化学成分[J].中国药物化学杂志,2009,4(19):288-289
[8]卢丹,刘金平,赵轶卓,等.穿龙薯蓣地上部分的化学成分(Ⅱ)[J].中草药,2010,41(5):700-703
[9]李艳茸,李春,王智民,等.藏药甘青乌头化学成分研究 (Ⅲ)[J].中国中药杂志,2014,39(7):1163-1167
[10]张明星,盛喆.对羟基苯丙酸的制备与应用[J].精细与专用化学品,2010,9(18):48-49
[11]陶军华.生物催化在制药工业的应用[M].北京:化学工业出版社,2010

