国内近10年铁皮石斛多糖研究进展
邹荣灿,王乾,孙俊,刘明月,向准,罗倩
(1.贵州师范大学生命科学学院,贵州贵阳550025;2.贵阳市长坡岭国有林场,贵州贵阳550014;3.贵州大学生命科学学院,贵州贵阳550025;4.贵州省生物研究所,贵州贵阳550009;5.贵州师范学院,贵州贵阳550018)
铁皮石斛(Dendrobium officinale)系兰科(Orchidaceae)石斛属(Dendrobium)多年生草本植物,主要分布于我国安徽、浙江、湖南、云南、广西等地[1],是我国传统名贵中药[2],具有益胃生津、滋阴清热、免疫调节、延缓衰老等功效;用于阴伤津亏,口干烦渴,食少干呕,病后虚热,目暗不明[3]。现代研究表明,铁皮石斛含多糖、生物碱、菲类、联苄类、氨基酸等多种活性成分[4],其中多糖为其主要的活性成分,也是其中含量最高的物质[5],具有降血糖[6]、降血脂[7]、降血压[8]、增强免疫力[9-12]、抗疲劳[13-14]、抗菌[15]、抗肿瘤[16]以及抗氧化[17-18]等作用,因其广泛的生物活性,备受科研工作者的关注,成为当今研究的热点,为今后对铁皮石斛多糖(Dendrobium officinale polysaccharides,DOP)的深度研究及相关药食品开发利用,该文从DOP的提取、含量测定、分离纯化、结构组成及生物活性等方面将近10年来的研究现状进行综述如下:
1 DOP的提取方法
经查阅国内外文献,目前用于DOP的提取方法主要有热水浸提法、超声波辅助提取法、微波辅助提取法、超高压萃取法、闪式提取法及酶提法,针对各提取方法分析其优势和弊端,为今后合理选择DOP的提取方法提供参考。
1.1 热水浸提法
热水浸提法操作简单、成本低廉,是提取DOP常选择的方法,原理是基于多糖易溶于水、不溶或微容于有机溶剂的性质,用高浓度乙醇(80%左右)将其从水中沉淀析出,再用适量无水乙醇或丙酮洗涤,经冷冻干燥后获得粗多糖。基本流程:样品→石油醚脱脂脱色→70%~80%乙醇除杂→蒸馏水浸提→醇沉过夜→离心→冷冻干燥→粗多糖。此法虽操作简单、条件温和、对仪器设备要求低,但提取率易受料液比、提取温度、提取时间等因素的影响。吴迪等[19]以水为溶剂,对影响DOP得率的提取时间、温度及料液比等因素进行了优化研究,结果表明,在料液比1∶120(g/mL)、浸提温度70℃、浸提时间90 min时DOP提取效果最好,提取率为55.2%。黄晓君等[20]同样对DOP的提取工艺进行优化,结果为料液比 1∶30(g/mL)、提取温度 90℃、提取时间2 h,在此条件下多糖得率为30.56%。而秦向东等[21]采用水提醇沉法、正交试验设计法优化DOP的提取工艺,优化后的最佳工艺为:温度95℃,提取时间2.5 h,pH 值 8,料液比 1 ∶40(g/mL),乙醇浓度 90%时,DOP提取率高达60.6%。
1.2 超声波辅助提取法
超声波辅助提取法是基于超声波的机械效应、热效应和空化效应作用,从而增大物质分子运动的频率和速度,提高溶剂穿击力,加快有效物质溶出,从而缩短提取时间。叶余原[22]探索DOP的超声波提取工艺条件,考察提取温度、固液比、提取时间和超声频率4个因素对DOP提取率的影响,结果表明:在1∶30(g/mL)的料液比,50℃超声水浴,45 kHz超声频率,提取1.5 h的条件下,DOP得率为15.3%,同等条件下较常规水提法(10.2%)得率高。此外,韩冉等[23]比较研究了超声辅助提取法和酶解法对DOP得率的影响,结果,超声辅助提取率为(15.78±0.072)%优于酶解法(14.89±0.053)%,超声波辅助提取法具有提取时间短、所需温度低、得率高的特点,但超声波功率不宜过高,否则会对多糖分子结构及特性产生负面影响。
1.3 微波辅助提取法
微波辅助提取法是基于微波穿透能力强的特点,利用物质在微波场中吸收微波能力的差异,使物质的某些区域或某些组分被选择性溶出,陈盛余等[24]分别考察了单因素料液比、微波功率、提取时间和提取温度对DOP得率的影响,结果表明,DOP的最佳提取工艺为料液比为1∶45(g/mL),微波功率900 W,提取时间30 min,提取温度95℃。在此条件下,DOP的提取率达9.77%。该提取工艺简单、快速,可以应用于从铁皮石斛中提取多糖物质,但也存在对溶剂要求严格、局限于实验室研究等弊端。
1.4 超高压萃取法
超高压萃取技术是近几年发展起来的较为先进的提取方法,在发达国家用于食品加工领域的研究已较为普遍,在国内主要用于灭菌、灭活、疫苗制取及中药有效成分提取等方面,将其作为植物多糖提取方法的文献鲜有报道,该法具有得率高、高效、快速、低能耗、绿色环保等优点。纵伟等[25]探讨了DOP的超高压提取工艺及条件优化,将石斛粉碎到80目后,按固液比 1 ∶20(g/mL),采用 300 MPa压力提取 6 min,DOP 的得率达19.27%。
1.5 闪式提取法
闪式提取法是一种用于植物软硬组织破碎的新型提取技术,依靠高速机械剪切力和超动分子渗滤技术,在室温及溶剂存在下数秒内把物料粉碎至细微颗粒,并使有效成分迅速达到组织内外平衡,通过过滤达到提取的目的,具有溶剂用量少、提取时间短、效率高等优点。蔡兴等[26]使用该法对铁皮石斛叶中多糖得率优化,结果表明:最佳提取工艺条件为以25倍量水提取3次,每次90 s,得率为11.52%。李娇等[27]比较了水提法、超声法和闪式提取法对DOP提取率的影响研究,并用正交试验法对最优方法进行条件优化,结果表明,水提法为10.90%,超声法为18.75%,闪式提取法为 24.05%,提取时间分别为 120、60、2 min;与传统水提法和超声法相比,闪式提取具有明显的优越性。
1.6 酶提法
酶提法是利用酶对植物细胞结构的破坏,使细胞内多糖有效的溶出。Hu等[28]利用Box-Behnken设计响应面法优化DOP的酶法提取工艺,结果最佳提取工艺条件为:酶用量3.5 mg/mL,水解温度53℃,反应时间70 min,DOP得率为16.11%,该法有效、稳定、可行。杨岩等[29]通过对酶解温度、酶解时间及加酶量3个因素进行优化,提高DOP提取率;结果显示,在酶解温度为40℃、酶解时间1 h、加酶量2.5%时,多糖提取率为38.4%,而不加酶处理仅为21.7%。尚喜雨[30]同样比较研究了酶法和水提法对DOP提取率的影响,结果酶法为26.49%,水提法为12.07%,酶法比水提法提高了119%。
基于以上不同提取方法,热水浸提法操作简单、成本低廉,但提取率低;超声波辅助提取法用时间短、所需温度低、得率高,但超声波功率不宜过高;微波辅助提取法工艺简单、快速,但局限于实验室研究;超高压萃取法得率高、高效、快速、低能耗、但对仪器设备要求高;闪式提取法和酶提法溶剂用量少、提取时间短、效率高;因原料的产地、处理方法不同,各提取方法提取的多糖得率有一定差异,因此,仅从多糖得率高低来判断提取方法的优越性没多大意义、可从多糖的纯度及活性方面综合考虑,建议研究者应根据自己研究的目的、要求、条件及环境选择适合的方法进行提取。
2 DOP含量测定及分离纯化
2.1 DOP含量测定
当前用于DOP含量测定的方法主要有苯酚-硫酸法和蒽酮-硫酸法,其原理是利用强硫酸水解多糖成单糖,形成糠醛化合物与苯酚或蒽酮形成有色物质,再利用其在可见光区的最大吸收波长作为检测波长进行含量测定。苯酚-硫酸法检测波长(490 nm左右),蒽酮-硫酸法检测波长(620 nm左右),有研究表明,同一样品,采用蒽酮-硫酸法测定多糖的含量高于苯酚-硫酸法,但苯酚-硫酸法的测定结果较为合理,可作为DOP含量测定的首选方法[31]。苯酚-硫酸法测多糖仅在一定时间内稳定性良好,因此,在显色过程中要严格控制好时间、显色剂及硫酸的用量问题,避免外界因素带来的误差。另外DNS比色法(3,5-二硝基水杨酸比色法)、高效液相色谱法也可作为DOP含量的测定方法。为保证测量值更加准确,在测量前需排除去色素,蛋白、单糖、寡糖等干扰。
2.2 DOP分离纯化
经不同方法提取的DOP中常含有蛋白质、色素、单糖、寡糖、脂类等杂质,如何除去这些杂质至关重要,如不除去杂质将影响提取物中多糖的含量及纯度,影响其活性和功效,甚至影响结构鉴定及构效关系的研究。目前,国内外除去DOP中蛋白常用的方法有Sevag法、三氯乙酸法、酶法、酶-Sevag法、等电点法、盐酸法等[32],其中Sevag法的优点是适用范围广、成本低、检测速率快、脱蛋白率高等,缺点是易损失提取物中的多糖影响其活性,另外Sevag法主要是除去游离蛋白,而很难除去与多糖结合的蛋白。三氯乙酸法脱蛋白较完全,但易使多糖降解,且残留的三氯乙酸还会带来安全隐患;DOP脱色的方法有活性炭脱色法、H2O2氧化法、离子交换树脂法等。较常用的是活性炭脱色,因为活性炭为黑色多孔性粉末或颗粒,无嗅无味,具有较大的表面积,吸附能力强,脱色成本低等特点,李国涛等[33]探讨DOP活性炭脱色工艺,以脱色率和多糖保留率为指标,结果表明:活性炭吸附法对DOP具有良好的脱色效果,最佳工艺条件为:温度为70℃,活性炭使用量为体积分数0.5%,搅拌60 min,脱色率为71.64%,多糖保留率为87.29%;严婧等[34]以总多糖保存率和蛋白脱除率为评价指标,通过单因素试验比较Sevage法、木瓜蛋白酶法、胰蛋白酶法和胰蛋白酶联合Sevage法,结果表明:胰蛋白酶联合Sevage法具有较高的总多糖保存率及蛋白脱除率,最佳工艺条件为酶解时间1.5 h,酶用量0.21 g/mL,酶解温度63.25℃,总多糖溶液-Sevage试剂体积比(4.27∶1),蛋白脱除率(87.15±7.93)%,总多糖保存率(81.32±8.54)%。
2.3 DOP结构组成
要进一步探究DOP的组成、分子质量、结构特征,在脱色脱蛋白的基础上还需进一步分离纯化,常用的分离纯化方法有离子交换树脂法、凝胶过滤柱色谱法、亲和色谱法、膜分离法。分析DOP成分是研究其生物活性的重要前提,王琳炜等[35]采用传统的水提醇沉法提取霍山DOP,经酶-Sevag法脱蛋白,再经DEAE-52纤维素柱、SephadexG-100凝胶柱分离纯化得到石斛多糖组分DOPA-1,单糖组成为甘露糖、葡萄糖和半乳糖,其物质的量比为1∶0.42∶0.27。龚庆芳等[36]发现构成DOP的单糖不仅包括甘露糖、葡萄糖和半乳糖,还包括阿拉伯糖,其摩尔比为3.28∶31.83∶1.51∶1.00。罗秋莲等[37]利用DEAE-52纤维素柱及Sephadex G-100对铁皮石斛粗多糖进一步纯化得4个组分,其中DOP1由甘露糖、葡萄糖醛酸和葡萄糖组成摩尔比为3.42 ∶0.11 ∶1.08;DOP2、DOP3、DOP4 均由甘露糖和葡萄糖组成摩尔比分别为 8.56 ∶1.12;4.91 ∶1.0;3.61 ∶1.01。而宾宇波等[38]研究发现 DOP 由 D-甘露糖、L(+)-鼠李糖和D-葡萄糖组成,其摩尔比为1.936∶0.856∶0.691。Luo等[39]研究发现DOP由甘露糖、葡萄糖、阿拉伯糖、半乳糖组成,摩尔比为6.2∶2.3∶2.1∶0.1。各文献报道的DOP组成及摩尔比存有一定差异,可能原因是因原料的产地、加工及纯化等方式的不同所致(见表1)。
3 DOP的生物活性
铁皮石斛被誉为“救命仙草”和药界的“大熊猫”,斛中的极品,现代研究表明DOP为其主要的功效成分之一,在降血糖、降血脂、增强免疫力、抗氧化、抗疲劳、抗菌及抗癌等方面具有显著疗效,另外DOP还具有促毛发生长、改善肺功能和炎症、增强胃肠道转运率等作用(见表2),对于研发更多DOP的药物制剂和保健产品,具有重要的经济价值和市场前景。
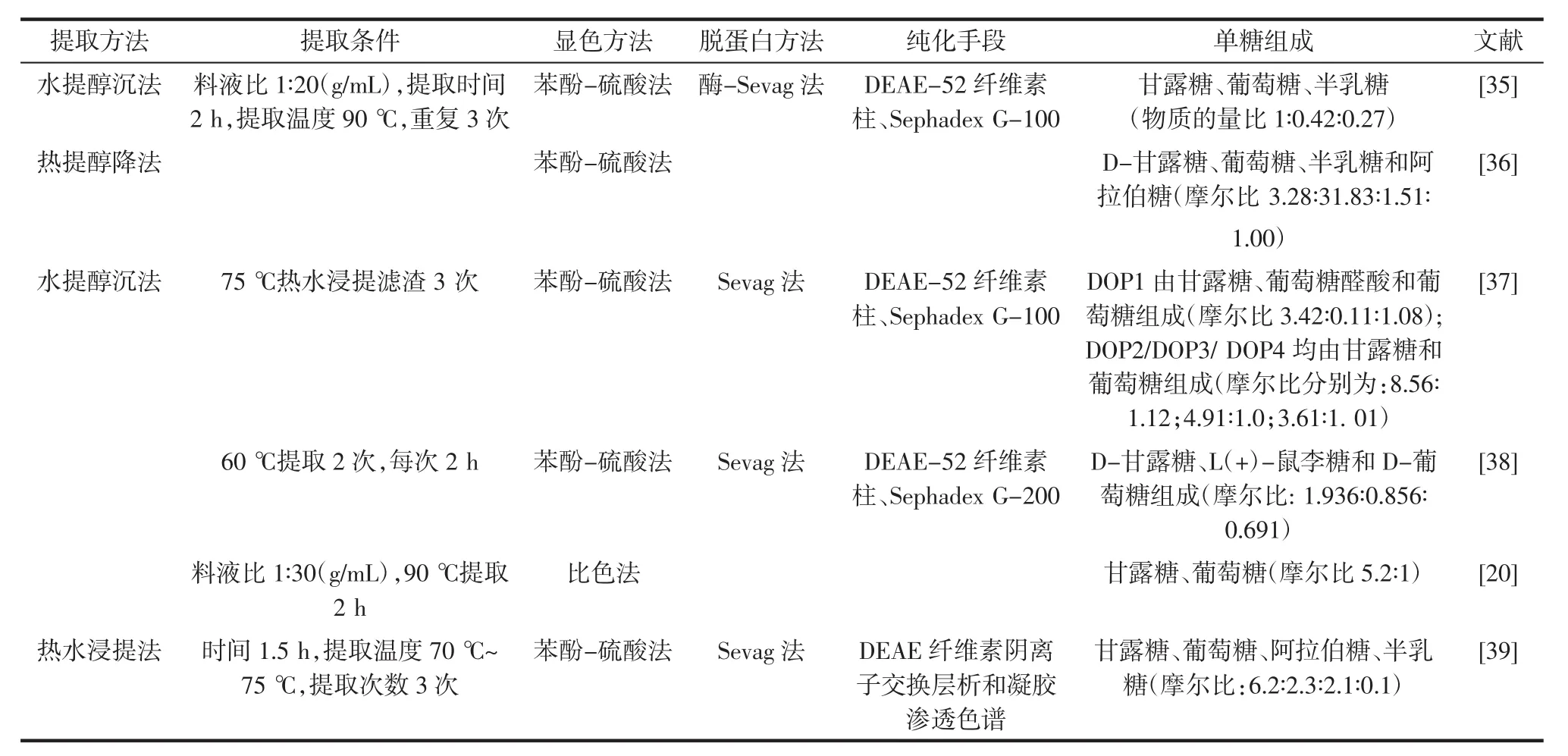
表1 DOP的提取、分离纯化及单糖组成Table 1 The extraction,isolation and monosaccharide composition of Dendrobium officinale polysaccharides

表2 铁皮石斛多糖的生物活性Table 2 The biological activities of polysaccharide from Dendrobium officinale
4 展望
综上所述,DOP的提取方法有热水浸提法、超声波辅助提取法、微波辅助提取法、闪式提取法、超高压萃取法及酶提法;含量测定方法有苯酚-硫酸法、蒽酮-硫酸法、3,5-二硝基水杨酸比色法、高效液相色谱法;分离纯化方法有离子交换树脂法、凝胶过滤柱色谱法、亲和色谱法、膜分离法。DOP在降血糖、降血脂、增强免疫力、抗氧化、抗疲劳、抗菌及抗癌等方面具有显著疗效,另外还具有促进毛发生长、改善肺功能和炎症、增强胃肠道转运率等作用。
随着科研工作者对DOP的日益深入研究,在DOP的提取、含量测定、分离纯化、结构组成及生物活性等方面做了大量的研究工作,已取得了一定的成效。但仍存在一些问题亟须解决:①DOP的最适提取方法目前尚无定论,目前应用较多的提取方法是热水浸提法,随着科学技术的不断进步,超声波辅助提取法、微波辅助提取法、超高压萃取法、闪式提取法及酶提法等也相继应用于DOP的提取,这些方法的应用大大缩短了提取时间,更易获得目标产物,还有一些较为先进的方法尚未用于DOP的提取,如超临界流体萃取、双水相萃取等,这些方法能否提高DOP的得率还有待进一步研究。因DOP的提取方法较多,各方法均有利弊,建议研究者跟据研究的目的、要求和条件对其合理选择。②结构决定性质,对DOP的结构研究还处在一级结构中单糖的组成及分子量大小等阶段,对于高级结构的研究进一步揭示DOP构效关系、代谢机理及作用机制是目前仍需迫切解决的问题。③DOP的药理活性已被大量实验证实,但都局限于粗提物,如何开发符合临床需求的药物制剂和相关保健品的开发,有待进一步研究。
参考文献:
[1]吴建,王建方,方玲,等.国内铁皮石斛研究概况[J].中国药学杂志,2013,48(19):1610-1613
[2]韩晓红,段春红,阎贺静,等.铁皮石斛原球茎液体悬浮培养研究进展[J].安徽农业科学,2010,38(20):10570-10572
[3]李桂锋,李进进,许继勇,等.铁皮石斛研究综述[J].中药材,2010,33(1):150-153
[4]张光浓,毕志明,王峥涛,等.石斛属植物化学成分研究进展[J].中草药,2003,34(6):附5-附8
[5]陈超琴,蒋丽华,赵黎明,等.石斛多糖的研究进展[J].食品工业科技,2012,2(2):441-445
[6]汤志远,周晓宇,冯健,等.铁皮石斛多糖降血糖作用研究[J].南京中医药大学报,2016,32(6):566-570
[7]季爱兵,曾胤,彭文书,等.铁皮石斛水提物对高脂血症小鼠血脂和血糖的影响[J].食品研究与开发,2017,38(3):176-180
[8]吴人照,杨兵勋,李亚平,等.铁皮石斛多糖对SHR-sp大鼠抗高血压中风作用的实验研究[J].中国中医药科技,2011,18(3):204-205,210
[9]童微,余强,李虎,等.铁皮石斛多糖化学修饰及其对免疫活性的影响[J/OL].食品科学,2017,38(7):155-160
[10]Xie S Z,Liu B,Zhang D D,et al.Intestinal immunomodulating activity and structural characterization of a new polysaccharide from stems of Dendrobium officinale[J].Food Funct,2016,7(6):2789-2799
[11]黄杰,章莹,严婧,等.铁皮石斛多糖对脂多糖诱导的巨噬细胞免疫调节作用[J].中国药学杂志,2017,52(7):548-552
[12]龙承星,贺璐,郭艳芳,等.铁皮石斛多糖对脾虚便秘小鼠免疫、肠道微生物及酶活性的影响[J].天然产物研究与开发,2017,29(6):1020-1024,1034
[13]封毅,黄茂康,叶建保,等.铁皮石斛提高小鼠运动能力、抗疲劳能力和免疫水平的量效关系分析[J].南方农业学报,2014,45(6):1089-1093
[14]Wei W,Li Z P,Zhu T,et al.Anti-Fatigue Effects of the Unique Polysaccharide Marker of Dendrobium officinale on BALB/c Mice[J].Molecules,2017,22(1):1-12
[15]王玲,唐德强,王佳佳,等.铁皮石斛原球茎与野生铁皮石斛多糖的抗菌及体外抗氧化活性比较 [J/OL].西北农林科技大学学报(自然科学版),2016,44(6):167-172,180
[16]张红玉,戴关海,马翠,等.铁皮石斛多糖对S180肉瘤小鼠免疫功能的影响[J].浙江中医杂志,2009,44(5):380-381
[17]安全,许丹妮,李光敏,等.微生物发酵法制备铁皮石斛多糖及抗氧化活性的研究[J].湖北农业科学,2017,56(10):1934-1937
[18]王再花,章金辉,李杰,等.3种药用石斛多糖的抗氧化活性比较研究[J].华南师范大学学报(自然科学版),2015,47(5):65-70
[19]吴迪,蔡成岗,沙如意.铁皮石斛多糖提取工艺优化研究[J].浙江科技学院学报,2016,28(6):444-449
[20]黄晓君,聂少平,王玉婷,等.铁皮石斛多糖提取工艺优化及其成分分析[J].食品科学,2013,34(22):21-26
[21]秦向东,宁玲,闫小颜,等.棒节石斛中的多糖分布及提取工艺研究[J].云南农业大学学报,2011,26(3):430-433
[22]叶余原.超声法提取铁皮石斛多糖工艺的研究[J].中药材,2009,32(4):617-620
[23]韩冉,李卿,王汝华,等.铁皮石斛多糖提取工艺优化及分子量分析[J].农产品加工,2017(17):28-32
[24]陈盛余,赵丹丹,谢瑜,等.铁皮石斛多糖的微波辅助提取工艺研究[J].食品研究与开发,2017,38(6):49-52
[25]纵伟,李翠翠.石斛多糖超高压提取工艺条件的优化[J].郑州轻工业学院学报(自然科学版),2012,27(4):36-39
[26]蔡兴,王美娜,梁权辉,等.响应面法优化铁皮石斛叶闪式提取工艺[J].亚太传统医药,2016,12(7):48-52
[27]李娇,荣永海,荣龙.闪式提取铁皮石斛多糖[J].中药材,2013,36(9):1524-1527
[28]Hu J M,Li J L,Feng P,Optimization of enzymatic extraction of polysaccharide from Dendrobium officinale by box-Behnken design and response surface methodology[J].Zhong Yao Cai,2014,3(1):130-133
[29]杨岩,李利君,吴妙灵,等.酶法提取铁皮石斛多糖工艺优化及对挥发性成分的影响研究[J].激光生物学报,2017,26(3):274-280,216
[30]尚喜雨.水提法:酶法提取铁皮石斛多糖的比较研究[J].安徽农业科学,2010,38(18):9787-9788
[31]范传颍,陶正明,吴志刚.苯酚硫酸法与蒽酮硫酸法测定铁皮石斛中多糖含量的比较[J].浙江农业科学,2013(7):799-801
[32]殷洪梅,尚强,萧伟.金银花多糖脱蛋白方法的研究[J].中草药,2010,41(4):584-586
[33]李国涛,杨浩,伏秦超.铁皮石斛多糖活性炭脱色研究[J].农技服务,2017,34(5):31-33
[34]严婧,夏伯候,章莹,等.响应面法优选铁皮石斛总多糖脱蛋白工艺[J].中国实验方剂学杂志,2016,22(17):19-22
[35]王琳炜,欧阳臻,张碧娟,等.霍山铁皮石斛多糖的脱蛋白工艺及结构分析[J].食品科学,2017,38(12):164-170
[36]龚庆芳,周浩,王新桂,等.7种石斛多糖质量分数的测定及单糖组成分析[J].食品科技,2013,38(3):172-175
[37]罗秋莲,唐专辉,张雪凤,等.铁皮石斛多糖的分离纯化及其结构研究[J].广西大学学报(自然科学版),2016,41(6):2060-2066
[38]宾宇波,王亚芸,安欣,等.铁皮石斛多糖分离纯化及单糖组成测定[J].食品工业科技,2014,35(4):122-125
[39]Luo Q L,Tang Z H,Zhang X F,et al.Chemical properties and antioxidant activity of a water-soluble polysaccharide from Dendrobium officinale[J].Int J Biol Macromol,2016,89:219-227
[40]刘亚娟,王诗豪,张铭,等.铁皮石斛多糖抗癌及免疫活性研究[J].广州化工,2014,42(10):58-60,65
[41]肖胤,肖林,杨军,等.铁皮石斛多糖的提取工艺及其治疗原发性干燥综合征疗效观察[J].临床口腔医学杂志,2017,33(6):363-365
[42]陈健,戚辉,李金标,等.铁皮石斛多糖促进毛发生长的实验研究[J].中国中药杂志,2014,39(2):291-295
[43]Song T H,Chen X X,Sydney Chi Wai Tang,et al.Dendrobium officinale polysaccharides ameliorated pulmonary function while inhibiting mucin-5AC and stimulating aquaporin-5 expression[J].Journal of Functional Foods,2016,21:359-371
[44]Luo D D,Qu C,Lin G S,et al.Character and laxative activity of polysaccharides isolated from Dendrobium officinale[J].Journal of Functional Foods,2017,34:106-117

