4种复合壁材对干酪乳杆菌包埋效果的影响
敬雪莲 曾 月 尹小琴 蓝绪悦 李慧霖 陈姝娟
(四川农业大学食品学院,四川 雅安 625014)
干酪乳杆菌作为三大益生菌之一,其益生作用越来越引起人们的重视[1]。研究[2]报道干酪乳杆菌在降低胆固醇、抑制癌症、调节机体免疫功能及缓解乳糖不耐症等方面有重要作用。但在食品加工贮藏及人体胃肠道中的环境均会影响其活性及数量,以致无法在肠道中发挥其作用,因此对干酪乳杆菌的有效保护是发挥其益处的前提[3-6]。
目前微胶囊技术正逐步广泛应用在食品工业,解决了食品中许多技术性问题,在食品工业中制备微胶囊的主要技术有喷雾干燥法、乳化法、挤压法等[7-8]。利用微胶囊技术包埋益生菌,可以提高其在不良环境中的抗性,以延长活益生菌产品的货架期[9]。目前利用内源乳化法包埋益生菌的研究较多,其壁材选择多为蛋白质、壳聚糖及海藻酸钠等单一壁材[10-12]。通过内源乳化法以蛋白质海藻酸钠做复合壁材包埋干酪乳杆菌的研究不多,但以此制备的微胶囊形态及粒径分布均一、安全可食用,在食品加工中应用前景广泛,目前有对乳清蛋白海藻酸钠做复合壁材包埋干酪乳杆菌的研究,张国芳等[13]曾利用内源乳化法以海藻酸钠与乳清蛋白为复合壁材制备了干酪乳杆菌微胶囊,但并未探讨复合壁材对干酪乳杆菌包埋效果的影响。本试验拟探究以乳清蛋白、大豆分离蛋白、酪蛋白及明胶分别与海藻酸钠做复合壁材包埋干酪乳杆菌的包埋效果,从包埋率、微胶囊形态、在模拟胃肠液中对干酪乳杆菌的保护情况分别对比4种复合壁材包埋干酪乳杆菌的效果,分析4种复合壁材微胶囊各自的优势及缺点,为选择合适复合壁材提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种与培养基
干酪乳杆菌(Lactobacilluscasei):来源于干酪乳杆菌菌粉,常州益菌加生物科技有限公司;
MRS琼脂培养基:加入2.0%左右的琼脂于MRS液体培养基中即得;
增殖培养基:蛋白胨1.2%、酵母提取物0.6%、牛肉膏0.6%、葡萄糖1.8%、乙酸钠0.5%、柠檬酸铵0.125%、Tween-80 0.1%、硫酸镁0.058%、硫酸锰0.005%、磷酸氢二钾0.2%,调节pH至6.5[14]。
1.1.2 试剂
胆盐、磷酸二氢钠、磷酸氢二钠、氯化钠、span-80、冰醋酸、碳酸钙、乙酸钠、海藻酸钠、酪蛋白、明胶:均为国产分析纯;
大豆油:食品级,黑龙江九三油脂有限责任公司;
乳清蛋白、大豆分离蛋白:食品级,安阳市齐天生物技术有限公司;
胃蛋白酶:USP级,1∶30 000,上海源叶生物科技有限公司;
胰蛋白酶:活性≥250 USP u/mg,上海瑞永生物科技有限公司。
1.1.3 仪器与设备
恒温培养箱:DHP-9162型,上海一恒科技有限公司;
高压蒸汽灭菌锅:FD36A/FD36R型,致微(厦门)仪器有限公司;
超净工作台:SW-CJ-1FD/1F型,上海博迅医疗生物仪器股份有限公司;
冷冻离心机:Contfuge Stratos型,美国Thermo Fisher公司;
激光粒度分析仪:RISE-2006型,济南润之科技有限公司。
1.2 方法
1.2.1 菌悬液的制备 将干酪乳杆菌菌粉按体积分数为2%的接种量接种于增殖培养基中,在恒温培养箱中37 ℃下培养24 h,活化2~3次后,离心(8 000 r/min,4 ℃,15 min),收集菌体并用0.9%无菌生理盐水将菌体洗涤2遍,重悬于10 mL无菌生理盐水中,制得一定浓度的菌悬液。
1.2.2 主要溶液的配制
(1) 微胶囊解囊液:准确配制0.1 mol/L磷酸盐缓冲液,调节pH至7.0,121 ℃灭菌15 min后备用[15]。
(2) 模拟人工胃液的配制:用浓盐酸溶液将0.2%的NaCl溶液的pH值调节到2.0,加入一定量的胃蛋白酶并使其终浓度为0.3 g/L,再用0.22 μm的膜过滤灭菌,现配现用[16]。
(3) 模拟人工肠液的配制:加入一定量的胰蛋白酶和胆盐于磷酸缓冲液中,使它们的终浓度分别为1.0,4.5 g/L,用0.1 mol/L的NaOH溶液将其pH值调至7.4,再用0.22 μm的膜过滤灭菌,现配现用[16]。
1.2.3 内源乳化法制备干酪乳杆菌微胶囊工艺流程 内源乳化法制备微胶囊的过程参照张国芳等[13]报道的方法,修改如下:将10 mL制得的一定浓度的菌悬液与20 mL一定浓度的海藻酸钠和蛋白溶液混合,再将一定量的碳酸钙粉末均匀分散在该混合液,再将此混合液乳化到含有体积分数1.0% Span-80大豆油中(300 r/min,15 min)后,加入200 μL冰醋酸继续搅拌,以促进冰醋酸和碳酸钙的充分接触反应,30 min后,加入120 mL pH为5.5的醋酸盐缓冲液并缓慢搅拌,待凝胶成型的微胶囊都沉降到醋酸盐溶液底部后,吸去油相,收集微胶囊,用0.9%生理盐水洗涤3次左右,去除剩余油相和表面菌体。最后将制得的微胶囊放在4 ℃冰箱保存。
1.2.4 微胶囊包埋工艺单因素试验
(1) 海藻酸钠质量分数:在海藻酸钠蛋白质含量比1∶1,海藻酸钠碳酸钙含量比3∶1,油水体积比3∶1的条件下,改变海藻酸钠质量分数(1%,2%,3%,4%,5%),以微胶囊的包埋率为指标,得到海藻酸钠的最佳添加量。
(2) 海藻酸钠蛋白含量比:在海藻酸钠质量分数为2%,海藻酸钠碳酸钙含量比3∶1,油水体积比3∶1的条件下,改变海藻酸钠蛋白含量比(1∶5,1∶3,1∶1,3∶1,5∶1),以微胶囊的包埋率为指标,得到最佳海藻酸钠蛋白含量比。
(3) 油水体积比:在海藻酸钠质量分数2%,海藻酸钠蛋白质含量比1∶1,海藻酸钠碳酸钙含量比3∶1的条件下,改变油水体积比(1∶1,3∶1,5∶1,7∶1,8∶1),以微胶囊的包埋率为指标,确定最佳油水体积比。
(4) 海藻酸钠碳酸钙含量比:在海藻酸钠质量分数2%,海藻酸钠蛋白含量比1∶1,油水体积比3∶1的条件下,改变海藻酸钠碳酸钙含量比(1∶1,1.5∶1,3∶1,6∶1,15∶1),以微胶囊的包埋率为指标,确定最佳海藻酸钠碳酸钙含量比。
1.2.5 微胶囊的形态分布及粒度检测 在单因素试验中确定的最佳包埋条件下制得干酪乳杆菌微胶囊,分别少量蘸取4种微胶囊涂于载玻片上,用光学显微镜在40,100倍下观察微胶囊的形态分布情况;并用激光粒度分析仪测定4种微胶囊的粒度大小,分别称取0.5 g微胶囊,加入9.5 mL蒸馏水,混合均匀后,加入到激光粒度分析仪测试容器中,进行粒度检测。
1.2.6 微胶囊在模拟胃肠液中耐受性试验 在单因素试验中确定的最佳包埋条件下制得干酪乳杆菌微胶囊,将0.5 g微胶囊均匀地分散到4.5 mL在37 ℃下预热的人工模拟胃液,将此混合液在控温振荡器37 ℃,100 r/min下震荡。在0,30,60,120 min时取样,并对微胶囊进行破碎以对活干酪乳杆菌进行计数[13]。
1.2.7 微胶囊在模拟肠液中的耐受性试验 在单因素试验确定的最佳包埋条件下制得干酪乳杆菌微胶囊,将0.5 g微胶囊均匀地分散到4.5 mL在37 ℃下预热的人工模拟肠液,将此混合液在控温振荡器37 ℃,100 r/min下震荡。在0,30,60,120 min时取样,对干酪乳杆菌直接进行计数[13]。
1.3 分析方法
1.3.1 菌落计数 按GB 4789.35—2010中MRS固体培养基平板倾注法执行。
1.3.2 微胶囊包埋率的测定 准确称取0.5 g微胶囊,加入到4.5 mL磷酸缓冲液(0.1 mol/L,pH 7)中,用磁力搅拌器搅拌10 min,取0.5 mL样品稀释到适宜浓度后涂布,于37 ℃ 培养箱培养48 h后,菌落计数,得微胶囊中包埋的活菌数(CFU/mL)[15],按式(1)计算包埋率。

(1)
2 结果与统计
2.1 单因素试验
2.1.1 海藻酸钠质量分数对微胶囊包埋率的影响 由图1可看出,以乳清蛋白、大豆分离蛋白、酪蛋白及明胶分别与海藻酸钠做复合壁材通过内源乳化法包埋干酪乳杆菌,微胶囊的包埋率均随海藻酸钠质量分数的增加而增大,当海藻酸钠质量分数为2%时,4种微胶囊的包埋率最大,当海藻酸钠的浓度继续变大时,4种微胶囊的包埋率反而下降。可能是海藻酸钠的黏度随浓度的增加而增大,浓度较高时,其黏度较大,使菌体不能均匀分散,且形成的微胶囊壁过厚;但在海藻酸钠浓度较低时,形成的微胶囊壁过薄导致机械强度不好,从而影响包埋效果。
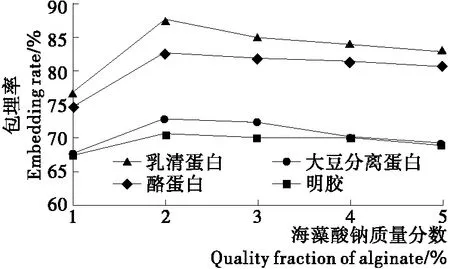
图1 海藻酸钠质量分数对微胶囊包埋率的影响
2.1.2 海藻酸钠蛋白质含量比对微胶囊包埋率的影响 由图2可以看出,以乳清蛋白、大豆分离蛋白、酪蛋白及明胶分别与海藻酸钠做复合壁材通过内源乳化法包埋干酪乳杆菌,微胶囊的包埋率均随海藻酸钠蛋白含量比的增加而增大,当海藻酸钠与蛋白质的含量比为1∶1时,4种微胶囊的包埋率最大,比例继续增加时,微胶囊的包埋率反而下降。可能是海藻酸钠与蛋白质是作为复合壁材去弥补单一壁材的缺陷,某一种成分过高或过低,都会影响微胶囊的包埋率。

图2 海藻酸钠蛋白质含量比对微胶囊包埋率的影响
2.1.3 油水体积比对微胶囊包埋率的影响 由图3可以看出,以乳清蛋白、大豆分离蛋白、酪蛋白及明胶分别与海藻酸钠做复合壁材通过内源乳化法包埋干酪乳杆菌,微胶囊的包埋率均随油水体积比的增加而增大,其中以乳清蛋白、酪蛋白与海藻酸钠做复合壁材的微胶囊在油水体积比为3∶1时,微胶囊的包埋率最大,以大豆分离蛋白、明胶与海藻酸钠做复合壁材的微胶囊分别在油水体积比为5∶1,7∶1时,微胶囊的包埋率最大,此后随着油水体积比的增加包埋率反而下降。可能是当油相不足时,会导致微胶囊间粘连,从而影响包埋率,当油水体积比变大时,由于分散空间相对较大,促进大液滴的形成,但微胶囊的粒径过大不利于在实际中应用。

图3 油水体积比对微胶囊包埋率的影响
2.1.4 海藻酸钠碳酸钙含量比对微胶囊包埋率的影响 由图4可以看出,以乳清蛋白、大豆分离蛋白、酪蛋白及明胶分别与海藻酸钠做复合壁材通过内源乳化法包埋干酪乳杆菌,微胶囊的包埋率均随海藻酸钠碳酸钙含量比的增加而增大,其中以乳清蛋白、明胶及大豆分离蛋白分别与海藻酸钠做壁材的微胶囊在海藻酸钠碳酸钙含量比为3∶1时包埋率最大,以酪蛋白与海藻酸钠做复合壁材的微胶囊在海藻酸钠碳酸钙含量比6∶1时包埋率最大,此后随着海藻酸钠碳酸钙质量比的增加包埋率反而下降,可能是随着碳酸钙加入量的增多,钙离子的浓度逐渐变大,从而促进了钙离子和海藻酸钠之间的凝胶化反应,使形成的微胶囊致密性好,耐受性强,但是随着碳酸钙的添加,碳酸钙浓度增大,溶液的表面张力增大,导致形成的微胶囊高度收缩,且溶液中由于残留着大量的不溶性的钙盐,使溶液密度增加,从而使微胶囊的包埋率降低。

图4 海藻酸钠碳酸钙含量比对微胶囊包埋率的影响
Figure 4 The effect of alginate and calcium carbonate content ratio on the microcapsules’embedding rate
通过单因素试验得到以乳清蛋白海藻酸钠做复合壁材包埋干酪乳杆菌的最佳条件为海藻酸钠质量分数2%,海藻酸钠蛋白质含量比1∶1,海藻酸钠碳酸钙含量比3∶1,油水体积比3∶1,在此条件下包埋率可达87.50%;以大豆分离蛋白海藻酸钠做复合壁材包埋干酪乳杆菌的最佳条件为海藻酸钠质量分数2%,海藻酸钠蛋白质含量比为1∶1,海藻酸钠碳酸钙含量比3∶1,油水体积比5∶1,在此条件下包埋率可达78.12%;以酪蛋白海藻酸钠做复合壁材包埋干酪乳杆菌的最佳条件为海藻酸钠质量分数2%,海藻酸钠蛋白质含量比为1∶1,海藻酸钠碳酸钙含量比6∶1,油水体积比3∶1,在此条件下包埋率可达83.19%;以明胶海藻酸钠做复合壁材包埋干酪乳杆菌的最佳条件为海藻酸钠质量分数2%,海藻酸钠蛋白质含量比为1∶1,海藻酸钠碳酸钙含量比3∶1,油水体积比7∶1,在此条件下包埋率可达76.58%。
2.2 壁材对微胶囊外观形态的影响
2.2.1 乳清蛋白复合壁材对微胶囊外观形态的影响 由图5 可看出,以乳清蛋白海藻酸钠为壁材得到的微胶囊其形状分布较均一,为球形且未出现微胶囊间粘壁现象,达到预期要求。

1. 包埋有菌体的微胶囊 2. 未包埋有菌体的微胶囊
Figure 5 Optical microphotograph of microcapsules with whey protein and alginate
2.2.2 大豆分离蛋白复合壁材对微胶囊外观形态的影响 由图6可以看出,微胶囊形状不一,且出现破壁现象,微胶囊之间出现粘连,因此微胶囊的成型性不理想。
2.2.3 酪蛋白复合壁材对微胶囊外观形态的影响 由图7可以看出,以酪蛋白海藻酸钠为壁材得到的微胶囊其形状不一,微胶囊间出现粘连现象。
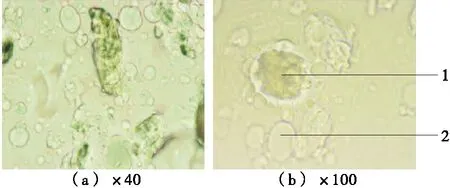
1. 包埋有菌体的微胶囊 2. 未包埋有菌体的微胶囊
Figure 6 Optical microphotograph of microcapsules with soy protein isolates and alginate

1. 未包埋有菌体的微胶囊 2. 包埋有菌体的微胶囊
2.2.4 明胶复合壁材对微胶囊外观形态的影响 由图8可以看出,以明胶海藻酸钠为复合壁材得到的微胶囊形状较均一,未出现微胶囊间的粘壁现象,但微胶囊间粒径大小相差较大。

1. 包埋有菌体的微胶囊 2. 未包埋有菌体的微胶囊
Figure 8 Optical microphotograph of microcapsules with gelatin and alginate
2.2.5 微胶囊粒度检测结果 由表1可以看出以明胶与海藻酸钠做复合壁材包埋干酪乳杆菌时,微胶囊的粒度最小,其他3种微胶囊的粒度均较大,由于微胶囊的粒度较大时,在加工过程中会对产品品质产生不利影响,如产品组织状态、口感等,因此从粒度大小来看明胶复合壁材较其他3种微胶囊效果较好,更有利于在食品加工中的应用。

表1 4种微胶囊粒度检测结果
2.3 干酪乳杆菌微胶囊在模拟胃肠液中的耐受性
2.3.1 干酪乳杆菌微胶囊在模拟胃液中的耐受性 从图9可以看出,未包埋的干酪乳杆菌和用4种不同复合壁材包埋的干酪乳杆菌在模拟胃液中,随着时间的延长,活菌数都有下降。以乳清蛋白、大豆分离蛋白、酪蛋白及明胶为复合壁材包埋的干酪乳杆菌在模拟胃液中2 h时其存活率分别为81.71%,90.39%,85.67%,87.87%,未包埋的干酪乳杆菌其存活率为56.51%,由此可看出相比于未包埋的干酪乳杆菌,这4种不同壁材的微胶囊都提高了干酪乳杆菌在胃液中的存活率,其中以大豆分离蛋白海藻酸钠为复合壁材的微胶囊在模拟胃液中对干酪乳杆菌的保护效果最佳。

图9 干酪乳杆菌微胶囊在模拟胃液中的存活情况
Figure 9 The survival rate of microencapsulatedLactobacilluscaseiin simulated gastric juice
2.3.2 干酪乳杆菌微胶囊在模拟肠液中的耐受性 从图10可以看出,4种不同的蛋白分别与海藻酸钠做复合壁材的微胶囊在30 min时,在模拟的肠液中4种微胶囊释放的活菌数最多,其中酪蛋白复合壁材微胶囊在30 min时已基本释放完菌体;大豆分离蛋白复合壁材微胶囊、明胶复合壁材微胶囊、乳清蛋白复合壁材微胶囊在60 min时,已基本释放完菌体。由此可知4种不同复合壁材的微胶囊都有较好的肠液溶解性,使得包埋于该微胶囊中的活菌可以定植于肠道,进而发挥其益生作用。

图10 干酪乳杆菌微胶囊在模拟肠液中的活菌数变化
Figure 10 The amount of microencasulatedLactobacilluscaseiin simulated intestinal juice
3 结论
4种复合壁材通过内源乳化法制备的干酪乳杆菌微胶囊,在包埋率、形态分布、粒度大小及模拟胃肠液中耐受性四方面各有优缺点,乳清蛋白复合壁材微胶囊在包埋率及微胶囊形态分布方面优于其他3种微胶囊,明胶复合壁材微胶囊的粒度大小较其他3种小,大豆分离蛋白复合壁材微胶囊在模拟胃液中对菌体的保护效果优于其他3种微胶囊,酪蛋白复合壁材微胶囊在模拟肠液中对菌体的溶出情况优于其他3种微胶囊。本次试验对基于内源乳化法包埋干酪乳杆菌的蛋白质复合壁材的选择进行了深入的探究,补充和完善了张国芳等[13]以乳清蛋白复合壁材利用内源乳化法制备干酪乳杆菌微胶囊。由于不同蛋白质复合壁材对干酪乳杆菌包埋效果的影响不同,根据不同蛋白质复合壁材在包埋率、模拟胃肠液中的耐受性、微胶囊粒度大小及显微结构四方面对包埋效果的不同影响,可根据在具体食品加工及应用中的不同需求选择更有效的包埋壁材,丰富了复合壁材选择依据,使内源乳化法更加广泛地应用于益生菌的包埋中。但本次试验探究了4种蛋白质复合壁材对干酪乳杆菌的包埋效果的影响,而蛋白质复合壁材种类繁多,对此的研究还不够全面,今后可继续就其他蛋白质复合壁材对干酪乳杆菌包埋效果的影响进行探究。
[1] 曹瑞博, 汪建明. 干酪乳杆菌的功能性研究及其应用[J]. 中国食品添加剂, 2009(S1): 169-172.
[2] SANDERS M E, GUARNER F, GUERRANT R, et al. An update on the use and investigation of probiotics in health and disease[J]. Gut, 2013, 62(5): 787-796.
[3] SHINH S, LEE J H, PESTKA J J, et al. Viability of bifidobacteria in commercial dairy products during refrigerate[J]. Journal of Food Protection, 2000, 63(3): 327-331.
[4] ZOU Qiang, LIU Xiao-ming, ZHAO Jian-xin, et al. Microencapsulation of Bifidobacterrium bifidum F-35 in whey protein-based microcapsules by transglutaminase-induced gelation[J]. Journal of Food Science, 2012, 77(5): 270-277.
[5] PIMENTELGONZALEZ D J, CAMPOSMONTIEL R G, LOBATOCALLEROS C, et al. Encapsulation of lactobacillus rhamnosus in double emulsion formulated with sweet whey as emulsifier and survival in simulated gastrointestinal conditions[J]. Food Research International, 2009, 42(2): 292-297.
[6] 邹盈, 魏敏, 谢琪, 等. 副干酪乳杆菌海藻酸钠微胶囊包埋工艺[J]. 食品与机械, 2015, 31(2): 227-231.
[7] 蔡茜彤, 段小明, 冯叙桥, 等. 微胶囊技术及其在食品添加剂中的应用与展望[J]. 食品与机械, 2014, 30(4): 247-251, 270.
[8] 张韻慧, 任斯嘉, 胡文文, 等. 喷雾干燥技术对食品微胶囊性质影响的研究进展[J]. 食品与机械, 2013, 29(2): 214-217.
[9] 张慧娟, 郝一铭, 王静, 等. 微生物包埋技术的研究进展[J]. 食品工业科技, 2016, 37(1): 381-386.
[10] 邹强, 袁鹏, 刘小鸣, 等. 不同蛋白质包埋壁材对益生菌在人体模拟胃液中的保护效果[J]. 食品工业科技, 2012, 33(13): 60-63.
[11] 邹强, 梁华忠, 龚春雪, 等. 海藻酸钠和乳清蛋白作为益生菌包埋壁材的比较[J]. 食品科学, 2014, 35(15): 207-211.
[12] 何荣军, 杨爽, 孙培龙, 等. 海藻酸钠/壳聚糖微胶囊的制备及其应用研究进展[J]. 食品与机械, 2010, 26(2): 166-169, 173.
[13] 张国芳, 王婷婷, 刘丽波, 等. 内源乳化法制备干酪乳杆菌微胶囊[J]. 中国乳品工业, 2017, 45(3): 15-20.
[14] 金桩, 彭健, 胡新文, 等. 干酪乳杆菌LC-03的培养条件优化研究[J]. 中国畜牧兽医, 2010, 37(6): 223-226.
[15] FRITZENFREIRE C B, PRUDENCIO E S, PINTO S S, et al. Effect of microencapsulation on survival of Bifidobacterium BB-12 exposed to simulated gastrointestinal conditions and heat treatments[J]. LWT-Food Science and Technology, 2012, 50(1): 39-44.
[16] ANNAN N T, BORZA A D, HANSEN L T. Encapsulation in alginate-coated gelatin microspheres improves survival of the probiotic Bifidobacterium adolescentis 15703T during exposure to simulated gastro-intestinal conditions[J]. Food research international, 2008, 4: 184-193.

