天然草地植物叶角质层蜡质的化学组成及其对自由放牧的响应
李晓婷,赵晓,王登科,黄蕾,姚露花,王党军,和玉吉,郭彦军
(西南大学农学与生物科技学院,重庆400716)
天然草地是放牧家畜赖以生存的物质基础,也是涵养水源、防风固沙的生态屏障。然而,土地利用方式的变化和放牧强度的增加等均可导致草地土壤退化,使草原生产力下降[1-2]。围栏封育是恢复退化草地常见的草原管理措施,已广泛应用于我国北方地区[3-4]。围栏封育可以增加土壤有机碳和氮含量,提高草原生产力[5-6]。Mavromihalis等[7]研究报道,在温带多年生草原,每年外来物种的覆盖率随着围栏封育持续时间的增加而下降,而原生、放牧敏感性和多年生草本覆盖率则有所增加。薛艳林等[8]报道,随着放牧强度的增加,冷蒿(Artemisiafrigida)的生殖分枝减少或消失,叶片表皮纹饰的隆起增加。与围栏封育的草地相比,长期放牧的草地上,羊草(Leymuschinensis)植株变小[9]。Schiborra 等[10]研究报道持续放牧使部分植物叶片总面积显著减少,但当地优势植物羊草和克氏针茅(Stipakrylovii)叶片总面积增加。这些研究表明,长期的过度放牧会改变植物多样性和植物形态。因此,了解植物对放牧的响应机制将有助于预测围栏封育草地其物种组成的变化,并可为改善放牧管理制度提供理论依据[11]。
植物角质层蜡质覆盖在叶片表面,主要由长链脂肪酸及其衍生物组成,如烷类、醇类、醛类、酯类及三萜类物质等[12]。这些疏水化合物被认为与防止叶片表面水分损失有关[13]。如,干旱胁迫提高了拟南芥(Arabidopsisthaliana)中的烷烃水平、降低了角质层通透性,有助于植物适应水分胁迫环境[14]。大麦(Hordeumvulgare)中大量的表皮蜡质层增加了对干旱的耐受性,提高了产量[15]。环境温度、湿度、季节不同,也将影响植物角质层蜡质的沉积和组分变化[16-18]。此外,烷烃碳链长度也因环境因子的变化而发生变化[19]。与其他非形态学指标相比,正烷烃分布的变化被认为是描述植物对环境变化响应的一种有用分类指标[20]。在低海拔地区,夏季存在温度高、生态干旱等环境胁迫,使得植物中烷烃碳链长度降低,并伴随角质层渗透性的降低[21]。姚露花等[22]发现采集于不同海拔的草地早熟禾(Poapratensis),其叶表皮蜡质组分存在差异,即随着海拔降低,初级醇比例减少,烷烃比例增加。与连续放牧的草原相比,围栏封育草原具有相对较高的植物覆盖率、产量和土壤水分[23-24],这种差异可能影响植物叶角质层蜡质的含量和化学组成。然而,草原植物叶角质层蜡质对过度放牧有何响应,目前尚无文献报道。
羊草、克氏针茅和糙隐子草(Cleistogenessquarrosa)是我国北方温带草原广泛分布的天然多年生牧草[25-26]。迄今为止,有关这些植物性状的研究主要集中在芽和根生长、繁殖或营养状态及补偿性生长等方面[25,27-29],尚无有关叶角质层蜡质分析方面的报道。在本研究中,选择草甸草原和典型草原两种草原类型,自由放牧和围栏封育两种利用方式,分析了羊草、克氏针茅和糙隐子草叶角质层蜡质的特征变化,包括蜡质总量、组分相对含量及碳链分布特征。旨在通过分析3种优势物种叶角质层蜡质特征及其对长期自由放牧的响应,为合理利用和管理草原提供理论依据。
1 材料与方法
1.1 样地选择及概况
试验地位于内蒙古锡林浩特市锡林河流域的温带草原,地理坐标为北纬43°50′,东经116°10′,平均海拔1077 m。样地以低山和丘陵为主。年平均降水量为350 mm,年平均气温为1.7 ℃。由于长期的过度放牧,锡林河流域的草原已经严重退化,截至1999年,退化草原面积已达到72%[30]。从2001年起,政府实施了一系列保护草原和管理草原的政策,将退化的草原进行围栏封育以防在生长季节过度放牧(4-9月)。土壤类型主要以栗钙土为主,土壤质地为沙壤土。草原类型为温性草甸草原和典型草原,草地植物主要包括:羊草、克氏针茅、糙隐子草、冷蒿(Artemisiafrigida)、米氏冰草(Agropyronmichnoi)、黄囊苔草(Carexkorshinskyi)、唐松草(Thalictrumaquilegifolium)、 野葱(Alliumchrysanthum)(表1)。
1.2 样品采集及处理
2015年7月,在草甸草原(43.27° N, 116.38° E)和典型草原(44.03° N, 116.15° E),分别选择围栏封育样地和自由放牧样地,其中草甸草原区围栏封育样地自2004年起开始围封,典型草原区自2002年起开始围封。围封草地主要用作打草场;自由放牧样地紧邻封育样地,为未受保护的公共放牧草地。每样地设置3个采样区(400 m2),作为3次重复。采样时,考虑到围栏周边家畜践踏严重,自由放牧样地采样区距围栏50 m之外。每个采样区,选择健康、叶片完全展开且生育期一致的糙隐子草、克氏针茅和羊草植株,自植株顶端选择第3至第5叶位叶片。每种植物每采样区采集20~30片叶(15~20株),然后用清水将表面冲洗干净,置于吸水纸保存。吸水纸每隔2~3 d更换一次,直至叶片充分干燥。

表1 围封草地和自由放牧草地植被类型Table 1 Relative coverage of plant species in ungrazed (UG) and continuously grazed (CG) steppes (%)
1.3 叶表皮蜡质的提取
取大约5~8片干叶片,分段剪碎,室温条件下在含5 μg内标(24烷)的氯仿(5 mL)溶液涡旋浸提2次,每次30 s。提取液混合后于40 ℃下氮气吹干,加入20 μL BSTFA[N,O-Bis(三甲基硅烷基)三氟乙酰胺]和20 μL吡啶,于70 ℃反应45 min,多余衍生剂利用氮吹仪再次吹干。将所得提取物溶于1 mL氯仿,进行气相色谱(福立9790Ⅱ 浙江)分析。叶片提蜡后,利用WinFOLIA专业叶片图像分析系统(Regent Instrument Inc, Canada)和数字化扫描仪(EPSON V750, Japan)测定叶表面积。
1.4 气相色谱-质谱(GC-MS)分析
蜡质含量分析采用福立9790Ⅱ系列气相色谱仪(GC)。气相色谱仪程序:GC毛细管柱长30 m,直径0.32 mm,液膜厚度0.25 μm;氮气作为载气;进样量为1.5 μL。柱膜和FID(火焰离子化检测仪)检测器的温度分别为300和320 ℃。分流比为10∶3。程序升温方式:初始温度为80 ℃,以每分钟15 ℃的速度升温至260 ℃,并保持10 min,之后以每分钟2 ℃升温至290 ℃,保持1 min,再以每分钟5 ℃ 的速度升温至320 ℃,并保持10 min。用内标计算植物单位面积的蜡质含量,单位为 μg·cm-2。利用气相色谱—质谱联用仪(GCMS-AOC-5000 Plus)鉴定蜡质组分,程序升温方式同色谱分析。蜡质量化基于FID峰值,根据质谱所鉴定的标准确定色谱中各种化学成分的出峰位置,用内标计算出植物单位面积的实际蜡质含量,单位为 μg·cm-2。
1.5 数据分析
试验数据为3个重复的平均值和标准误。采用SPSS (17.0)统计软件,利用二因素实验设计分析了草地类型和草地利用方式及其二者的交互作用对植物角质层蜡质总量及蜡质组分相对含量的影响。然后,利用单因素方差分析比较了不同处理间蜡质总量、组分及链长分布之间的差异,显著水平为P<0.05(l.s.d,least significant difference)。
2 结果与分析
2.1 不同草原类型3种植物角质层蜡质总量
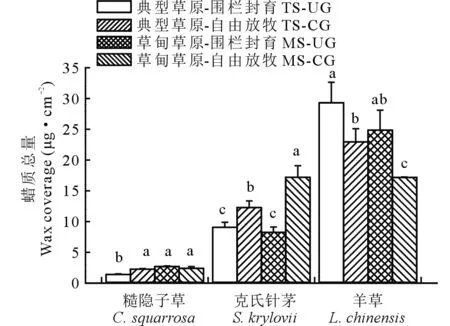
图1 草甸草原和典型草原糙隐子草、克氏针茅和羊草叶角质层蜡质总量 Fig.1 Wax coverage in leaves of C. squarrosa, S. krylovii and L. chinensis in meadow steppe (MS) and typical steppe (TS) under un-grazing (UG) and continuous grazing (CG) conditions 数据柱上不同小写字母表示差异显著(P<0.05)。下同。 Different lowercase letters above the data bar represent significant difference at P<0.05 level. The same below.
3种植物叶角质层蜡质总含量种间变异较大(图1)。如糙隐子草蜡质总含量为1.50~3.00 μg·cm-2,克氏针茅蜡质总量为8~18 μg·cm-2,羊草蜡质总量为17~30 μg·cm-2。草地类型显著影响了糙隐子草蜡质总量及其烷基酯的相对含量、克氏针茅烷烃相对含量及羊草次级醇和β-二酮相对含量(表2)。而草地利用方式显著影响了糙隐子草脂肪酸相对含量、克氏针茅蜡质总量、α-香树脂醇和β-谷甾醇相对含量及羊草蜡质总量和次级醇相对含量。在典型草原,糙隐子草和克氏针茅叶角质层蜡质总量均表现为自由放牧草地>围封草地,差异显著;而羊草与之相反。在草甸草原,糙隐子草叶角质层蜡质总量表现为围封草地(2.70 μg·cm-2)>放牧草地(2.41 μg·cm-2),但差异不显著;克氏针茅表现为放牧草地(17.20 μg·cm-2)>围封草地(8.26 μg·cm-2),差异显著;羊草叶角质层蜡质总量表现为围封草地(24.87 μg·cm-2)>放牧草地(17.18 μg·cm-2)(P<0.05),差异显著。在围栏封育条件下,糙隐子草叶角质层蜡质总量表现为草甸草原(2.70 μg·cm-2)>典型草原(1.43 μg·cm-2),差异显著;克氏针茅和羊草变化趋势与之相反,均表现为典型草原>草甸草原,且差异不显著。在自由放牧状态下,糙隐子草叶角质层蜡质总量表现为草甸草原(2.41 μg·cm-2)>典型草原(2.29 μg·cm-2),但差异不显著;克氏针茅叶角质层蜡质总量表现为草甸草原(17.20 μg·cm-2)>典型草原(12.28 μg·cm-2),差异显著;羊草叶角质层蜡质总量表现为典型草原(22.95 μg·cm-2)>草甸草原(17.18 μg·cm-2),差异显著。
2.2 三种植物叶角质层蜡质组分含量分析
3种植物叶角质层蜡质化学组分和相对含量均存在较大差异。在糙隐子草中,鉴定出6类蜡质组分(图2),分别是脂肪酸、烷烃、醛类、初级醇、烷基酯和β-香树脂醇,其中初级醇相对含量最高,约占47.50%,其次是醛类,约占26.56%。整体上,初级醇相对含量呈现放牧草地>围封草地,典型草原>草甸草原。克氏针茅中鉴定出5类成分(图3),分别是脂肪酸、烷烃、初级醇、α-香树脂醇以及β-谷甾醇,其中烷烃相对含量最高,约占54%,其次为初级醇,约占30.90%。烷烃相对含量表现为典型草原>草甸草原。在羊草中,鉴定出7类成分(图4),分别是脂肪酸、烷烃、次级醇、初级醇、β-谷甾醇、烷基间苯二酚和β-二酮,其中次级醇含量最高,约占53%,其次为β-二酮,约占41%。次级醇相对含量表现为围封草地>放牧草地,典型草原>草甸草原。

表2 草地类型(草甸草原和典型草原)与草地利用方式(围栏封育和自由放牧)影响植物角质层蜡质总量及组分的方差分析(F值)Table 2 ANOVA analysis of the main effects of steppe types (meadow steppe and typical steppe) and utilization (un-grazing and continuously grazing steppe) and their interactions on total waxcoverage and the abundance of wax compounds (F value)
*,P<0.05; **,P<0.01; ***,P<0.001.

图2 草甸草原和典型草原糙隐子草叶角质层蜡质组分相对含量Fig.2 Relative abundance of wax compound class in leaves of C. squarrosa in meadow steppe (MS) and typical steppe (TS) under un-grazing (UG) and continuous grazing (CG) conditions

图3 草甸草原和典型草原克氏针茅叶角质层蜡质组分相对含量Fig.3 Relative abundance of wax compound class in S. krylovii in meadow steppe (MS) and typical steppe (TS) under un-grazing (UG) and continuous grazing (CG) conditions
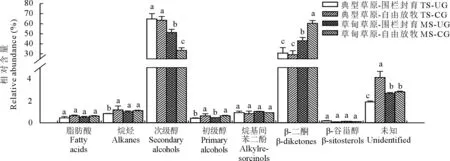
图4 草甸草原和典型草原羊草叶角质层蜡质组分相对含量Fig.4 Relative abundance of wax compound class in leaves of L. chinensis in meadow steppe (MS) and typical steppe (TS) under un-grazing (UG) and continuous grazing (CG) conditions
2.2.1糙隐子草主要蜡质组分碳链分布特征 糙隐子草叶角质层蜡质中脂肪酸化合物以偶数碳C24、C26和C28脂肪酸同系物的形式存在,其中C26脂肪酸含量最高,占脂肪酸总含量的59.00%,且整体表现为放牧草地>围封草地(图5)。烷烃以奇数碳C25、C27和C29形式存在,其中C27烷所占比例最大(59.50%),在典型草原表现为放牧草地大于围封草地,而在草甸草原刚好相反。醛类和初级醇均以偶数碳C26~C32同系物形式存在,且均以C30同系物相对含量最高,其中初级醇C30占77.77%,醛类C30占65.70%。烷基酯类以偶数碳C40、C42和C44同系物形式存在,其中C42烷基酯类同系物相对含量最高,约占总烷基酯含量的57.80%。整体而言,在糙隐子草中,各蜡质组分碳链分布遵循正态分布规律,且除烷类以奇数碳同系物占据优势外,其他4种成分(脂肪酸、醛类、初级醇和烷基酯)均为偶数碳同系物占据优势。
2.2.2克氏针茅主要蜡质组分碳链分布特征 克氏针茅叶角质层蜡质中脂肪酸以偶数碳C22~C32同系物的形式存在,其中C28同系物相对含量最高,约占28.60%。烷烃碳链长度在C25~C33之间,具有明显的碳奇数优势,其中C31的相对含量最高(81.80%),且整体表现为放牧草地>围封草地,草甸草原>典型草原的趋势(图6)。初级醇主要以偶数碳C24~C32同系物的形式存在,其中C28同系物相对含量最高,约占86.70%,且表现为草甸草原>典型草原、围封草地>放牧草地的趋势。
2.2.3羊草主要蜡质组分碳链分布特征 羊草叶角质层蜡质中脂肪酸化合物以偶数碳C20~C26同系物的形式存在,其中C24同系物相对含量较高,约占53.80%(图7)。烷烃碳链长度在C25~C33,其中C31相对含量最高(约占47.90%)。次级醇包括C29、C31和C33三种同系物,且每种同系物有两种异构体存在,-OH分别位于碳链第6和第7个碳上。次级醇C31占优势,且-OH位于第7个碳上的异构体相对含量(86.90%)显著高于第6个碳位上的(13.10%)。初级醇以偶数碳C22~C32同系物的形式存在,其中C28相对含量最高(约占42.60%),且整体呈现典型草原>草甸草原的趋势。烷基间苯二酚以C19、C21和C23同系物的形式存在,表现为奇数碳同系物优势,其中C19同系物相对含量最高,约占66.80%。β-二酮以C23、C25和C27同系物的形式存在,具有明显的奇数碳优势,其中C25相对含量最高(约占51.20%),其次为C27同系物(约占48.20%)。

图5 草甸草原和典型草原糙隐子草叶角质层蜡质各组分同系物相对含量Fig.5 Relative abundance of wax homologs in leaves of C. squarrosa in meadow steppe (MS) and typical steppe (TS) under un-grazing (UG) and continuous grazing (CG) conditions
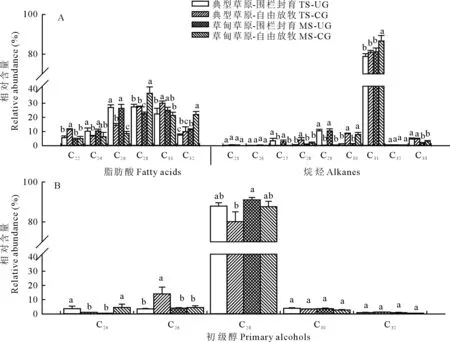
图6 草甸草原和典型草原克氏针茅叶角质层蜡质各组分同系物相对含量Fig.6 Relative abundance of wax homologs in leaves of S. krylovii in meadow steppe (MS) and typical steppe (TS) under un-grazing (UG) and continuous grazing (CG) conditions
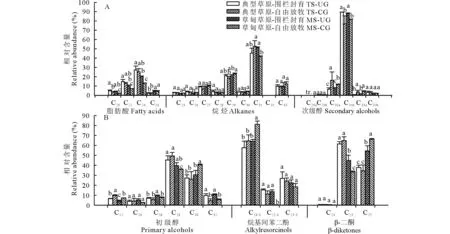
图7 草甸草原和典型草原羊草叶角质层蜡质各组分同系物相对含量Fig.7 Relative abundance of wax homologs in leaves of L. chinensis in meadow steppe (MS) and typical steppe (TS) under un-grazing (UG) and continuous grazing (CG) conditions C29a,C31a和C33a指次级醇羟基(-OH)所在位置为碳链第6碳位上;C29b,C31b和C33b指次级醇羟基(-OH)所在位置为碳链第7碳位上。C29a, C31a and C33a represented secondary alcohols with -OH on carbon six; C29b, C31b and C33b represented secondary alcohols with -OH on carbon seven. tr:微量 Trace.
3 讨论
植物物种不同,其所含的角质层蜡质组分及含量也不尽相同[31]。本研究中,发现糙隐子草、克氏针茅和羊草叶角质层蜡质的主要组分和含量是不同的。蜡质组分的差异说明参与蜡质合成的途径也不同,其中烷合成途径和醇合成途径参与了所有植物的蜡质合成,而β-二酮合成途径参与了羊草蜡质合成。除已经报道的大麦、燕麦(Avenasativa)和小麦(Triticumaestivum)外[32-34],羊草β-二酮成分的发现,可作为未来研究β-二酮合成途径的新材料。在角质层蜡质总量上,品种间表现为羊草最高,其次为克氏针茅,糙隐子草最低。这几种植物在天然草地均广为分布,因此物种间单纯利用角质层蜡质含量不能说明哪种植物更抗逆。就具体某种植物而言,一般认为蜡质含量的增加与提高其抗旱性有关[32]。
尽管几种植物生长在相同的环境,他们主要蜡质组分的相对含量也不同,其中羊草的次级醇含量最高(占总量的53%),糙隐子草初级醇含量最高(47.50%),而克氏针茅的烷烃含量最高(54%)。这说明不同植物角质层蜡质中参与保护植物的蜡质组分是不同的。Cameron等[35]报道,生长在相同环境条件下的杨属(Populus)和柳属(Salix),角质层蜡质的组成成分有很大的差异,并且调控蜡质产生的过程在不同物种间也不一样。Oliveira等[36]发现,Capparisyco可减少叶片蒸腾,这可能是因为其叶片蜡质中含有的烷占优势,而Aspidospermaesperanzae对蒸腾作用抵抗力较低可能是因为其叶片蜡质中16-三十一酮占主要优势。
角质层蜡质在提高植物对生物和非生物逆境的适应性方面发挥着重要作用[13]。在本研究中,自由放牧引起的植物角质层蜡质含量变化与草原类型和物种有关。如羊草,在典型草原围栏封育草地高于自由放牧草地,在草甸草原又是围栏封育草地高于自由放牧草地。糙隐子草和克氏针茅也表现出相似的现象。引起这种差异的原因可能在于不同草地类型的土壤条件(特别是水分)及其物种优势所含的蜡质组分不同。典型草原相对干旱,而草甸草原土壤湿度相对较高。围栏封育后,土壤改善状况不同[37],使得植物的生理响应也产生差异[38-39],包括角质层蜡质的沉积。角质层蜡质的含量和组成的变化已被证明与植物适应环境的变化有关[40]。如,紫外线B(280~315 nm)照射影响黄瓜(Cucumissativus)角质层蜡质中烷和初级醇的沉积[41];干旱胁迫下燕麦叶角质层中初级醇含量显著高于对照组[42];在干旱胁迫下生长的苘麻(Abutilontheophrasti)其叶表皮蜡质积累较湿润土壤生长的植物有所增加[43]。此外,由于自由放牧草地上的植物大部分是再生植株,这些叶片要比围栏封育草地上的植物叶片嫩,而叶片成熟度不同可能导致表层蜡质含量和成分产生差异。Chachalis等[44]研究报道,与较老叶片上的疏水组分相比,幼嫩的Brunnichiaovata叶片蜡质组成相对亲水,其叶片蜡质的亲水性要更好。然而,尽管尚不能清晰得出几种植物叶角质层蜡质在不同草原类型及草地利用方式下的变化规律,天然草地植物叶角质层蜡质对草地利用方式是敏感的,这种变化可能是植物适应外界环境变化的适应性策略。
植物角质层蜡质多数组分都是由不同碳链长度的同系物组成,其中正构烷烃的碳链分布模式已被作为分子标记技术用于研究不同生长环境条件下种群之间的物种内变异[20,45]。本研究中,正构烷烃的分布范围在C25~C33之间,糙隐子草以C27烷为主峰碳,克氏针茅和羊草以C31烷为主峰碳,但是不同草地类型间无显著差异。说明锡林河流域典型草原与草甸草原的环境差异可能不足以引起被测植物物种的正烷烃分布变化。这可能与两种草原之间常年相似的平均气温导致长链烷烃合成增加的现象有关[46]。与正烷烃相比,初级醇、次级醇和醛的分布模式在围封和连续放牧的草地之间差异很大,并且在植物种类和草原类型之间响应也不同。在一项关于大豆(Glycinemax)的研究中,Kim等[27]报道,干旱胁迫对初级醇的链长分布影响不大。Shepherd等[17]报道,脂肪酸和初级醇可以显示出甘蓝型油菜(Brassicanapus)短链长度的变化,但是在较强的光照条件下,甘蓝型油菜的长链长度增加。这些研究结果表明,脂肪酸、初级醇和醛的分布模式对环境胁迫的反应可能取决于胁迫水平和植物物种。因此,它们可能不适用于评估植物对环境胁迫反应的可靠参数。
4 结论
本试验详细报道了糙隐子草、克氏针茅和羊草叶角质层蜡质的含量及组分特点。其中糙隐子草含有脂肪酸、烷烃、醛类、初级醇、烷基酯和β-香树脂醇,克氏针茅含有脂肪酸、烷烃、初级醇、α-香树脂醇以及β-谷甾醇,而在羊草中含有脂肪酸、烷烃、初级醇、次级醇、β-谷甾醇、β-二酮和烷基间苯二酚。羊草次级醇含量最高,糙隐子草初级醇含量最高,而克氏针茅的烷烃含量最高。羊草β-二酮成分的发现,可作为未来研究β-二酮合成途径的新材料。因不同植物蜡质含量及组分存在较大差异,使得他们在草原类型间(典型草原和草甸草原),甚至草原利用方式之间(自由放牧和围栏封育),均表现出不同的响应模式。就不同蜡质组分的链长分布特征而言,烷分布特征相对稳定,而初级醇、次级醇和醛的分布特征在围封草地和自由放牧草地之间存在较大差异。不同植物角质层蜡质表现出的差异性响应模式,说明不同植物在长期进化过程中形成了各自特有的适应机制。综合分析认为,草地植物可以通过调整自身蜡质合成,改变蜡质组分和含量以适应放牧引起的胁迫。
参考文献References:
[1] Butterbach-Bahl K, Kögel-Knabner I, Han X. Steppe ecosystems and climate and land-use changes-vulnerability, feedbacks and possibilities for adaptation. Plant & Soil, 2011, 340(1/2): 1-6.
[2] Spence L A, Liancourt P, Boldgiv B,etal. Climate change and grazing interact to alter flowering patterns in the Mongolian steppe. Oecologia, 2014, 175(1): 251-60.
[3] Wang D, Wu G L, Zhu Y J,etal. Grazing exclusion effects on above-and below-ground C and N pools of typical grassland on the Loess Plateau (China). Catena, 2014, 123: 113-120.
[4] Wu G L, Du G Z, Liu Z H,etal. Effect of fencing and grazing on aKobresia-dominated meadow in the Qinghai-Tibetan Plateau. Plant & Soil, 2009, 319: 115-126.
[5] Han G, Hao X, Zhao M,etal. Effect of grazing intensity on carbon and nitrogen in soil and vegetation in a meadow steppe in Inner Mongolia. Agriculture Ecosystems & Environment, 2008, 125(1/2/3/4): 21-32.
[6] He N, Zhang Y, Dai J,etal. Land-use impact on soil carbon and nitrogen sequestration in typical steppe ecosystems, Inner Mongolia. Journal of Geographical Sciences, 2012, 22(5): 859-873.
[7] Mavromihalis J A, Dorrough J, Clark S G,etal. Manipulating livestock grazing to enhance native plant diversity and cover in native grasslands. Rangeland Journal, 2013, 35(1): 95-108.
[8] Xue Y L, Yin G M, Zhang Y J,etal. Responses strategy of morphology ofArtemisiafrigidato grazing intensity. Chinese Journal of Grassland, 2014, 36(6): 18-22.
薛艳林, 殷国梅, 张英俊, 等. 冷蒿形态对放牧强度的响应策略. 中国草地学报, 2014, 36(6): 18-22.
[9] Li X L, Hou X Y, Wu X H,etal. Plastic responses of stem and leaf functional traits inLeymuschinensisto long-term grazing in a meadow steppe. Chinese Journal of Plant Ecology, 2014, 38(5): 440-451.
李西良, 侯向阳, 吴新宏, 等. 草甸草原羊草茎叶功能性状对长期过度放牧的可塑性响应. 植物生态学报, 2014, 38(5): 440-451.
[10] Schiborra A, Gierus M, Wan H W,etal. Short-term responses of aStipagrandis/Leymuschinensiscommunity to frequent defoliation in the semi-arid grasslands of Inner Mongolia, China. Agriculture Ecosystems & Environment, 2009, 132(1/2): 82-90.
[11] Bullock J M, Franklin J, Stevenson M J,etal. A plant trait analysis of responses to grazing in a long-term experiment. Journal of Applied Ecology, 2001, 38(2): 253-267.
[12] Jetter R, Kunst L, Samuels A L. Composition of plant cuticular waxes. Annual Plant Reviews, Biology of the Plant Cuticle, 2007, 23: 145-181.
[13] Yeats T H, Rose J K C. The formation and function of plant cuticles. Plant Physiology, 2013, 163(1): 5.
[14] Kosma D K, Bourdenx B, Bernard A,etal. The impact of water deficiency on leaf cuticle lipids ofArabidopsis. Plant Physiology, 2009, 151(4): 1918-1929.
[15] González A, Ayerbe L. Effect of terminal water stress on leaf epicuticular wax load, residual transpiration and grain yield in barley. Euphytica, 2010, 172(3): 341-349.
[16] Jenks M A, Gaston C H, Goodwin M S,etal. Seasonal variation in cuticular waxes on hosta genotypes differing in leaf surface glaucousness. Hortscience A Publication of the American Society for Horticultural Science, 2002, 37(4): 673-677.
[17] Shepherd T, Robertson G W, Griffiths D W,etal. Effects of environment on the composition of epicuticular wax from kale and swede. Phytochemistry, 1995, 40(2): 407-417.
[18] Gao J H, He Y J, Guo N,etal. Seasonal variations of leaf cuticular wax in herbs widely distributed in Chongqing. Acta Prataculturae Sinica, 2016, 25(1): 134-143.
高建花, 和玉吉, 郭娜, 等. 重庆地区野生草本植物叶表皮蜡质的季节性变化. 草业学报, 2016, 25(1): 134-143.
[19] Bush R T, Mcinerney F A. Leaf wax n-alkane distributions in and across modern plants: Implications for paleoecology and chemotaxonomy. Geochimica Et Cosmochimica Acta, 2013, 117(117): 161-179.
[20] Nikoli B, Tesevic V, Bojovi S,etal. Chemotaxonomic implications of the n-alkane composition and the nonacosan-10-ol content inPiceaomorika,Pinusheldreichii, andPinuspeuce. Chemistry & Biodiversity, 2013, 10(4): 677-686.
[21] Dodd R S, Poveda M M. Environmental gradients and population divergence contribute to variation in cuticular wax composition inJuniperuscommunis. Biochemical Systematics & Ecology, 2003, 31(11): 1257-1270.
[22] Yao L H, Ni Y, Guo N,etal. Leaf cuticular waxes inPoapratensisand their responses to altitudes. Acta Prataculturae Sinica, 2018, 27(1): 97-105.
姚露花, 倪郁, 郭娜, 等. 草地早熟禾叶表皮蜡质及其对海拔变化的响应. 草业学报, 2018, 27(1): 97-105.
[23] Reszkowska A, Krümmelbein J, Gan L,etal. Influence of grazing on soil water and gas fluxes of two Inner Mongolia steppe ecosystems. Soil & Tillage Research, 2011, 111(2): 180-189.
[24] Sun J, Wang X, Cheng G,etal. Effects of grazing regimes on plant traits and soil nutrients in an alpine steppe, Northern Tibetan Plateau. Plos One, 2014, 9(9): e108821.
[25] Jing Z, Cheng J, Su J,etal. Changes in plant community composition and soil properties under 3-decade grazing exclusion in semiarid grassland. Ecological Engineering, 2014, 64(3): 171-178.
[26] Wang X T, Hou Y L, Liu F,etal. Point pattern analysis of dominant populations in a degraded community inLeymuschinensis+Stipagrandissteppe in Inner Mongolia, China. Chinese Journal of Plant Ecology, 2011, 35(12): 1281-1289.
王鑫厅, 侯亚丽, 刘芳, 等. 羊草+大针茅草原退化群落优势种群空间点格局分析. 植物生态学报, 2011, 35(12): 1281-1289.
[27] Kim K S, Park S H, Kim D K,etal. Influence of water deficit on leaf cuticular waxes of soybean (Glycinemax[L.] Merr.). International Journal of Plant Sciences, 2007, 168(3): 307-316.
[28] Wei Z, Chen S P, Han X G,etal. Effects of long-term grazing on the morphological and functional traits ofLeymuschinensisin the semiarid grassland of Inner Mongolia, China. Ecological Research, 2009, 24(1): 99-108.
[29] Wang S P, Wang Y F. Study on over-compensation growth ofCleistogenessquarrosapopulation in Inner Mongolia steppe. Acta Botanica Sinica, 2001, 43(4): 413-418.
汪诗平, 王艳芬. 不同放牧率下糙隐子草种群补偿性生长的研究. 植物学报, 2001, 43(4): 413-418.
[30] Tong C, Wu J, Yong S,etal. A landscape-scale assessment of steppe degradation in the Xilin River Basin, Inner Mongolia, China. Journal of Arid Environments, 2004, 59(1): 133-149.
[31] Li J J, Huang J H, Xie S C. Plant wax and its response to environmental conditions: an overview. Acta Ecologica Sinica, 2011, 31(2): 565-574.
李婧婧, 黄俊华, 谢树成. 植物蜡质及其与环境的关系. 生态学报, 2011, 31(2): 565-574.
[32] Dai S, Guo J, Xu W,etal. Biosynthesis and regulation of cuticular wax and its effects on drought resistance of wheat. Plant Physiology Journal, 2016, 52(7): 979-988.
戴双, 郭军, 徐文, 等. 蜡质组成形态及其合成调控对小麦抗旱性的影响. 植物生理学报, 2016, 52(7): 979-988.
[33] Zhu S Y, Qi J C, Lin L H,etal. Responses of epicuticular wax components in barley seedling leaves to PEG6000 stress and its impacts on epidermal permeability. Journal of Triticeae Crops, 2015, 35(3): 436-442.
朱双艳, 齐军仓, 林立昊, 等. PEG6000胁迫对大麦幼苗叶片表皮蜡质组分及其透性的影响. 麦类作物学报, 2015, 35(3): 436-442.
[34] Yang H H, Shi X, Xia L F,etal. Analysis on composition and content of cuticular waxes on spikes of different wheat varieties (Lines). Journal of Triticeae Crops, 2017, 37(3): 403-408.
杨昊虹, 史雪, 夏凌峰, 等. 不同小麦品种(系)穗部表皮蜡质的成分及含量分析. 麦类作物学报, 2017, 37(3): 403-408.
[35] Cameron K D, Teece M A, Bevilacqua E,etal. Diversity of cuticular wax amongSalixspecies andPopulusspecies hybrids. Phytochemistry, 2002, 60(7): 715-725.
[36] Oliveira A F M, Meirelles S T, Salatino A. Epicuticular waxes from caatinga and cerrado species and their efficiency against water loss. Anais Da Academia Brasileira De Ciencias, 2003, 75(4): 431-439.
[37] Li Y. Effects of long-term fencing closure an soil and vegetation in mountain pasture of Bayanbullak. Xinjiang Agricultural Sciences, 2009.
李赟. 长期围封对亚高山草地土壤和植被的影响. 新疆农业科学, 2009.
[38] Zhao J X, Qi B, Duojidunzhu,etal. Effects of short-term enclose on the community characteristics of three types of degraded alpine grasslands in the north Tibet. Pratacultural Science, 2011, 28(1): 59-62.
赵景学, 祁彪, 多吉顿珠, 等. 短期围栏封育对藏北3类退化高寒草地群落特征的影响. 草业科学, 2011, 28(1): 59-62.
[39] Zuo W Q, Wang Y H, Wang F Y,etal. Effects of enclosure on the community characteristics ofLeymuschinensisin degenerated steppe. Acta Prataculturae Sinica, 2009, 18(3): 12-19.
左万庆, 王玉辉, 王风玉, 等. 围栏封育措施对退化羊草草原植物群落特征影响研究. 草业学报, 2009, 18(3): 12-19.
[40] Riederer M. Introduction: biology of the plant cuticle//annual plant reviews (volume 23): biology of the plant cuticle. Blackwell Publishing Ltd, 2007: 674-678.
[41] Fukuda S, Satoh A, Kasahara H,etal. Effects of ultraviolet-B irradiation on the cuticular wax of cucumber (Cucumissativus) cotyledons. Journal of Plant Research, 2008, 121(2): 179-189.
[42] Bengtson C, Larsson S, Liljenberg C. Effects of water stress on cuticular transpiration rate and amount and composition of epicuticular wax in seedlings of six oat varieties. Physiologia Plantarum, 1978, 44(4): 319-324.
[43] Hatterman-Valenti H, Pitty A, Owen M. Environmental effects on velvetleaf (Abutilontheophrasti) epicuticular wax deposition and herbicide absorption. Weed Science, 2011, 59(1): 14-21.
[44] Chachalis D, Reddy K N, Elmore C D. Characterization of leaf surface, wax composition, and control of redvine and trumpetcreeper with glyphosate. Weed Science, 2001, 49(2): 156-163.
[45] Li J, Huang J, Ge J,etal. Chemotaxonomic significance of n-alkane distributions from leaf wax in genus ofSinojackiaspecies (Styracaceae). Biochemical Systematics & Ecology, 2013, 49(49): 30-36.
[46] Dodd R S, Rafii Z A, Power A B. Ecotypic adaptation inAustrocedruschilensisin cuticular hydrocarbon composition. New Phytologist, 1998, 138(4): 699-708.

