不同游离脂肪酸通过PI3K/AKT途径对INS-1细胞增殖与凋亡的影响
戴盈,崔巍,徐利,施秉银,赵廷启
在肥胖个体和2型糖尿病(T2DM)患者中常有体内游离脂肪酸(FFA)的升高,研究发现,FFA的升高可能与胰岛 细胞功能障碍和T2DM的发病密切相关。FFA包括饱和脂肪酸和不饱和脂肪酸,后者又分为单不饱和脂肪酸和多不饱和脂肪酸。目前关于不同FFA对胰岛 细胞的生存与死亡的影响存在争论,有待进一步研究。本实验以大鼠INS-1胰岛 细胞瘤株(以下简称INS-1细胞)为实验对象,观察不同浓度饱和脂肪酸(棕榈酸,PA)、单不饱和脂肪酸(油酸,OA)和FFA加用广谱Caspase抑制剂和PI3K抑制剂对体外培养下的INS-1细胞的增殖和凋亡的影响。现报道如下。
1 资料与方法
1.1材料 INS-1细胞由中日友好医院临床医学研究所病理生理研究室娄晋宁教授和瑞士日内瓦大学王海燕博士所赠。PA、OA、四甲基偶氮唑盐(MTT)及无FFA的牛血清白蛋白(BSA)均购自Sigma公司。RPM I1640培养基和胎牛血清购自美国Invitrogen(GIBICO)公司。Annexin-Ⅴ/FITC试剂盒购自深圳晶美公司。Z-VAD-fmk购自 Alexis公司,LY294002购自CST公司。
1.2方法
1.2.1细胞培养 INS-1细胞用含10%胎牛血清的RPM I1640培养基(11.1 mmol/L葡萄糖,10 mmol/L的丙酮酸钠,10 mmol/L的HEPES,2 mmol/L的L-谷氨酰胺,及55mol/L的 巯基乙醇)在37℃/5%CO2的细胞孵箱中培养,待到细胞85%左右贴壁,弃去原有培养基,用无血清的含0.1%BSA和0.5mmol/L葡萄糖的RPM I1640培养基对细胞进行24h同步化培养。然后用不同浓度的PA和OA进行干预。
1.2.2FFA的配制[1]用0.1mol/LNaOH溶液在70℃水浴中溶解一定量的OA和PA,振荡混匀10 m in,然后过滤,配成100 mmol/L的OA/PA储存液。在55℃水浴中用去离子水配5%BSA溶液,过滤。然后将上述的FFA溶液和BSA溶液按1∶19的体积比混合配成5mmol/LFFA/5%BSA复合液。复合液在水浴中振荡10 s后继续水浴10 m in,取出后冷却至室温,过滤。然后将上述复合液分别用无血清含葡萄糖16.7mmol/L的RPM I1640培养基以1∶5和1∶10的比例稀释成1.0mmol/LFFA/1%BSA和0.5 mmol/L FFA/0.5%BSA的实验所需浓度;用无血清含葡萄糖5.5mmol/L的RPMI1640培养基以1∶10和1∶20的比例稀释成0.5mmol/LFFA/0.5%BSA和0.25mmol/L FFA/0.25%BSA的实验所需浓度。
1.2.3MMT法测定细胞增殖情况 将INS-1细胞按每孔104种于96孔培养板,待细胞85%贴壁,细胞同步化24h,弃去原有培养基,加入含不同浓度FFA的培养基干预。实验组分别是终浓度为0.25、0.5mmol/L OA;0.25、0.5mmol/LPA;0.5mmol/LOA/PA+100mol/L Z-VAD-fmk;以及 0.5 mmol/L OA/PA+20mol/L LY294002。同时设含0.25%BSA和0.5%BSA的两组对照组。每组5个复孔,每孔总反应体系为200l。按照设定的时间,在倒置显微镜下观察细胞并拍摄记录细胞形态;然后每孔加入MTT 20l,继续培养 4h。弃去上清液,每孔加入二甲基亚砜200l,振荡10min,酶标仪(德国BGM公司,型号:POLARstarOPTIMA)测定590nm下各个组实验对象的吸光度(A)。
1.2.4用Annexin-Ⅴ/FITC试剂盒检测细胞凋亡将INS-1细胞按每孔106种于6孔培养板,待细胞85%贴壁,同步化培养24 h。实验组分别用含0.5 mmol/L的OA/PA和1.0mmol/L的OA/PA的无血清高糖(含葡萄糖16.7mmol/L)RPM I1640培养基培养,对照组用含0.5%或1%BSA的无血清高糖RPM I1640培养基培养。每组设三个复孔。在6、16、24 h 3个时间点,用倒置显微镜观察细胞并拍摄记录细胞形态,然后分别消化细胞,离心收集细胞,用4℃预冷的PBS缓冲液洗细胞两次,然后用结合缓冲液重悬细胞,调节细胞的浓度为106/m l。每个样本取100l的细胞悬液,加入5l的Annexin-Ⅴ/FITC和10l的碘化丙啶(PI,20g/ml)溶液,混匀后室温避光孵育15 min,在每个样本中加入400l结合缓冲液,流式细胞仪(美国BD公司,型号:FACSCalibur)测量并分析。
1.3统计学分析 采用SPSS18.0统计软件进行数据分析,计量资料以均数±标准差表示,采用方差分析,两两比较采用LSD-检验。<0.05为差异有统计学意义。
2 结果
2.1不同浓度的OA和PA对INS-1细胞生长的影响 与对照组相比,在各时间点,两种浓度OA对细胞生长均具有促进作用(均< 0.05),以 0.25mmol/L OA促进细胞生长作用更为明显,细胞增殖程度分别是对照组的1.3倍、1.5倍和1.9倍;而0.25 mmol/L PA和0.50 mmol/L PA均能抑制细胞生长(均<0.05),以0.50mmol/LPA的抑制作用更为明显,其作用下的细胞增殖程度仅为对照组的42%、45%和32%。各实验组的细胞在48h生长程度达到最大。见表1。
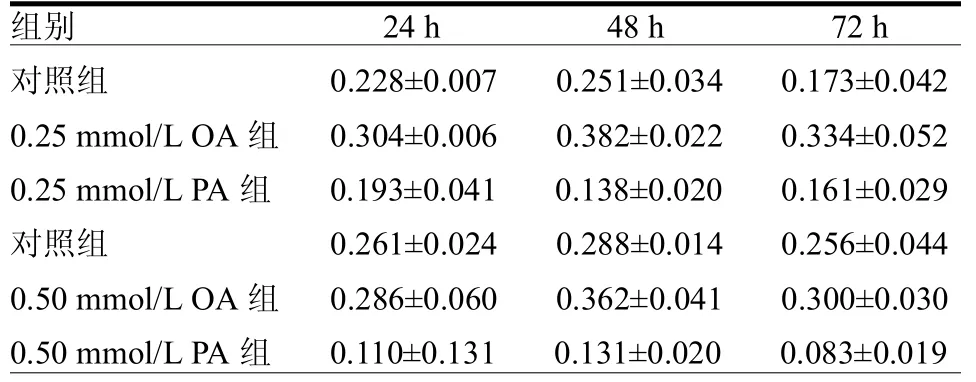
表1 不同浓度的油酸和棕榈酸对INS-1细胞增殖(吸光度A)的影响
2.2不同Caspase抑制剂对INS-1细胞增殖的影响在含0.5 mmol/L OA/PA的高糖培养基中加入Caspase抑制剂Z-VAD-fmk(以下简称VAD),并使其终浓度为100mol/L,培养细胞28 h后,OA干预下的两组细胞增殖程度均高于对照组,其中,VAD组的细胞增殖程度稍低于无VAD组的细胞,无VAD组的细胞增殖程度与对照组差异有统计学意义(< 0.05);PA干预的两组细胞增殖程度均低于对照组,但VAD组的细胞增殖程度要高于无VAD组的细胞,而无VAD组的细胞与对照组相比增殖明显受到抑制(<0.01)。见表2。
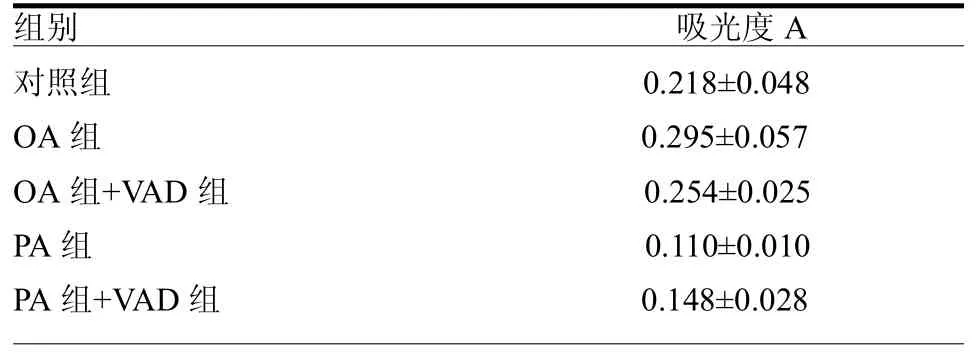
表2 广谱Caspase抑制剂VAD处理后的Ins-1细胞增殖情况
同样在含0.5 mmol/L OA/PA的高糖培养基中加入终浓度为20mol/L的PI3K抑制剂LY294002(以下简称LY),培养细胞30 h后,MTT法观察发现,在OA和PA两种干预下,加LY组处理的细胞增殖程度均明显低于相应的不加LY组的细胞(<0.01)。与对照组相比,OA能显著促进细胞增殖(<0.01),OA+LY、PA、PA+LY这3组的细胞增殖均明显受到抑制(均<0.01)。OA+LY组细胞增殖程度明显高于PA+LY组细胞。见表3。

表3 PI3K抑制剂LY处理后对Ins-1细胞增殖的影响
2.3不同浓度OA和PA对INS-1细胞凋亡的影响用不同浓度的OA和PA作用,在各时间段均可见到凋亡细胞。随着时间的推移,各实验组的凋亡细胞量增多,尤其在24h后,倒置显微镜下可见到大量细胞凋亡:细胞皱缩成圆形或椭圆形,失去原有的突触,漂浮或悬浮于培养基中,不再贴壁生长(封二彩图3A、B、C)。而较对照组而言,OA组的细胞凋亡量要少于对照组(封二彩图3B),而PA组的细胞凋亡量要明显多于对照组(封二彩图3C)。
用Annexin-Ⅴ/FITC/PI双标记流式细胞术可测知各个时间段各组细胞凋亡的比例。在6 h,OA组和PA组作用下细胞和对照组细胞的凋亡率差异均无统计学(均>0.05),但1 mmol/L OA细胞凋亡比例明显少于同浓度PA组(<0.01)。24 h高浓度OA引起细胞凋亡与对照组差异有统计学意义(p<0.05);0.50 mmol/L和1 mmol/L PA组的细胞凋亡率与对照组差异均有统计学意义(均< 0.05)。对照组及PA组细胞的凋亡均随着时间的推移逐渐增加(<0.05);而OA组引起的细胞凋亡在各个时间段差异均无统计学意义(均>0.05)。见表4。
3 讨论
本研究显示,不饱和脂肪酸OA可促进细胞增殖,而饱和脂肪酸PA则抑制细胞增殖,促进细胞凋亡。OA组细胞在48h增殖程度达到最大,48h后,生长程度逐渐下降,可能是测定细胞增殖是在无血清、低糖(葡萄糖浓度为5.5mmol/L)培养基中进行,而48 h后无血清、低糖条件下氧化应激导致的细胞凋亡超过OA促增殖作用,以致72 h细胞增殖程度低于48 h,尽管如此,72 h的OA和PA相比还是显示出较少的细胞毒性。
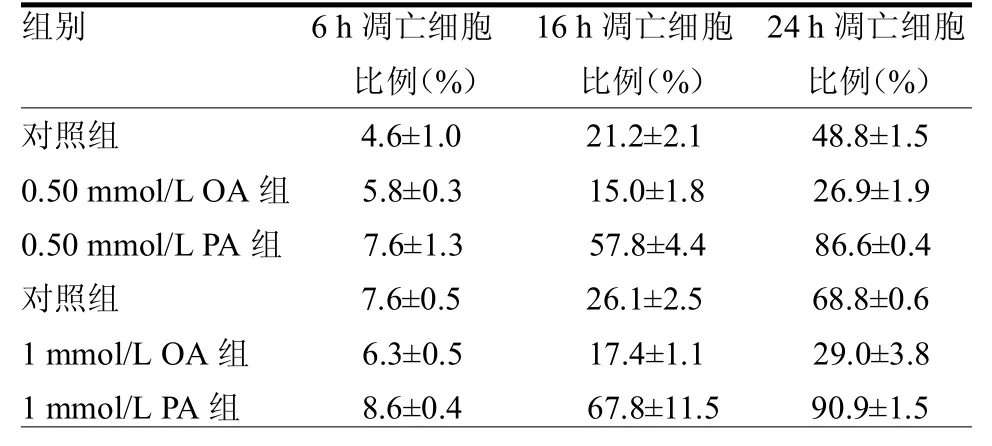
表4 不同浓度OA和PA作用下对INS-1细胞凋亡的影响
研究证明,Caspase家族在细胞凋亡信号传导过程中起到核心作用,VAD是广谱的Caspase抑制剂,可抑制由Caspase所引起的细胞凋亡。本实验在OA组应用了VAD之后,并没有使细胞生长率显著提高,可能是OA本身能促进细胞生长,故VAD对OA组细胞生长的影响不大。而PA组应用了VAD之后,细胞生长率有所增加,提示PA引起的INS-1细胞凋亡的信号途径中有Caspase参与其中。PI3K/Akt信号通路中的下游反应元件cIAP-2和XIAP是Caspase有效的抑制剂,可阻断细胞的凋亡反应[7]。本研究中,应用了LY的OA组和PA组,细胞生长明显受抑,提示LY作为PI3K抑制剂,通过抑制PI3K/Akt信号通路使Caspase失去抑制,致细胞凋亡增加。上述结果提示,PI3K/Akt信号通路在INS-1细胞脂性凋亡中对维持应激细胞的生存具有重要意义,而PA引起的细胞凋亡是通过Caspase介导的。
本研究对细胞凋亡的测定是在高糖(16.7mmol/L)及无血清条件下进行的。结果显示,PA使细胞凋亡显著增加;而OA作用下细胞凋亡率低于对照组和PA组。本实验对照组引起细胞大量凋亡的原因可能与高糖、无血清环境所致高糖毒性及氧化应激有关。由此,笔者推测,OA在促进细胞增殖同时,还能对抗高糖毒性诱发的 细胞凋亡,对 细胞起到保护作用。
总之,本实验证实了OA能促进INS-1细胞生长,抑制其凋亡,对 细胞具有保护作用;PA则抑制INS-1细胞的生长,并促进其凋亡,对 细胞具有毒性作用。通过应用广谱Caspase抑制剂VAD和PI3K抑制剂LY对细胞生长影响的研究,发现PI3K/Akt信号通路在胰岛 细胞脂性凋亡中对维持应激细胞的生存具有重要意义;在高浓度PA长期作用下引起的INS-1细胞凋亡是通过Caspase介导的。而上述结论中涉及的具体分子机制,还需进一步实验证实。
参考文献:

