响应面法优化竹芋淀粉酶解工艺及动力学研究
高义霞,周向军*,王廷璞,呼丽萍
(1.天水师范学院 生物工程与技术学院,甘肃天水741001;2.甘肃省大樱桃工程技术研究中心,甘肃天水741001)
竹芋(Maranta arundinacea L.)为竹芋科竹芋属多年生草本植物,其淀粉含量约为22~28%.[1]α-淀粉酶作用于α-1,4糖苷键,生成糊精和低分子量糖,可降低淀粉黏度,[2]因而广泛用作制糖行业原料或用于焙烤类食品品质改善。影响淀粉糖化效率的因素很多,如酶类型、离子强度、淀粉种类、结构和浓度、pH、温度、激活剂和抑制剂[3-5]等,常规米氏方程难以真实描述反应过程,[6]因此,在实际生产中,须进一步探讨酶促反应的最佳条件,[7]以最大化发挥催化作用,从而降低生产成本。玉米、小麦、甘薯、木薯、马铃薯及荞麦等淀粉研究较多,[8-13]但竹芋淀粉与其他薯类、谷类淀粉相比,其性质、功能存在一定差异。[14]目前有关竹芋的研究,主要集中在其性质、单因素和正交工艺及糖化条件优化等方面,还未见利用响应面法优化竹芋淀粉酶解工艺及相应动力学参数研究。因此,本试验以温度、E/S及时间为因素,通过响应面法优化α-淀粉酶酶解竹芋淀粉制糖工艺,同时对酶解动力学进行研究,也为竹芋淀粉的深加工提供理论依据。
1 材料与方法
1.1 材料与试剂
竹芋淀粉(69.583±0.232%);α-淀粉酶(sigma,58.7 U/mg);酒石酸钾钠、氢氧化钠、3,5-二硝基水杨酸、亚硫酸氢钠、苯酚、葡萄糖(上海生工)。
1.2 器材
AL204型电子天平:梅特勒-托利多仪器有限公司;TGL-20M型高速台式冷冻离心机:湖南湘仪离心机仪器有限公司;PHS-3D雷磁pH值计:上海精密科学有限公司;722型可见分光光度计:上海欣茂有限公司。
1.3 方法
1.3.1 标准曲线制作及酶解
参考3,5-二硝基水杨酸(DNS)法。[15]Y=2.8991X-0.1469,r=0.992(X为葡萄糖质量mg,Y为OD)。称取竹芋淀粉,加少许pH 6.0磷酸缓冲液,80℃糊化5 min.冷却,加一定量α-淀粉酶液,混匀,一定时间后迅速沸水灭活5 min,测定吸光值,计算DE和反应速度v。
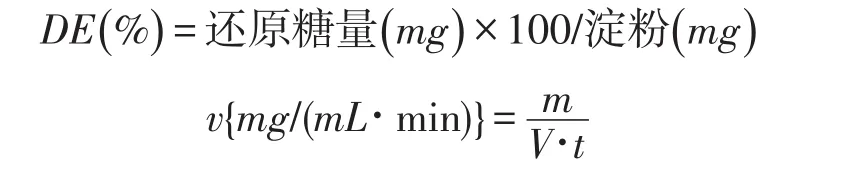
式中:v-反应速率(mg/mL×min),m/V-还原糖含量(mg/mL);t-反应时间(min)。
1.3.2 单因素试验
按1.3.1法,分别考察温度30、40、50、60和70℃、E/S=0.005、0.01、0.02、0.04 和 0.08 U/mg、10、20、40、60、80、100、120、150、180和210 min,pH4.0、pH5.0、pH6.0、pH7.0和pH8.0对DE的影响。
1.3.3 响应面法优化酶解工艺
在单因素试验基础上,参考李艳红等人研究,[16]固定pH 6.0,以温度、E/S、时间为因子,单因素试验各因子最优点为基准点,确定适度步长,DE为响应值,利用Design-Expert 8.06中Box-Behnken法设计实验,见表1.

表1 Box-Benhnken试验因素水平及编码
根据Lineweaver-Burk方程求Km和Vm.
1.4 数据处理
利用origin7.5作图,Design-Expert 8.06进行响应面分析,数据以表示。
1.3.4 酶促反应动力学参数计算
2 结果与分析
2.1 单因素试验
时间对DE的影响见图1a,在0~210 min范围内,随时间延长,DE逐渐增加,进一步延长酶解时间,DE接近最大值而趋于稳定,故选择210 min.温度对DE的影响见图1b,温度为60℃时,DE为最大值。原因一方面是温度升高,分子间碰撞次数增加,反应速率增加;另一方面,随温度升高,酶逐渐变性失活,导致反应速率下降。另外,温度过高,淀粉易发生糊化,[17]综合考虑,温度选择60℃.E/S对DE的影响见图1c,由图1c可知,反应初期,随E/S增大,DE迅速增加,原因是开始时底物过量,酶促反应速率与酶量成正比,随E/S增大,此时底物逐渐不足,因而反应速率降低,甚至出现下降趋势,[18]E/S为0.04 U/mg时,DE最大,故E/S选择0.04 U/mg.pH对DE的影响见图1d,由图1d可知,pH6.0时DE为最大值,原因是pH可影响酶分子活性中心上必需基团的离子化程度,也可影响底物的解离程度,从而影响酶与底物的结合,[19]故选择pH6.0.
2.2 响应面分析
Box-Benhnken设计和结果及方差分析见表2和表3,方程具有显著性(P<0.05),表明所选模型显著,失拟项P=0.0607>0.05,说明模型失拟项不显著。Y=-780.64+55.768X1-18249.88X2-3.08X3-74.35X1X2-023X1X3+125.6X2X3-0.06
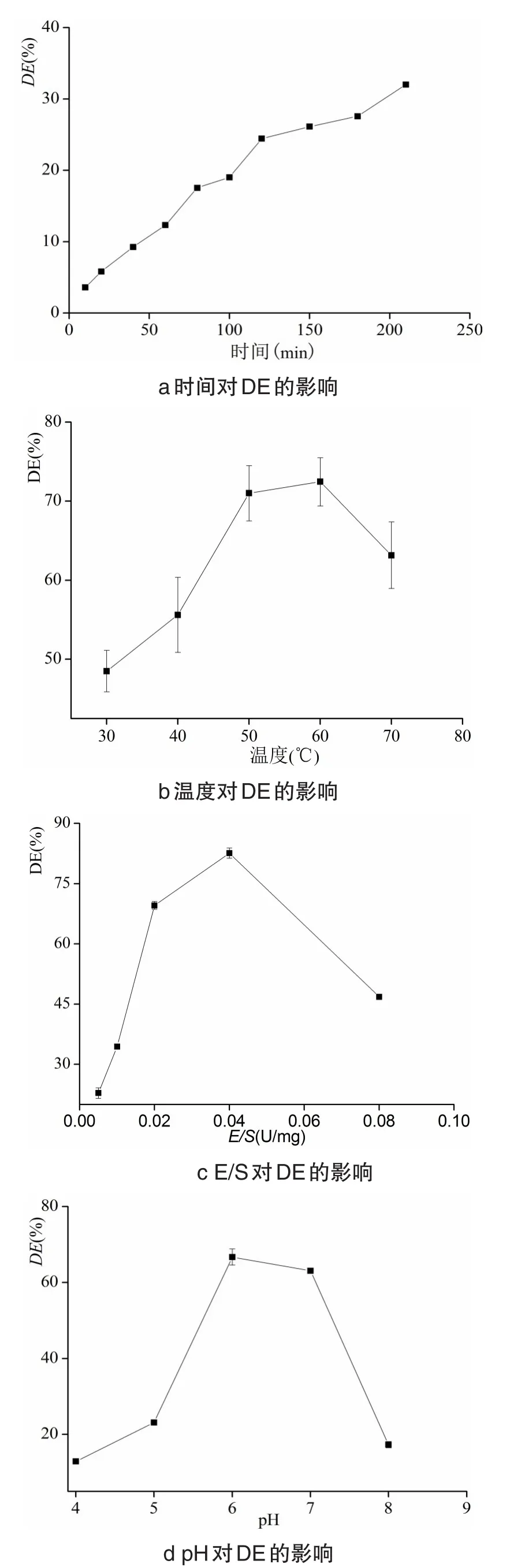
图1 单因素试验
时间(X3)的P值<0.05,表明其对DE影响显著;温度(X1)及E/S(X2)的P值>0.05,影响不显著。各因素影响大小依次为时间、E/S及温度。二次项及影响均不显著。交互项影响大小依次为 X2X3、X1X3、X1X2,其中 X2X3及X1X3达到显著水平,表明各因素对DE的影响非简单线性关系。最优工艺为:时间220min、E/S=0.05U/mg和温度55℃,预测DE值可达95.25%.验证试验及结果见表4.验证试验平均值为(92.34±1.45%,n=6),RSD=1.57%<5%,表明模型有效,可用于竹芋淀粉酶解参数的优化。

表2 Box-Benhnken试验设计表及结果
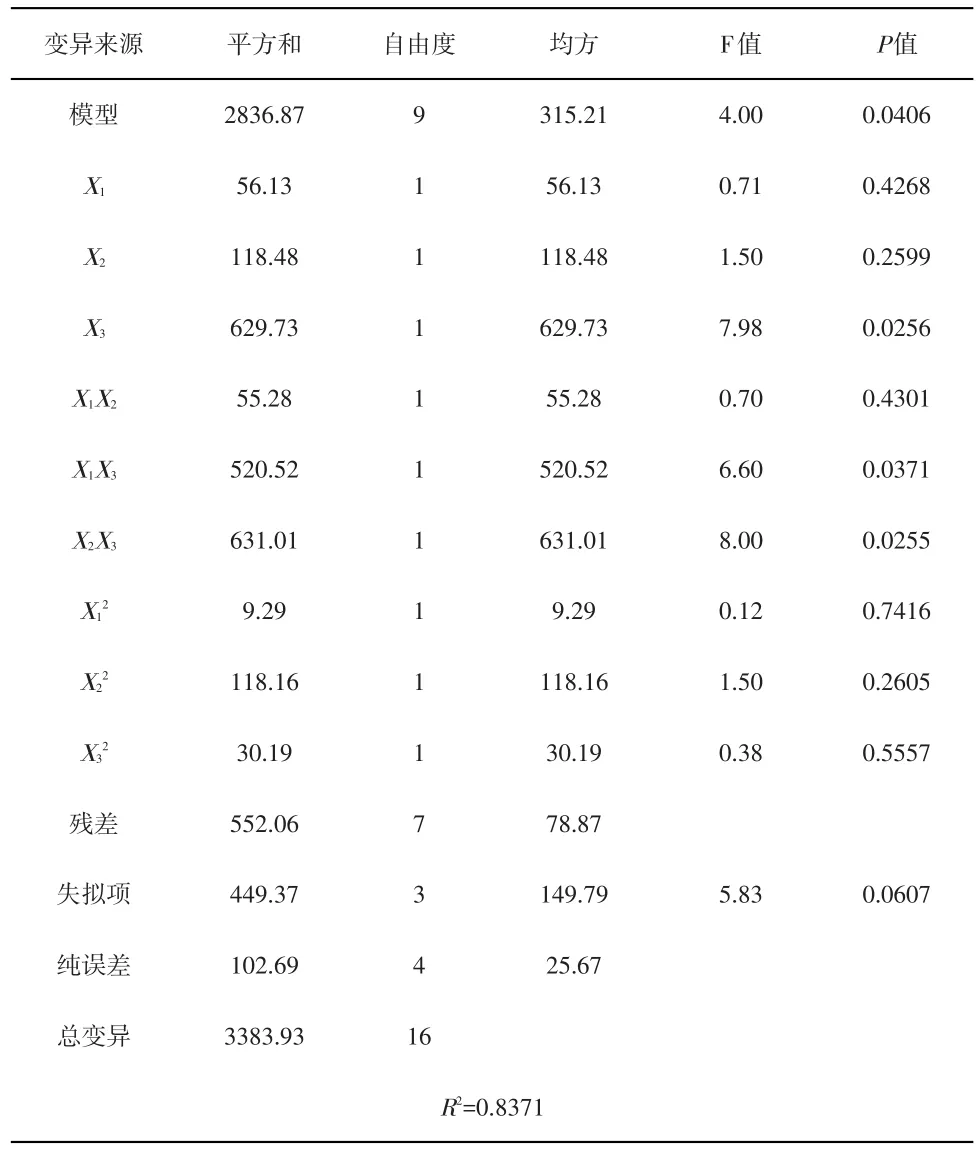
表3 回归模型系数显著性检验及其方差分析
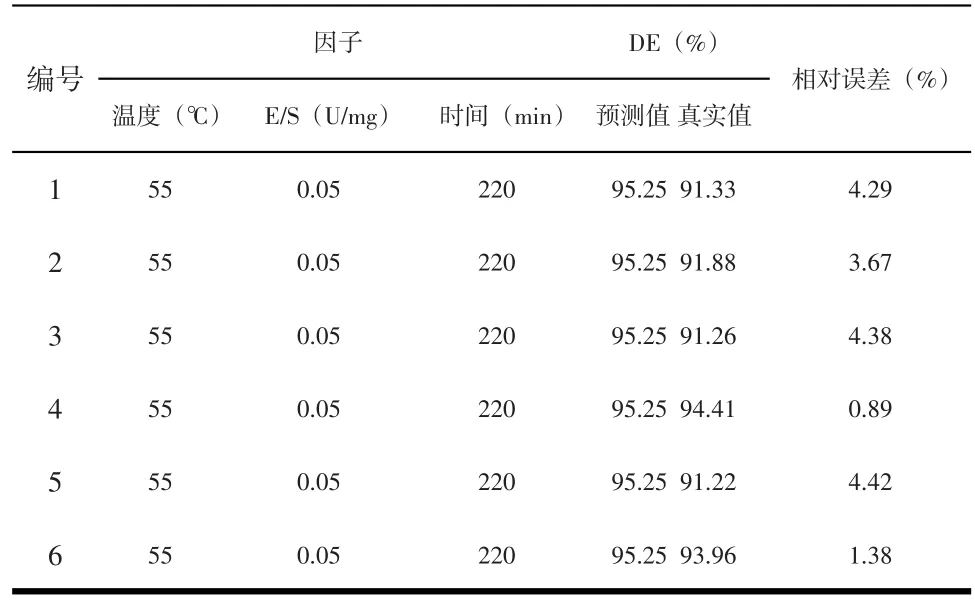
表4 回归模型的6组参数及其验证结果
2.3 Lineweaver-Buck法求酶解参数
以底物浓度对反应速率作图,见图2.表明底物浓度与反应速率的关系符合米氏方程描述的双曲线。以1/V-1/S作图,见图3,Y=16.43589+69.58485X,r=0.993,求得Vmax=0.061mg/mL·min-1,Km=4.234 mg/mL.

图2 底物浓度与反应速率的关系

图3 1/V-1/S
2.4 Ea及△H计算
在35~60℃范围内,反应速率随温度的增加而增大,以lnv对1/T(×103)作图,见图4.呈直线关系,用阿累尼乌斯(Arrhenius)方程拟合:式中:R为气体常数8.31{J/(mol×K)};Ea为活化能(kJ×mol);B为积分常数。上式写成指数形式,K3=A×exp(-Ea/RT),A为前指因子{mg/(mL×min)},Y=-1.84144-1.4428X,r=0.972.求得 Ea=11.995 kJ/moL,A=0.1585889 mg/(mL×min)。平衡常数Ks与温度T服从范特柯夫方程:
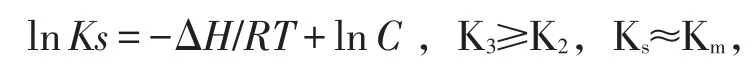
在45~60℃范围内,以不同温度下Km与1/T回归,[20]见图 5,Y=9.60365-2.77355X,r=0.958,△H=23.048 kJ/mol.
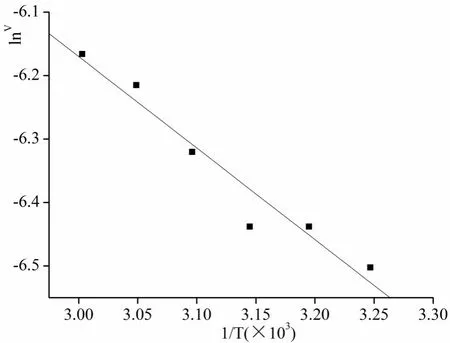
图4 lnv-1/T
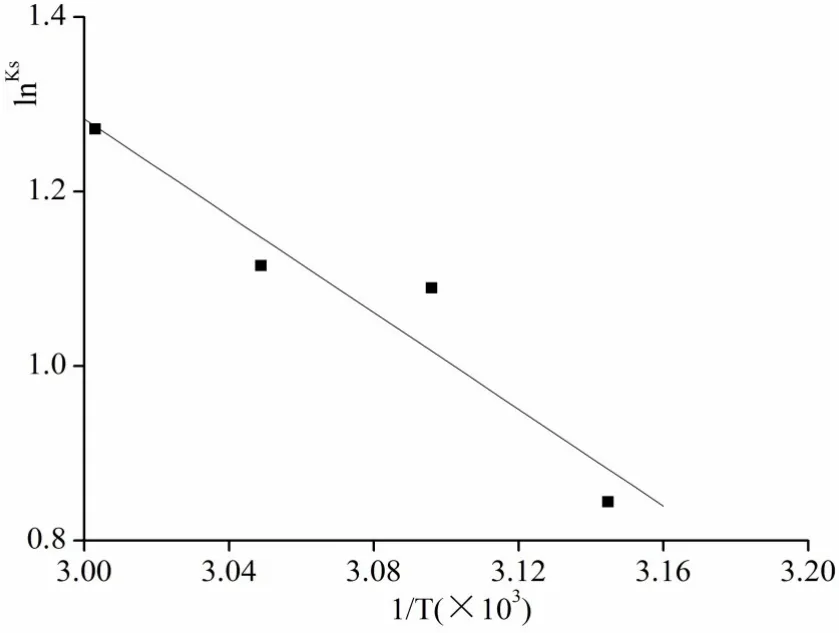
图5 lnKs-1/T
3 结论与讨论
本试验利用响应面法优化α-淀粉酶酶解竹芋淀粉工艺,并对酶解动力学进行研究。在单因素最佳pH和温度条件下,α-淀粉酶酶解竹芋淀粉动力学遵循米氏方程,故可在米氏方程基础上,拟合一般条件下的动力学方程及参数。结果表明:酶解工艺为:时间220min、E/S=0.05U/mg和温度55℃,在此条件下,验证值为(92.34±1.45%,n=6)。在pH 6.0,60℃条件下,Vmax=0.061mg/mL·min-1,Km=4.234mg/mL,Ea=11.995 kJ/moL, △ H=23.048 kJ/mol.后续试验可对α-淀粉酶和糖化酶协同酶解竹芋淀粉的工艺及动力学模型进行研究,如通过控制水解度研究竹芋淀粉的有限水解机理及动力学模型,以及水解过程中产物分子量变化及是否存在产物抑制和底物抑制现象。
[1]杨丽英,张庆滢,李军,等.竹芋的生长习性及开发价值[J].中国野生植物资源,2006,25(3):37-38.
[2]钟红兰,窦晓凤,熊华,等.超声辅助酶解葛根粉及其响应面优化工艺的研究[J].食品工业科技,2013,34(5):134-137.
[3]张洪林,于秀芳,张刚.钙、镁离子对淀粉酶催化激活作用的热动力学[J].物理化学学报,2002,18(12):1125-1128.
[4]于轩,李兆丰,顾正彪,等.淀粉结构对其酶解性能影响的研究进展[J].食品与发酵工业,2012,38(4):137-140.
[5]QI WEI,HE ZHIMIN,SHI DEQING.Product distribution of casein tryptic hydrolysis based on HPSEC analysis and molecular mechanism[J].Chemical Engineering Science,2003,58(3-6):767-775.
[6]黎金,张国权,罗勤贵.荞麦蛋白的碱性蛋白酶酶解动力学研究[J].中国粮油学报,2009,24(6):41-46.
[7]史一一.荞麦淀粉酶水解特性研究[D].杨凌:西北农林科技大学,2007:29.
[8]赵燕,涂勇刚,郭建军,等.玉米淀粉的β-淀粉酶酶解动力学研究[J].食品科学,2009,30(17):190-194.
[9]钟昔阳,杨积东,汤玉清,等.α-淀粉酶酶解小麦面粉动力学模型研究[J].食品科学,2012,33(7):96-100.
[10]李忠海,刘建军,钟海雁,等.响应面法优化甘薯淀粉酶解条件的研究[J].中国粮油学报,2009,24(10):64-69.
[11]张国权,史一一,魏益民,等.荞麦淀粉的真菌淀粉酶酶解动力学研究[J].农业工程学报,2007,23(5):42-46.
[12]张喻,谭兴和,熊兴耀,等.双酶法水解辐射改性马铃薯淀粉动力学研究[J].激光生物学报,2013,22(5):447-452.
[13]董华壮,扶雄,罗志刚,等.双酶协同酶解木薯淀粉的研究[J].现代食品科技,2009,25(2):182-187.
[14]尹志华,汪兰,田斌强,等.竹芋淀粉的物化特性研究[J].中国粮油学报,2008,23(1):66-70.
[15]张惟杰.糖复合物生化研究技术[M].2版.杭州:浙江大学出版社,1999:10-11.
[16]李艳红,刘坚,张涛,等.酶解鹰嘴豆蛋白制备抗氧化肽工艺优化研究[J].农业工程学报,2008,24(1):268-273.
[17]高静,罗志刚,董华壮,等.低取代度木薯淀粉醋酸酯的制备及理化性质的研究[J].现代食品科技,2008,24(8):756-758.
[18]郑宝东.食品酶学[M].南京:东南大学出版社,2006:88.
[19]蔡丽华,马美湖.4种常用蛋白酶对牛骨蛋白的酶解动力学研究[J].食品科学,2010,31(5):150-154.
[20]任省涛,程可可,宋安东,等.蒸汽爆破玉米秸秆酶解动力学[J].生物工程学报,2011,27(4):592-597.

