戈舍瑞林联合芳香化酶抑制剂治疗转移性乳腺癌的研究
麦泽锋
(海南省人民医院,海南 海口 570311)
转移性乳腺癌是晚期乳腺癌常见的类型之一,也是治疗的难点,目前临床只能通过手术或药物治疗延长患者生存期,提高其生活质量[1]。近期有研究提出,戈舍瑞林联合芳香化酶抑制剂可有效抑制脑垂体促黄体生成素的合成,并作用于卵巢,改善血清雌激素水平,增强治疗效果[2]。为进一步探究戈舍瑞林联合芳香化酶抑制剂治疗转移性乳腺癌的疗效,本研究选取102例转移性乳腺癌患者进行分析,旨在提供最佳治疗方案。现报道如下。
1 资料与方法
1.1 一般资料
选取2011年1月-2013年1月于海南省人民医院收治的102例转移性乳腺癌患者作为研究对象,均为女性,采用随机数字表法将其分为对照组和研究组,每组51例。其中,对照组患者年龄20~45岁,平均(36.54±5.23)岁;淋巴结转移24例,骨转移12例,内脏转移15例。研究组患者年龄22~45岁,平均(36.78±5.23)岁;淋巴结转移21例,骨转移13例,内脏转移17例。纳入标准:①女性,且符合《妇产科学》中乳腺癌的诊断标准,经影像学检查显示存在远处转移[3];②近期未服用对实验结果产生影响的药物;③依从性好,自愿签署知情协议,配合治疗及随访。排除标准:①常规血液学检查异常,或伴有严重心﹑脑及血管疾病;②预期生存时间<3个月;③伴有严重肝肾功能不全。两组患者临床资料和转移情况比较,差异无统计学意义(P>0.05)。
1.2 治疗方法
对照组患者采用常规治疗方法,给予口服他莫昔芬片(山东健康药业有限公司,规格:10 mg,批准文号:H37022925)1片/次,2次/d,28 d为1个疗程,连续治疗2个疗程。
研究组使用卵巢去势药物戈舍瑞林联合芳香化酶抑制剂治疗,给予研究组戈舍瑞林(英国AstraZeneca公司,规格:3.6 mg/支,批准文号:国药准字X19990231)3.6 mg/次,皮下注射,28 d/次;来曲唑(江苏恒瑞医药股份有限公司,规格:2.5 mg,批准文号:国药准字:H19991001)2.5 mg/次,1次/d,28 d为1个疗程,连续治疗2个疗程。
1.3 观察指标与评定方法
治疗后观察两组患者临床疗效,参照实体瘤疗效评价标准:包括完全缓解(complete response, CR)﹑部分缓解(partial response, PR)﹑疾病稳定(stable disease, SD)及疾病进展(progressive disease, PD),由于骨转移病灶为不可测量病灶,临床疗效分为CR﹑PR及SD,客观缓解率为完全缓解与部分缓解例数之和的比例,临床获益率=CR﹑PR及SD持续时间>6个月的患者数之和/总例数×100%[4]。
记录观察治疗期间出现的不良反应情况。通过电话或网络等形式随访3年,每1~2个月随访1次,记录两组患者生存情况,本研究无失访。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计数资料以率表示,比较用χ2检验;等级资料以频数表示,比较用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
两组患者临床疗效比较,差异有统计学意义(P<0.05),两组患者客观缓解率比较,差异有统计学意义(P<0.05)。研究组与对照组CR﹑PR及SD持续时间>6个月的患者数分别为39和21例,即临床获益率分别为76.47%,41.18%,两组比较,差异有统计学意义(P<0.05)。见表 1。
2.2 两组患者随访3年的生存率比较
两组患者随访3个月﹑6个月及1年期的生存率比较,差异无统计学意义(P>0.05)。3年后研究组失访了2例患者,生存率为51.02%,对照组失访了3例患者,生存率为29.17%,两组比较,差异有统计学意义(χ2=4.151,P=0.042)。见表2。
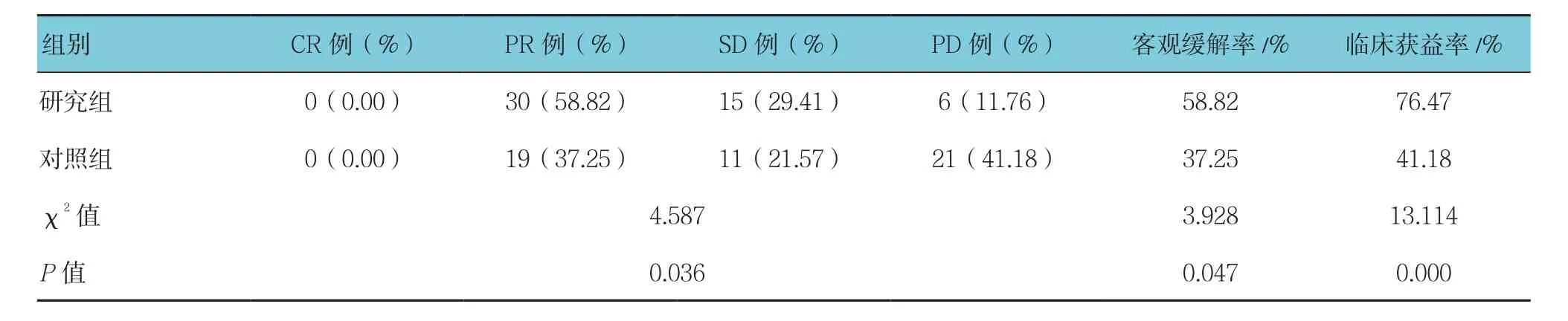
表1 两组患者临床疗效的比较 (n =51)
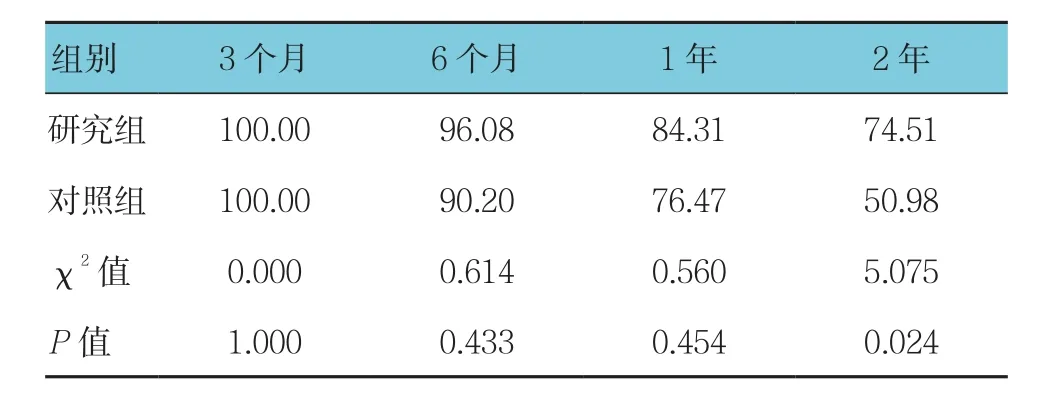
表2 两组患者随访3年生存率比较 (n =51,%)
2.3 患者不良反应比较
对照组患者出现潮热4例,恶心呕吐2例,乏力多汗2例,水肿3例,不良反应发生率为21.57%,研究组患者出现潮热1例,皮疹1例,乏力多汗1例,不良反应发生率为5.88%,两组不良反应发生率比较,差异有统计学意义(χ2=5.299,P=0.021)。
3 讨论
乳腺癌为威胁女性生命健康的常见恶性肿瘤,而其具体病因尚未完全明确。有关资料显示,该病的发生与年龄﹑遗传﹑高龄初产﹑电离辐射及避孕药的使用等因素有关[5]。随着早期诊断水平的不断升高,手术方法不断改进,乳腺癌治疗总体生存率提高,然而大多患者最终不可避免的发生复发或转移。转移性乳腺癌无法再次承受手术损伤,难以进行手术治疗,多采用药物治疗。内分泌治疗较化疗毒性低,缓解率高,不良反应少,被广泛应用于临床治疗转移性乳腺癌[6-7]。内分泌治疗的目的为延长患者生存期,提高患者生活质量,成为治疗转移性乳腺癌的全身治疗的主要手段,具有疗效肯定﹑安全性高及患者可长期服用等优点[8]。
临床上常用内分泌治疗药物为他莫昔芬,他莫昔芬为一种抗雌激素药物,属于非固醇类,其结构与雌激素相似,存在Z型和E型两种异构体,其中Z型异构体进入细胞内,与雌激素受体结合,形成受体复合物,阻止雌激素发挥作用,从而抑制乳腺癌细胞增殖分化。E型异构体具有弱雌激素活性,与Z型异构体化学性质及生理活性均存在不同程度差异。他莫昔芬作为绝经前乳腺癌内分泌治疗的主要药物,其疗效毋庸置疑[9-10]。有关研究表明,他莫昔芬在治疗早期乳腺癌患者中疗效显著,对于缓解患者症状,降低死亡率,提高生存期有显著疗效[11]。然而,对于绝经后转移性乳腺癌患者其疗效下降,治疗后生存率较低,治疗效果并不理想[12]。在本研究中,采用他莫昔芬治疗的对照组远期生存率较低,临床治疗效果较差,推测:本研究中研究对象绝经后女性较多。
卵巢去势方法主要包括双侧卵巢切除手术和药物去势,由于双侧卵巢切除手术创伤较大,及其不可逆性,不能被大多数患者接受,因此,在本研究中卵巢去势仅采用药物去势。常用卵巢去势药物为戈舍瑞林,该药物为一种促黄体激素释放激素类似物激动剂,其治疗转移性乳腺癌的主要机制如下:该药物可以与促黄体激素释放激素受体长久强效的结合,抑制卵巢产生雌激素;戈舍瑞林可以通过抑制垂体分泌促性腺激素,降低性腺功能,可通过阻止卵巢进入卵泡池的募集过程发挥作用,进而保护卵巢[13];此外戈舍瑞林为一种可逆性的卵巢功能抑制药物,使用该药物6个月后,使用者月经功能可恢复,对卵巢伤害作用较小。芳香化酶为一种复合酶,存在于机体卵巢,肌肉组织或脂肪中,主要参与机体醛甾酮,皮质类固醇等合成过程中不同阶段[14]。来曲唑为一种新型的芳香化酶抑制剂,属于人工合成的苄三唑类衍生物。该药物可通过抑制芳香化酶活性,阻止雄激素向雌激素的转化,降低刺激素水平,消除雄激素对肿瘤成长的刺激作用,适用于绝经后转移性乳腺癌患者。此外,来曲唑毒性小,对全身器官及靶器官没有潜在毒性﹑药理作用强﹑不良反应小﹑耐受性好及抗肿瘤作用较强[15]。因此,将卵巢去势戈舍瑞林联合芳香化酶抑制剂来曲唑起共同治疗转移性乳腺癌理论上具有显著疗效。
在本实验研究结果中,研究组生存率﹑客观缓解率及临床获益率高于对照组,提示:戈舍瑞林联合芳香化酶抑制剂来曲唑可提高转移性乳腺癌患者长期生存率,疗效均显著。分析其原因:来曲唑抗肿瘤作用前,且不影响肾上腺皮质激素和甲状腺功能,治疗指数较高,戈舍瑞林对抑制卵巢产生雌激素具有较强的作用,两者联合使用可增强其疗效。
综上所述,内分泌治疗为转移性乳腺癌的主要治疗手段,而卵巢去势药物戈舍瑞林联合芳香化酶抑制剂可提高患者客观缓解率及临床获益率,并提高生存率,减少不良反应,安全性高,在临床应用上具有借鉴意义和推广价值。
参 考 文 献:
[1]CARLSON R W, O’NEILL A, VIDAURRE T, et al. A randomized trial of combination anastrozole plus gefitinib and of combination fulvestrant plus gefitinib in the treatment of postmenopausal women with hormone receptor positive metastatic breast cancer[J].Breast Cancer Research and Treatment, 2012, 133(3): 1049-1056.
[2]杨婷婷, 王涛, 边莉, 等. 卵巢功能去势联合芳香化酶抑制剂治疗绝经前转移性乳腺癌的临床研究[J]. 临床肿瘤学杂志, 2013,18(06): 521-524.
[3]彭裕文, 丰有吉, 李笑天, 等. 妇产科学[M]. 上海: 复旦大学出版社, 2005: 154.
[4]刘秋华, 林榕波. 实体瘤疗效评价标准(RECIST)指南1.1版[C].全国临床肿瘤大会暨csco学术年会, 2009.
[5]SCHULER M, AWADA A, HARTER P, et al. A phase II trial to assess efficacy and safety of afatinib in extensively pretreated patients with HER2-negative metastatic breast cancer[J]. Breast Cancer Research and Treatment, 2012, 134(3): 1149-1159.
[6]SMITH M L, WHITE CB, RAILEY E, et al. EXAMINING And predicting drug preferences of patients with metastatic breast cancer:using conjoint analysis to examine attributes of paclitaxel and capecitabine[J]. Breast Cancer Research and Treatment, 2014,145(1): 83-89.
[7]顾军, 于泽平. 乳腺癌手术后辅助内分泌治疗研究进展[J]. 医学研究生学报, 2012, 25(01): 107-112.
[8]郑飞, 姜达. 乳腺癌内分泌治疗研究进展[J]. 肿瘤基础与临床,2012, 25(01): 84-88.
[9]卢强. 他莫昔芬与托瑞米芬治疗复发或转移性乳腺癌的临床对比研究[J]. 当代医学, 2011, 17(26): 128-129.
[10] 张瑾, 温灵珠. 探讨依维莫司联合他莫昔芬对激素受体阳性及HER2阴性转移性乳腺癌患者的作用[J]. 循证医学, 2013,13(03): 138-140.
[11]陈萌, 路洪超, 耿翠芝. 人类乳腺癌抗雌激素药物耐药基因与他莫昔芬耐药关联性的研究进展[J]. 河北医科大学学报,2013, 34(05): 612-614.
[12]童刚领, 李柱, 农巧红, 等. 他莫昔芬治疗芳香化酶抑制剂耐药的激素受体阳性绝经后转移性乳腺癌患者的临床研究[J].现代肿瘤医学, 2015, 23(07): 966-968.
[13]刘洋, 田欣, 吴荣. 戈舍瑞林联合依西美坦治疗绝经前及围绝经期复发转移性乳腺癌的疗效分析[J]. 实用药物与临床,2014, 17(11): 1435-1439.
[14]胡旭明, 欧阳取长. 卵巢功能去势联合芳香化酶抑制剂治疗绝经前转移性乳腺癌的临床观察[J]. 中国医药导刊, 2014,16(12): 1494-1495.
[15]吴小亮, 汤明, 邹彦, 等. 来曲唑内分泌治疗绝经后受体阳性转移性乳腺癌疗效观察[J]. 遵义医学院学报, 2013, 36(03):251-253.

