原发性胆汁性肝硬化患者超声评分与临床病理分期的相关性*
郝娟,陶艳艳,周扬,邢枫,朱春雾,刘成海
(上海中医药大学附属曙光医院 肝病研究所,上海 201203)
原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)是慢性肝内胆汁淤积性疾病,最终可进展为肝硬化[1]。PBC的患病率为1.91~40.20/10万,呈逐年增高趋势[2]。肝活检是诊断PBC﹑排除其他疾病及判断预后的金标准。因其是有创检查,较多患者不适合或不愿意接受。临床分期存在阶段范围跨度过大,也不能很好地评估病情的严重程度。本研究分析PBC患者的肝脏超声特点与临床病理分期之间的相关性,阐述超声检查在判断PBC患者病情变化中的实用性。
1 资料与方法
1.1 一般资料
选取2008年4月-2016年10月于上海中医药大学附属曙光医院﹑普陀区中心医院及上海交通大学附属仁济医院肝病科门诊及住院首次确诊为PBC患者215例。其中,男性20例,女性195例,男女比例为1.00:9.75;平均年龄(55.57±10.47)岁;平均病程(3.30±3.19)年。临床症状:乏力183例(85.12%)﹑皮肤瘙痒95例(44.19%)﹑肝区不适108例(50.23%)﹑口干101例(46.98%)﹑腹胀96例(44.65%)﹑失眠88例(40.93%)。体征:脾肿大110例(51.16%)﹑黄疸36例(16.74%)﹑腹水38例(17.67%)﹑双侧下肢水肿33例(15.35%)。所有患者的诊断符合原发性胆汁性肝硬化(又名原发性胆汁性胆管炎)诊断和治疗共识(2015)[1]。即符合以下3项中的2项即可诊断为PBC。①胆汁淤积的生物化学指标如碱性磷酸酶(alkaline phosphatase, ALP)升高;②血清抗线粒体抗体(anti-mitochondrial antibody, AMA)或AMA-M2亚型阳性;③肝脏组织病理学符合PBC。
1.2 研究指标
1.2.1 肝脏病理学检查 由本院肝硬化科2位医师在超声引导下行细针穿刺肝活检,穿刺针规格为16~18 G,穿刺标本长度≥1.5 cm,穿刺后标本固定于10%的甲醛溶液中,并送本院病理科完成包埋﹑切片﹑染色及读片过程。参照Ludwig的标准病理分期分为4期:Ⅰ期胆管炎期,Ⅱ期汇管区周围炎期,Ⅲ期进行性纤维化期,Ⅳ期肝硬化期[3]。
1.2.2 临床分期 根据PBC的发展自然史,临床分为4个阶段[1]:第一阶段为临床前期,表现为AMA阳性,无临床症状,生化指标正常;第二阶段为无症状期,表现为生化指标异常,无临床症状;第三阶段为症状期,出现乏力﹑皮肤瘙痒等症状;第四阶段为肝功能失代偿期,血清胆红素进行性升高,出现消化道出血﹑腹水及肝性脑病等表现。收集患者一般资料包括年龄﹑性别及病程等。临床症状包括乏力﹑黄疸﹑皮肤瘙痒及腹胀等。体征包括肝脾肿大﹑巩膜皮肤黄染﹑腹腔积液﹑面色晦暗及下肢水肿等。实验室指标包括肝功能﹑血脂﹑自身免疫抗体和免疫球蛋白,具体如下:丙氨酸氨基转移酶(alanine transaminase,ALT)﹑天冬氨酸氨基转移酶(aspartate transaminase,AST)﹑ALP﹑γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase, γ-GT)﹑ 总 胆 汁 酸(total bile acid,TBA)﹑白蛋白(Albumin, ALB)﹑球蛋白(Globulin,GLO)﹑总胆固醇(total cholesterol, TC)﹑总胆红素(total bilirubin, TBIL)﹑直接胆红素(direct bilirubin, DBIL)﹑AMA﹑AMA-M2﹑抗平滑肌抗体(anti-smooth muscle antibody, ASMA)﹑抗肝肾微粒体抗体-1型(anti-liver kidney microsome-1, 抗LKM-1)﹑抗肝细胞溶质抗原-1型(anti-liver cytosol-1, 抗LC-1)﹑抗可溶性肝抗原/肝胰抗原抗体(anti-soluble liver antigen/liver pancreas antigen, 抗SLA/LP)﹑抗核抗体(antinuclear antibodies,ANA)﹑免疫球蛋白G(Immunoglobulin G, IgG)及免疫球蛋白M(Immunoglobulin M, IgM)。
1.2.3 超声特征 根据PBC患者的超声形态学变化,将肝脏表面和边缘﹑实质回声与分布及肝内血管走向等情况分为0~4分。0分:肝脏表面光滑,边缘锐,肝实质回声正常,分布均匀,肝内血管走向清晰;1分:肝脏表面光滑,边缘锐,肝实质回声稍有增粗,分布尚均匀,肝内血管走向清晰;2分:肝脏表面欠光滑,边缘稍钝,肝实质回声增粗,分布不均匀,肝内血管走向欠清晰;3分:肝脏表面不规则,边缘钝,肝实质回声增密增粗,分布不均匀,肝脏血管走向不清晰;4分:肝脏表面凹凸不平,呈锯齿状,边缘钝,肝实质回声增密增粗,分布呈结节状或斑片状,肝内血管粗细不等﹑走向紊乱。
1.3 统计学方法
数据分析采用SPSS 17.0统计学软件,计量资料以均数±标准差(±s)表示;等级资料以频数表示,比较做秩和检验(H检验);相关分析用Spearman秩相关,P<0.05为差异有统计学意义。
2 结果
2.1 PBC患者的自身免疫抗体情况
215例PBC患者血清AMA阳性179例(83.26%),AMA-M2阳性157例(73.02%),两者均为阴性15例(6.98%)。ASMA﹑抗SLA/LP﹑抗LC-1和抗LKM-1阳性各1例(0.47%)。ANA阳性135例(62.79%),均质型29例(13.49%),颗粒型(27.44%)及着丝点型31例(14.42%)。
2.2 PBC患者的肝功能、血脂和免疫球蛋白水平
215例PBC患者ALP﹑γ-GT升高,ALT和AST轻度偏高;TC升高;IgM明显升高,IgG轻度偏高。见表1。
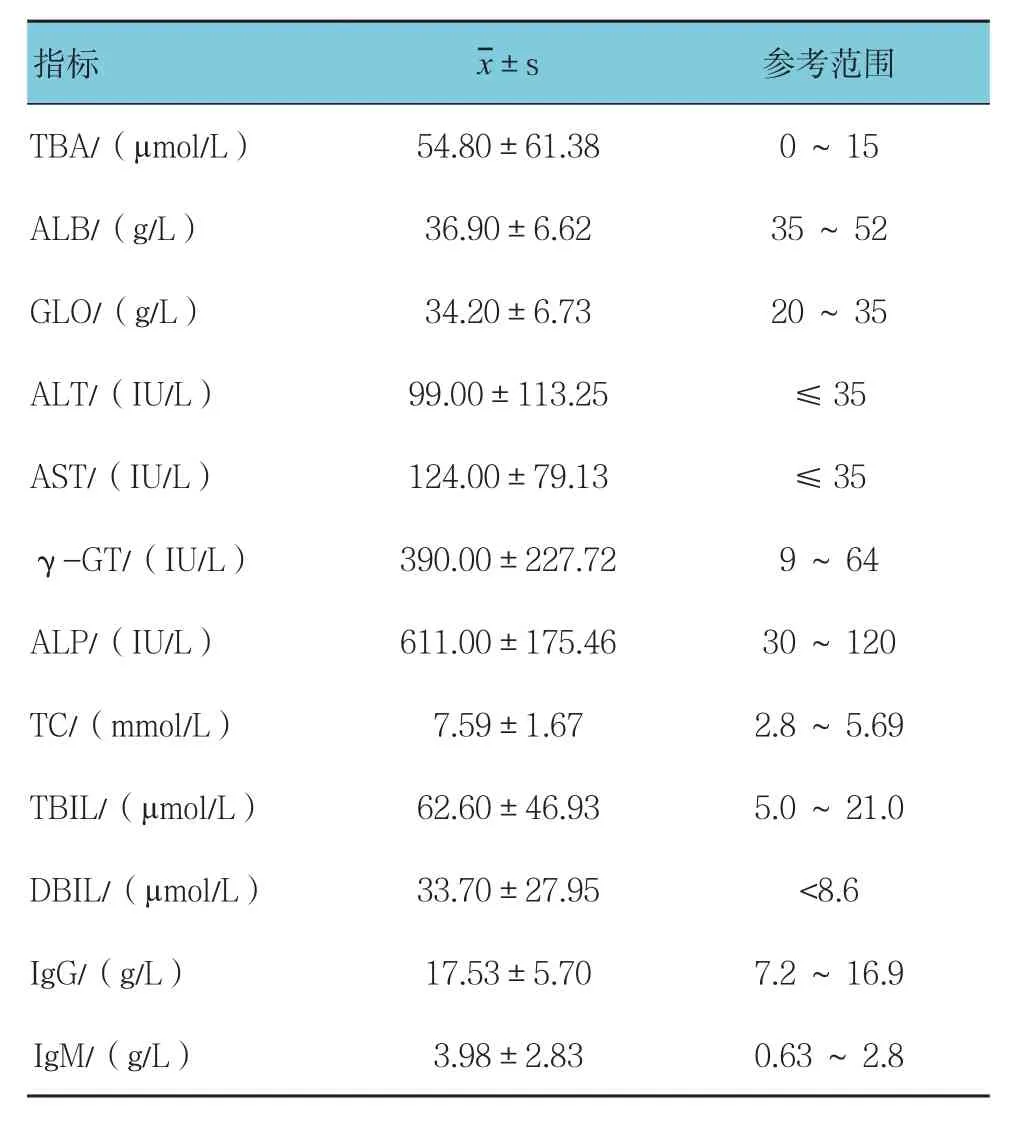
表1 215例PBC患者的实验室检查指标与正常人的参考范围
2.3 PBC患者的超声评分、临床和病理分期情况
215例PBC患者的超声评分:0分8例(3.72%),1分 35例(16.28%),2分 46例(21.40%),3分 57例(26.51%),4分69例(32.09%)。215例PBC患者的临床分期:临床前期4例(1.86%),无症状期7例(3.26%),症状期173例(80.47%),肝功能失代偿期31例(14.42%)。PBC患者中有64例进行了肝活检,其病理分期:Ⅰ期10例(15.63%),Ⅱ期12例(18.75%),Ⅲ期23例(35.94%),Ⅳ期19例(29.69%)。超声评分:0分1例(1.56%),1分6例(9.38%),2分17例(26.56%),3分20例(31.25%),4分20例(31.25%)。临床分期:临床前期0例,无症状期2例(3.13%),症状期58例(90.63%),肝功能失代偿期4例(6.25%)。
2.4 PBC患者超声评分与临床、病理分期之间的关系
215例PBC患者超声评分与临床分期之间有相关性(r=0.326,P=0.000)。64例肝活检 PBC患者不同病理分期的超声评分比较,差异有统计学意义(H=25.406,P=0.000),超声评分的变化趋势与病理分期一致。64例肝活检PBC患者的临床分期主要集中在症状期,且症状期可表现为病理的不同分期,亦体现症状期患者病情轻重不一。64例肝活检PBC患者的病理分期﹑超声评分与临床分期之间无相关性(r=0.196和0.190,P=0.121和0.133)。见表 2﹑3。
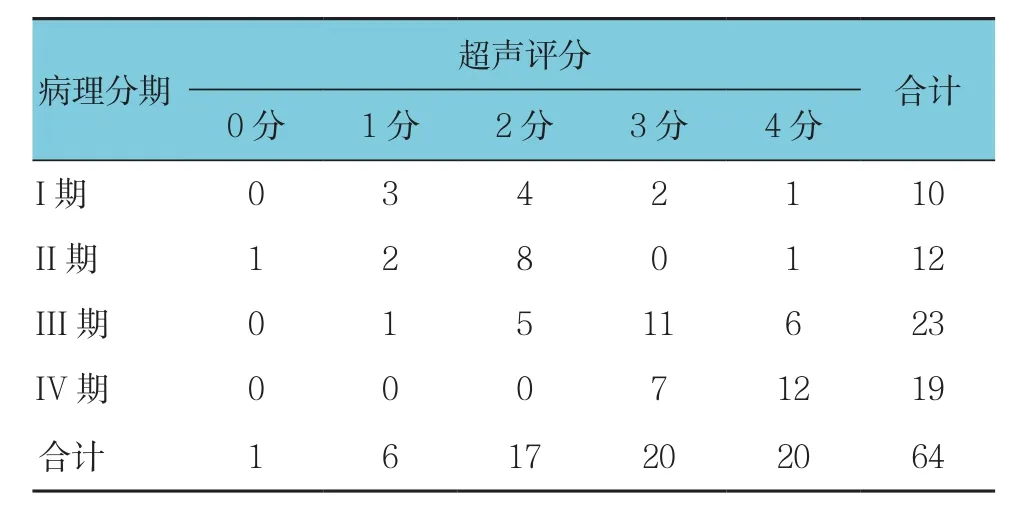
表2 64例肝穿刺PBC患者不同病理分期的超声评分比较 (频数)
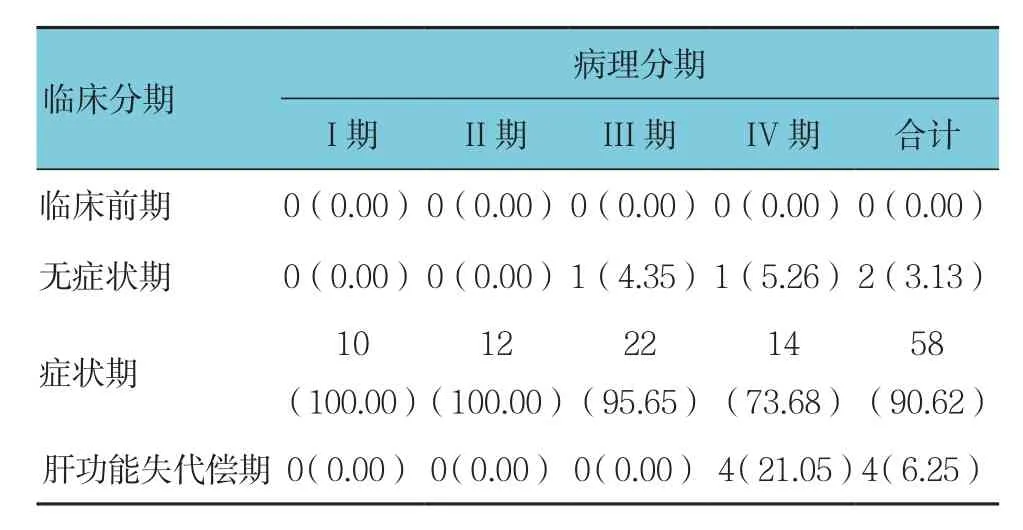
表3 64例肝穿刺PBC患者不同临床分期与病理分期的描述 例(%)
3 讨论
PBC的病理改变以进行性﹑非化脓性及破坏性肝内小胆管损伤为特征,最终可发展为胆汁淤积性肝硬化[1,4]。肝组织病理学检查是PBC诊断和病情评估的金标准,但肝活检是有创检查,存在出血﹑取样误差等不足,患者依从性较差,不能作为动态观察病情变化的检查项目。临床分期中的临床前期和无症状期,患者均无不适症状,不能引起足够重视,早期诊断PBC比较困难;症状期跨度范围较大,病情轻重不一;肝功能失代偿期患者已出现了腹水﹑消化道出血及肝性脑病等表现,病情重且容易反复。因此,临床分期也不能及时的判断PBC的病情轻重变化。
腹部彩色多普勒超声是临床常用的检查项目,因其无创﹑快捷及廉价等优点而被大多数患者所接受。PBC的不同阶段,肝脏形态大小﹑包膜﹑实质回声及血管走行等情况均有不同程度的变化,与病情的严重程度密切相关。PBC患者的超声特点表现为:肝脏实质回声较强,呈细密结节状,肝内胆管轻度扩张,胆管壁水肿﹑回声增强;随病情发展,肝脏血流动力学也发生变化,晚期可出现门静脉扩张﹑脾大及腹水等改变[5]。本研究分析PBC患者的超声特征与临床分期﹑病理分期之间的相关性,结果显示超声评分与病理分期之间的相关性强,表现为超声评分的变化趋势与病理分期相一致,而超声评分与临床分期﹑病理分期与临床分期之间的相关性均不高,可能与临床分期的范围过大有关。隋鑫等[6]研究彩色多普勒超声显像在原发性胆汁性肝硬化诊疗中的作用,结果表明二维超声显像能够直观显示PBC患者肝实质的受损情况,PBC患者的彩色多普勒超声显像随病情加重,肝功能﹑门静脉﹑肝静脉内径﹑流速及频谱都有相应的变化,与肝脏组织病理分期的结果一致。多项临床研究比较原发性胆汁性肝硬化患者的超声诊断特点与病毒性肝硬化之间的差别,结果显示PBC患者的超声显像多表现为肝脏弥漫性肿大﹑肝实质回声呈细颗粒状﹑肝内再生结节不明显﹑肝包膜增厚及门静脉流速降低等,与病毒性肝硬化患者的超声表现有差异,可用于两者之间的鉴别诊断[7-10]。可见,PBC具有特征性的超声显像。
此外,对于胆汁淤积性肝病患者,首选肝胆系统超声检查排除胆道梗阻类疾病。一项国际多中心研究显示PBC患者肝细胞癌的年发病率为3.4/1000[11]。在国内PBC患者中,肝细胞癌的发生率为4.13%(52/1255),男性高于女性[12]。可见,肝细胞癌在PBC患者中的发病率并不低,对于肝硬化患者,尤其是进展期,应每6个月行肝脏超声检查以筛查肝细胞癌[1]。
PBC患者随病情发展,肝脏形态及肝实质损伤程度均有相应的改变,腹部彩超检查对PBC患者的病情判断有重要的指导意义,但不适合或不愿接受肝活检的患者。
参 考 文 献:
[1]陈成伟, 成军, 窦晓光, 等. 原发性胆汁性肝硬化(又名原发性胆汁性胆管炎)诊断和治疗共识(2015)[J]. 临床肝胆病杂志,2015, 31(12): 1980-1988.
[2]BOONSTRA K, BEUERS U, PONSIOEN C Y. Epidemiology of primary sclerosing cholangitis and primary biliary cirrhosis: a systematic review[J]. J Hepatol, 2012, 56(5): 1181-1188.
[3]LUDWIG J, DICKSON E R, MCDONALD G S. Staging of chronic nonsuppurative destructive cholangitis (syndrome of primary biliary cirrhosis)[J]. Virchows Archiv. A, Pathological anatomy and histology, 1978, 379(2): 103-112.
[4]CAREY E J, ALI A H, LINDOR K D. Primary biliary cirrhosis[J].Lancet, 2015, 386(10003): 1565-1575.
[5]陈海淼, 苏颖, 张世雄. 彩色多普勒超声对原发性胆汁性肝硬化诊断价值[J]. 中国实用医药, 2015, 10(01): 44-45.
[6]隋鑫, 房勤茂, 张文云, 等. 彩色多普勒超声显像在原发性胆汁性肝硬化诊疗中的应用[J]. 河北医药, 2011, 33(20): 3099-3101.
[7]满守东, 吴长君, 宋光平. 原发性胆汁性肝硬化的超声诊断特点分析[J]. 中国医疗前沿, 2009, 4(16): 70-71.
[8]陈立军, 罗欢. 原发性胆汁性肝硬化与病毒肝炎性肝硬化超声诊断的对比分析[J]. 中国医药指南, 2013, 11(23): 637-638.
[9]洪莉. 超声诊断病毒肝炎性肝硬化与原发胆汁性肝硬化的对照观察[J]. 微量元素与健康研究, 2015, 32(06): 1-2.
[10]陈重, 张新力, 卢福昱. 自身免疫性肝病与慢性乙型病毒性肝病超声影像对比分析[J]. 临床肝胆病杂志, 2006, 22(03): 187-188.
[11]TRIVEDI P J, LAMMERS W J, VAN BUUREN H R, et al.Stratification of hepatocellular carcinoma risk in primary biliary cirrhosis: a multicentre international study[J]. Gut, 2016, 65(2):321-329.
[12]ZHANG X X, WANG L F, JIN L, et al. Primary biliary cirrhosisassociated hepatocellular carcinoma in Chinese patients:incidence and risk factors[J]. World J Gastroenterol, 2015, 21(12):3554-3563.

