配制Na2S2O3、I2标准溶液过程中的误差来源
(唐山三友集团有限公司,河北 唐山 063305)
硫代硫酸钠(Na2S2O3)、碘(I2)两种标准溶液多用来测定硫化物的含量,在纯碱行业应用广泛。在纯碱生产过程中,为了减轻铁质的设备、管道的锈蚀,通常在母液系统中加入硫化钠溶液。如果硫化钠加入过量,会使纯碱颜色发黄。可见,硫化钠是非常重要的一个分析指标。在分析中,我们发现测定硫化钠的硫代硫酸钠、碘两种标准溶液稳定性差,在标定这样两种标液时应用的“四平衡、四对照”工作中存在标定数据误差大的现象[1],下面从这两种标准溶液的配制方面分析误差来源。
硫代硫酸钠和碘标准溶液都属于氧化还原性标准溶液,性质不稳定,在配制标准溶液前,必须首先配制储备液。
1 储备液的配制
1.1 硫代硫酸钠储备液[2]
1)配制用水中如有CO2存在,Na2S2O3易分解,反应为:
Na2S2O3+H2CO3=NaHCO3+NaHSO3+S↓
故配制时必须将配制用蒸馏水煮沸30 min,以去除溶解在水中的CO2,冷却后使用。CO2的分解作用一般在制成溶液10天后才能用于配制标准溶液,因为有沉淀产生,使用时需过滤。
2)Na2S2O3易被空气和微生物分解,反应为:
2Na2S2O3+O2=2Na2SO4+2S↓
Na2S2O3=Na2SO3+S↓
为了增加硫代硫酸钠储备液的稳定性,在配制的储备液中应适当加入少量碳酸钠基准试剂,比如,配制1 L(1 mol/L)的Na2S2O3储备液加入0.2 g基准碳酸钠,使溶液呈弱碱性,可防止微生物生长,并将配制好的储备液煮沸10 min后冷却放置,密闭存储。
同时,Na2S2O3本身是一种不稳定的还原剂,日光可使其分解,应避光储存。
1.2 碘储备液
因为I2在水中的溶解度很小,所以配制I2储备液时,应加入一定量的KI,促使I2溶解。另外,I2挥发性极强,保存时要密闭存储,且储备液也要于暗处存储于棕色具塞瓶中,防止挥发。
2 标准溶液的标定
通常分析硫化钠所用的硫代硫酸钠、碘两种标准溶液的浓度为0.1000 mol/L,存储液浓度为1 mol/L。标定Na2S2O3时,采用重铬酸钾法。
2.1 方法原理[3]
在酸性介质中,用K2Cr2O7氧化碘化钾,生成游离碘,再以淀粉为指示剂,用待标定的Na2S2O3还原,反应为:
K2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+3I2+4K2SO4+7H2O
I2+2Na2S2O3=Na2S4O6+2NaI
2.2 计算公式
式中:m——烘至恒重(120±2 ℃)的重铬酸钾的质量,g;
M——重铬酸钾摩尔质量的数值M(1/6 K2Cr2O7)=49.03 g/mol;
V——滴定中硫代硫酸钠溶液消耗的体积,mL;
V0——空白实验硫代硫酸钠溶液的体积,mL。
2.3 实验过程
2.3.1 滴定环境
2.3.1.1 浓度影响
重铬酸钾在第一步反应中由Cr6+→Cr3+,I-→I2,第二步用硫代硫酸钠滴定I2时,滴定终点前I2遇淀粉变蓝,由于墨绿色Cr3+的干扰,使终点很难观察,造成较大的读数误差,因而应在第二步反应前加水稀释降低浓度,使颜色变浅,终点时由蓝色变为亮绿色才易于观察。之所以在第二步反应前加水,而不在实验开始,是因为第一步反应很慢,在稀释液中会更慢。大量实验证明在滴定过程中维持溶液总体积为250 mL左右为最佳,原方法未对加水量作明确规定,此过程加水量的不同是标定中产生结果误差的重要原因之一。
2.3.1.2 酸度影响
此方法第一步反应中要求是强酸性环境,一般加入20%的硫酸,但第二步反应必须在弱酸性或中性溶液中进行,防止硫代硫酸钠分解。因而酸度调节非常必要,其中加水稀释也是降低酸度的重要途径,可谓一举两得。
2.3.2 静置时间
如前所述,第一步反应重铬酸钾与碘化钾反应较慢,为使反应充分完全进行,需要于暗处静置10 min,为防止I2的挥发,在静置过程中,必须使用碘量瓶,并对配套瓶盖进行水封。
2.3.3 滴定速度
在第二步反应滴定过程中,由于I2极易挥发,同时,在酸性环境中过剩的I-(第一步反应加入KI过量)极易被空气氧化成I2引起滴定误差,因而,在用未知浓度的硫代硫酸钠滴定碘时,在指示剂加入前不能充分摇晃碘量瓶,应轻轻晃动,但在淀粉指示剂加入后,应完全充分晃动,避免淀粉吸附I2,造成结果误差。
2.3.4 指示剂加入时间
淀粉指示液(10 g/L)加入过早,则大量的I2与淀粉结合成蓝色物质,这部分I2不易与Na2S2O3反应,使终点提前,产生误差,故应在近终点时加入。
2.3.5 空白实验
在空白实验中加入的KI及硫酸将使I2生成,在静置10 min期间,即使用碘量瓶,也不可避免接触部分氧气。另外,分析用的蒸馏水中少量的溶解氧会加速I2的生成,其反应式如下:
4I-+4H++O2=2I2+2H2O
消耗的此部分Na2S2O3的量可引起结果误差。
2.4 碘标液的标定
因为碘的挥发性较大,所以在标定碘标液时常采用反标,以Na2S2O3为标准滴定溶液,反应原理、滴定环境及指示剂等因素同标定Na2S2O3的第二步反应,除此之外,碘的空白试验是标定中的关键步骤,是引起碘标准液误差的另一重要因素。
2.4.1 空白试验
由于水中溶解氧及空气会消耗部分碘,因而碘空白试验方法:取水250 mL(15~20 ℃),加0.05~0.2 mL配制好的碘标准溶液及2 mL淀粉指示液(2 g/L),用硫代硫酸钠标准溶液滴定至溶液蓝色消失。
2.4.2 计算公式
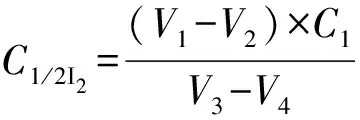
式中:V1——Na2S2O3标准溶液滴定的体积数,mL;
V2——空白试验中消耗Na2S2O3标准溶液的体积数,mL;
V3——滴定时吸取I2溶液的体积数,mL;
V4——空白实验中加入I2标准溶液准确的体积数,mL;
C1——Na2S2O3标准溶液的浓度,mol/L。
严格地讲,在配制碘标准溶液过程中,因浓度的不断调整,加水前后空白值会有所改变,因而,为减少误差,在最后确定碘标准溶液浓度前,应再一次测定空白值。
3 使用中误差的来源及减小措施
硫代硫酸钠与碘标液在使用中,无论是直接碘量法还是间接碘量法所要求的滴定环境以及各个环节的影响因素与标定时的要求一样。为了保证待测产品分析的准确性,减小误差的产生,要缩短药品的有效期,避光储存,标液中若有浑浊、沉淀及颜色变化时必须重新标定。
4 结 论
误差可能来自多方面因素,有些待测产品中杂质成分不明确,或杂质含量高也有可能引起较大误差。除不可控因素外,严格精细操作是保证准确度的重要环节,特别是针对稳定性差的标准溶液,在分析过程中必须从源头控制。严格遵循标准溶液的自身特性,明晰各个环节的原理,满足要求的配标环境以及滴定条件,真正精细化操作,才能最大限度地降低误差,从而保证标准溶液的准确性,为提高分析准确度、服务生产,提供有力保障。
[1] 罗盛旭,范春蕾.分析化学实验[M].北京:化学工业出版社,2016
[2] 曾鸽鸣,李庆宏.化学分析工程师实用技术丛书——化验员知识与技能[M].北京:化学工业出版社,2011
[3] 周心如,杨俊佼,柯以侃.化验员读本(上册)化学分析.(第五版) [M].北京:化学工业出版社.2017
——硫代硫酸钠

