家蚕脱胶蚕丝的蛋白组成成分
张艳,董照明,席星航,张晓璐,叶林,郭凯雨,夏庆友,赵萍
(西南大学家蚕基因组生物学国家重点实验室/重庆市蚕丝纤维新材料工程技术研究中心/西南大学生物技术学院,重庆 400715)
0 引言
【研究意义】家蚕(Bombyx mori)是一种重要的经济昆虫,最重要的经济价值在于可以生产一种天然的高分子纤维材料——蚕丝。丝素蛋白构成了蚕丝的核心纤维,而丝胶包裹在丝素的外围,具有保护和胶着丝素的作用。除了丝素与丝胶外,笔者课题组在最近的研究中从蚕丝中鉴定到了酶、蛋白酶抑制剂和未知功能蛋白等上百种蛋白质[1-2]。另外,蚕丝中还含有糖、脂、氨基酸、有机酸和烷烃等小分子物质,它们主要存在于丝胶层中[3]。蚕丝应用于纺织工业需要经过一系列的加工过程,丝素在这个过程中基本不变,而绝大部分丝胶则在煮茧、缫丝和精炼的过程中被脱去并排放掉,而其他丝蛋白的变化情况至今未被阐明。因此,对蚕丝加工过程中蛋白质组分的变化进行研究,不仅有利于深入理解蚕丝的蛋白质组分与特性,而且有利于探索更加先进的蚕丝加工工艺。【前人研究进展】蚕丝的主要组分是丝素蛋白(fibroin)和丝胶(sericin)蛋白[4]。丝素是一种纤维蛋白,是丝的中心成分,约占丝重的70%—80%。丝素蛋白含有3种成分:390 kD的重链蛋白(H-chain)、25 kD的轻链蛋白(L-chain)和27或30 kD的fibrohexamerin/P25蛋白(fhx)[5-7]。这 3种丝素蛋白在后部丝腺细胞内按照一定的比例(H-chain:L-chain:fhx=6:6:1)形成丝素蛋白基本单位,然后被分泌到丝腺腔[5]。丝胶是一种胶状的球蛋白,存在于丝素的外围,包被着丝素,对丝素起着保护和胶黏作用。目前已发现3种丝胶蛋白,包括丝胶1、丝胶2和丝胶3[8-11]。丝胶1和丝胶3的主要作用是黏附丝素纤维以形成茧;丝胶2不存在于蚕茧中,却在茧网和小蚕的蚕丝中被检测到,它具有更好的黏性,可能的作用是将蚕茧或幼虫黏附于周围物体,从而防止蚕体掉落,帮助蜕皮和结茧[9-10]。为了深入了解蚕丝的蛋白组分,DONG等[1]收集了家蚕在不同发育时期所分泌的7种蚕丝,利用蛋白质组学的方法从各种蚕丝中共鉴定到500种蛋白质,通过GO分类和非标记定量分析,发现蚕丝中的主要蛋白质包括丝素、丝胶、蛋白酶抑制剂、酶、未知功能蛋白;ZHANG等[2]对家蚕蚕茧中处于不同分层的茧丝进行蛋白质组学鉴定,也鉴定到了同样类型的丝蛋白,并且发现蚕茧外层丝比内层丝拥有更多的丝胶1和蛋白酶抑制剂;DONG等[12]通过调查各种丝蛋白在丝腺腔内的动态变化过程,发现丝素、丝胶、蛋白酶抑制剂、seroin以及未知功能蛋白都是在食桑期的丝腺内不断积累,构成了蚕丝的主要成分,而酶类等其他丝蛋白并不是丝蛋白的主要成分;GUO等[13]发现茧丝中的蛋白酶抑制剂不仅对真菌蛋白酶表现出高效的抑制活性,还能够抑制白僵菌孢子的萌发。蚕丝中还存在另外一类抗菌蛋白 seroin,研究发现中部及后部丝腺都能分泌这种蛋白[14-16]。SINGH 等[17]发现家蚕的seroin还具有抗病毒的活性。除了抗菌蛋白外,蚕丝中还有大量未知功能的蛋白质未被研究。【本研究切入点】近年来关于蚕丝蛋白组分与活性的研究已经取得了较多进展,然而关于蚕丝加工过程对于蚕丝组成与特性的影响仍然所知甚少。为了更好地开发和利用好蚕丝制品,有必要对蚕丝加工过程中丝蛋白成分的变化进行系统地研究。【拟解决的关键问题】采用不同方法对蚕丝进行脱胶处理,对脱胶后的蚕丝进行电泳检测以及液相色谱-质谱联用的蛋白质组学分析,并对经历了不同加工过程的蚕丝产品进行电泳检测与蛋白质组学分析,阐明各种脱胶方法及不同加工过程对蚕丝蛋白质成分与性质的影响,为蚕丝加工工艺的改进提供依据。
1 材料与方法
试验于2014—2015年在西南大学完成。
1.1 材料与试剂
选取家蚕大造品种作为试验对象,由西南大学家蚕基因组生物学国家重点实验室家蚕基因资源库提供。幼虫在25℃、相对湿度60%、自然光照条件下用桑叶进行饲喂,试验材料为新鲜的蚕茧。生丝、胚绸、绸、缎、电力纺由西南大学席星航教授提供,使用多年的丝绸衣服由西南大学赵萍教授提供。木瓜蛋白酶、尿素、二硫苏糖醇购于上海生工生物工程公司,碳酸钠、氢氧化钠购于成都科龙化工试剂厂,Bradford蛋白浓度测定试剂盒购于上海碧云天生物技术公司,超滤管和脱盐柱购于密理博公司,胰蛋白酶、硫氰化锂、碘乙酰胺和甲酸购于 Sigma公司。
1.2 蚕茧样品的预处理与脱胶
将去掉茧网的蚕茧分为外层、中层和内层。选取中间层的蚕茧置于 65℃恒温烘箱烘干,之后进行称重,用5种方法对蚕茧进行脱胶处理。(1)木瓜蛋白酶脱胶法:将蚕茧置于 0.1%的木瓜蛋白酶溶液中(浴比为1:50),在60℃水浴锅中水浴60 min;(2)尿素脱胶法:将蚕茧置于 8 mol·L-1尿素溶液中(浴比为1:100),在100℃水浴锅中水浴75 min,取出脱胶液,将脱胶的蚕丝用 40℃温水清洗 2次并尽量拧干,再放入新的8 mol·L-1尿素溶液中(浴比为1:100),在100℃水浴锅中水浴60 min;(3)碳酸钠脱胶法:将蚕茧置于0.5% Na2CO3溶液中(浴比为1:100),在100℃水浴锅中水浴75 min,取出脱胶液,将脱胶的蚕丝用40℃温水清洗2次并尽量拧干,再放入新的0.5% Na2CO3中(浴比为1:100),在100℃水浴锅中水浴60 min;(4)中性皂脱胶法:将蚕丝置于0.5%的中性皂液中(浴比为1:100),在100℃水浴锅中水浴30 min,取出脱胶液,将脱胶的蚕丝尽量拧干,放入0.05% Na2CO3溶液中水浴20 min(浴比为1:100),取出脱胶液,将脱胶的蚕丝尽量拧干,再放入0.2% Na3PO4溶液中水浴60 min;(5)碱水脱胶法:将蚕茧置于含有NaOH的pH 11的纯水溶液中(浴比为1:100),在100℃水浴锅中水浴30 min。以上5种方法脱胶后取出脱胶液,并分别将脱胶后的蚕丝用40℃温水清洗2次,于65℃恒温烘箱中烘干。
1.3 蚕丝蛋白的提取、定量与电泳
称取约0.01 g的未脱胶蚕茧、脱胶蚕茧或蚕丝制品放入1.5 mL离心管中,加入60% LiSCN溶液(1 g/100 mL)剧烈涡旋振荡2 h,12000×g离心10 min,取上清,于-20℃保存。利用Brandford法测定蛋白浓度[18]。分别取 2 µg蚕丝蛋白进行聚丙烯酰胺凝胶电泳,并通过硝酸银染色来分析提取的蚕丝蛋白。
1.4 蚕丝蛋白的质谱前处理
采取FASP(filter-aided sample preparation)酶解法对蚕丝蛋白进行溶液内酶解[19],步骤如下:将150 µg蚕丝蛋白加入超滤管(MWCO 10 000,Millipore),用8 mol·L-1尿素溶液(UA)洗3次以置换LiSCN溶液,每次洗完后在12 000×g室温离心20 min,除去离心下去的液体。加入15 mmol·L-1的二硫苏糖醇溶液(DTT),37℃孵育 1 h,加入 15 µL 50 mmol·L-1的碘乙酰胺溶液(IAA),室温避光反应1 h后,12 000×g室温离心20 min,弃掉液体。用尿素溶液洗涤3次,以去除残留的DTT和IAA,每次加入200 µL UA溶液。用50 mmol·L-1NH4HCO3溶液洗涤4次,以去除残留的尿素溶液,12 000×g室温离心20 min,弃掉液体,并更换新的离心管。在超滤管中按照1:50的质量比加入胰蛋白酶,于37℃酶解20 h。12 000×g室温离心 20 min,回收管中酶解后的肽段溶液,4℃浓缩干燥,用0.1%甲酸水复溶后用Zip TipC18脱盐柱脱盐,然后在4℃浓缩干燥。
1.5 蚕丝蛋白的质谱鉴定
干燥后的肽段用0.1%甲酸水复溶,使用C18柱在EASY-nLC 1000系统(Thermo Fisher Scientific)上进行 140 min的色谱梯度分离。分离的肽段通过 Q Exactive质谱仪(Thermo Fisher Scientific)进行鉴定。质谱检测使用TOP20原则。Full MS扫描的分辨率为70 000,MS2扫描的分辨率为17 500;Full MS的最大离子注入数为3e6,最大离子注入时间为20 ms,二级最大离子注入数为1e6,最大离子注入时间为60 ms。
利用MaxQuant(1.3.0.1版)软件对获得的数据进行数据库搜索鉴定[20]。将家蚕基因组数据库SilkDB(http://silkworm.swu.edu.cn/silkdb/)和 NCBI(http://www.ncbi.nlm.nih.gov/)家蚕数据库整合,构建本地数据库(共包含35 379个蛋白质)。搜索引擎为Andromeda[21]。搜库的参数设置如下,Mutiplicity=1,肽段 FDR(false discovery rate)=0.01,蛋白 FDR=0.01,可变修饰为Oxidations(M)和Acetyl(protein N-term),最小肽段的氨基酸数为6,切割酶为Trypsin,蛋白定量方法为 iBAQ。从得到的结果中手动去除污染序列和反向序列。
2 结果
2.1 不同方法脱胶后蚕丝蛋白的电泳检测
目前常用的脱胶方法包括碳酸钠法[22]、尿素法[23]、中性皂法[24-25]和蛋白酶法[26-27]等。为了观察不同方法的脱胶效果,收集了各种方法的脱胶溶液与脱胶后的蚕丝纤维并进行蛋白电泳。从图1的电泳结果可以看出,每种方法的第一次脱胶溶液中都能检测到或多或少的蛋白质,而第二次脱胶溶液中几乎检测不到蛋白质,表明第一次脱胶处理就已经把容易脱掉的丝胶蛋白去掉了。电泳检测脱胶后的蚕丝纤维可以发现不同方法处理后的纤维蛋白有着不同的分子量分布,表明丝素蛋白在脱胶过程中可能发生了不同程度的降解或残留了不同量的丝胶蛋白。
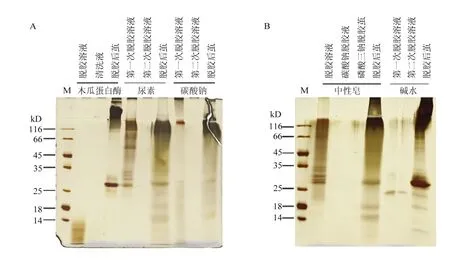
图1 脱胶溶液和脱胶后蚕茧丝的电泳图Fig. 1 SDS-PAGE of degummed solution and cocoon silk
木瓜蛋白酶法脱胶的溶液中只能检测到小分子量的蛋白,但脱胶后的蚕茧中还能明显地检测到丝素重链和轻链,表明木瓜蛋白酶对丝胶蛋白具有较强的水解作用,而对丝素蛋白的水解作用较弱。碳酸钠法脱胶溶液中能看到两条明显的丝胶条带,脱胶后的蚕茧蛋白明显比木瓜蛋白酶处理后的蚕茧蛋白分子量低,表明碳酸钠溶液对丝胶的降解程度较弱,对丝素的降解程度较强。尿素脱胶溶液中存在拖带的丝胶蛋白,脱胶后的蚕茧中能检测到分子量明显降低的丝素蛋白,表明尿素对丝胶蛋白和丝素蛋白的降解都比较严重(图1-A)。中性皂液脱胶溶液和尿素脱胶溶液相似,能导致丝胶蛋白的降解,经过碳酸钠和磷酸三钠二次脱胶后,溶液中基本检测不到蛋白,脱胶后的蚕茧中能检测到分子量明显降低的丝素蛋白。碱水脱胶溶液中只能检测到少量的蛋白,表明脱胶效果不是很理想,脱胶后的蚕茧中存在大量的高分子量的丝素蛋白,降解不明显(图1-B)。
为了进一步比较不同方法的脱胶效果,将5种方法脱胶后的蚕茧与未脱胶的蚕茧一起进行聚丙烯酰胺凝胶电泳。结果发现未脱胶的蚕茧、木瓜蛋白酶脱胶的蚕茧和碱水脱胶后的蚕茧蛋白的条带较类似,能明显地看到丝素重链和丝素轻链,并且丝素蛋白没有出现明显的降解;而尿素、碳酸钠和中性皂脱胶后的蚕茧蛋白条带类似,其丝素重链和轻链都出现了明显的降解(图2)。
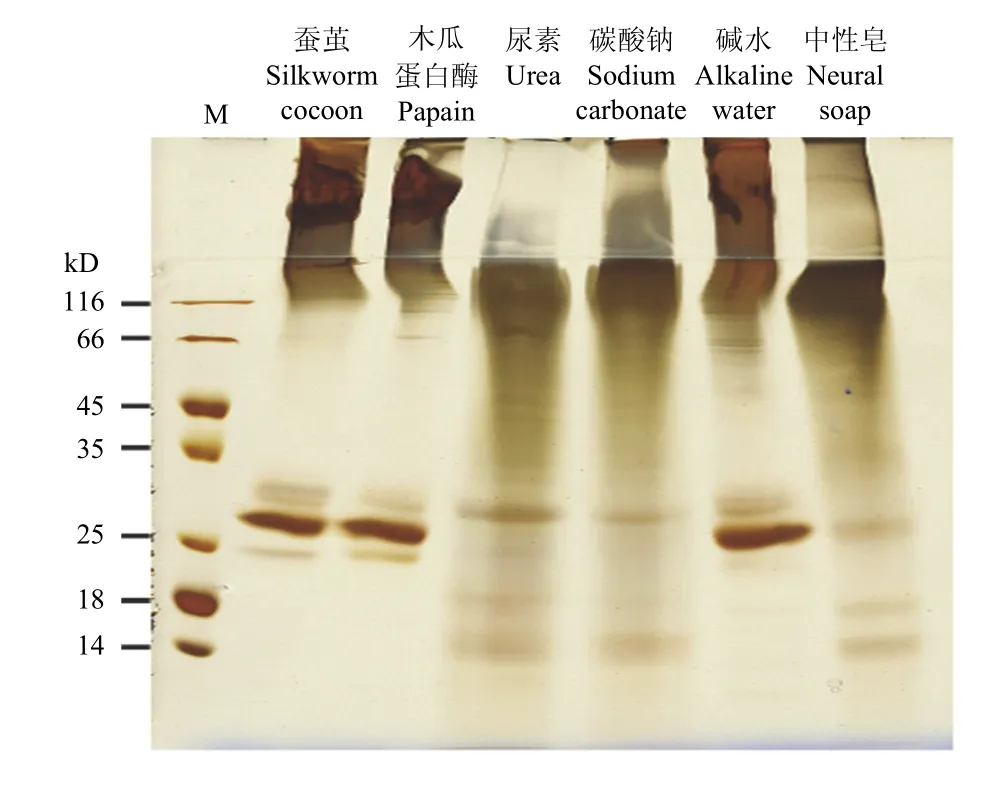
图2 脱胶后蚕茧丝蛋白的电泳图Fig. 2 SDS-PAGE of proteins in the degummed cocoon silk
2.2 不同方法脱胶后的蚕茧蛋白质组学分析
利用液相色谱质谱联用的技术,对不同方法脱胶后的蚕茧进行蛋白质组学鉴定。共鉴定到159种蛋白,其中未脱胶蚕茧中鉴定到107种蛋白,碱水法脱胶后的蚕茧中鉴定到112种蛋白,木瓜蛋白酶法鉴定到64种蛋白,中性皂法鉴定到37种蛋白,碳酸钠法鉴定到24种蛋白,尿素法鉴定到19种蛋白,表明这些脱胶方法的效果差异很大。碱水法的蛋白数目比未脱胶蚕茧的蛋白数目稍多,属于实验误差,也暗示了碱水法效果最差。尿素法鉴定到的蛋白数目最少,表明尿素法的脱胶效果最好。
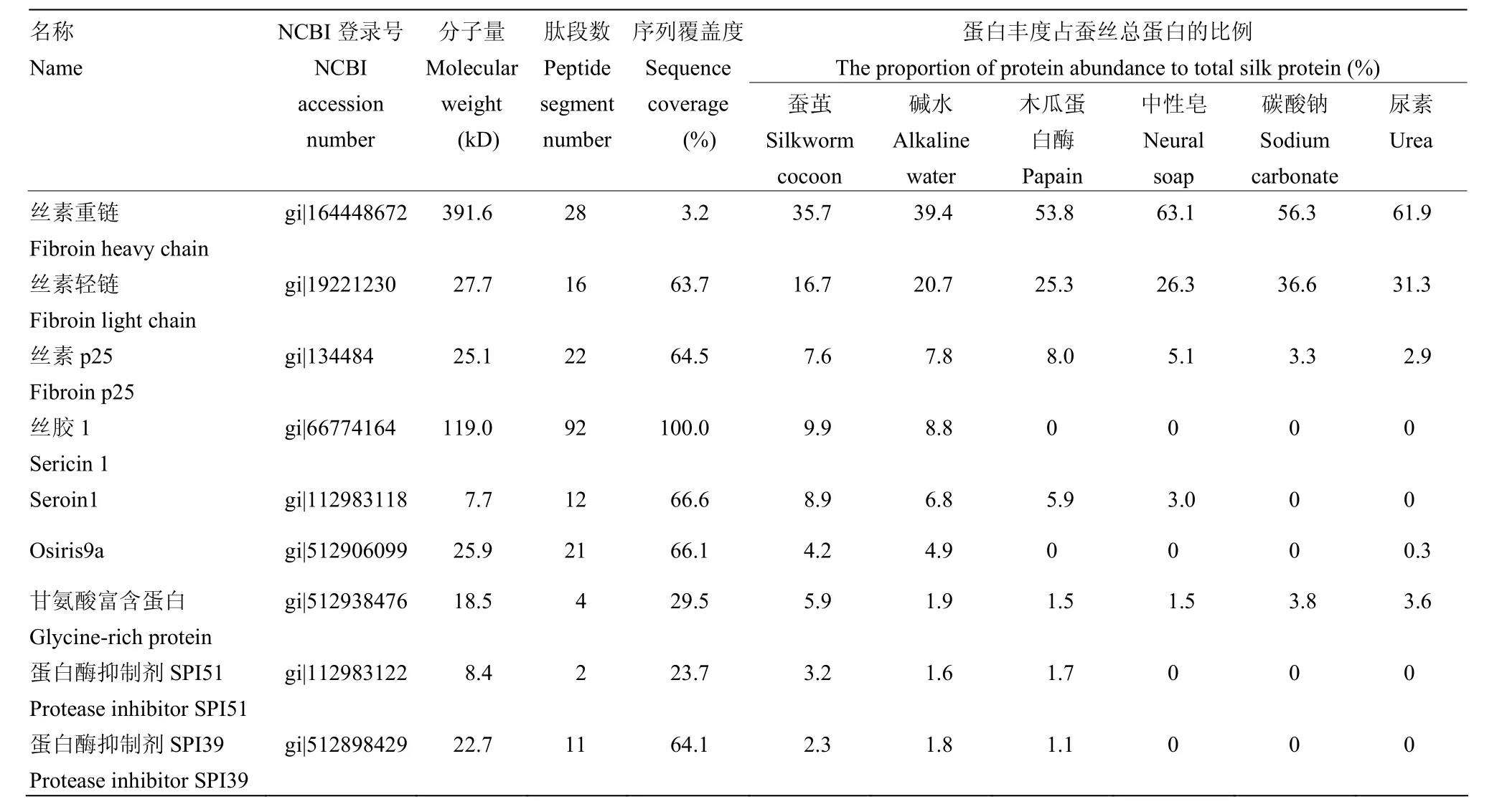
表1 脱胶后的蚕茧丝中主要蛋白质的信息列表Table 1 List of major proteins in the degummed cocoon silk
将未脱胶的蚕茧和5种脱胶方法处理的蚕茧蛋白组分进行非标定量比较分析,结果发现碱水法处理过的蚕茧和未脱胶蚕茧的蛋白组分相似,主要包括丝素重链、丝素轻链、丝素p25、丝胶1、seroin 1、osiris 9a、甘氨酸富含蛋白和蛋白酶抑制剂SPI51和SPI39等(表1)。木瓜蛋白酶法和中性皂法脱胶后的蚕茧中丝胶1蛋白几乎消失,丝素蛋白的比例明显增加,除了丝素蛋白外还含有seroin 1和甘氨酸富含蛋白等。碳酸钠法和尿素法的脱胶效果最好,这两种方法脱胶后的蚕茧中丝素蛋白是主要的成分,此外还含有甘氨酸富含蛋白,表明甘氨酸富含蛋白可能是丝素蛋白或最内层的丝胶蛋白(图3)。
2.3 不同蚕丝产品中蛋白质的电泳检测
为了检测蚕丝工业实际加工过程对蚕丝成分的影响,选取了蚕丝加工获得的各种产品,包括生丝、胚绸、绸、缎、电力纺和丝绸旧衣,提取其中的蛋白质进行电泳分析与质谱鉴定。通过电泳检测可以看出,在生丝和胚绸中,丝素重链与丝素轻链的条带都比较清晰;在绸、缎和电力纺中,丝素重链出现了部分程度的降解,丝素轻链的条带也变得模糊;在丝绸旧衣中,丝素重链与轻链蛋白都出现了严重的降解,已经看不到清晰的蛋白条带(图4)。

图3 脱胶的蚕茧丝中蛋白质的非标定量分析Fig. 3 Label-free quantitative analysis of proteins in the degummed cocoon silk
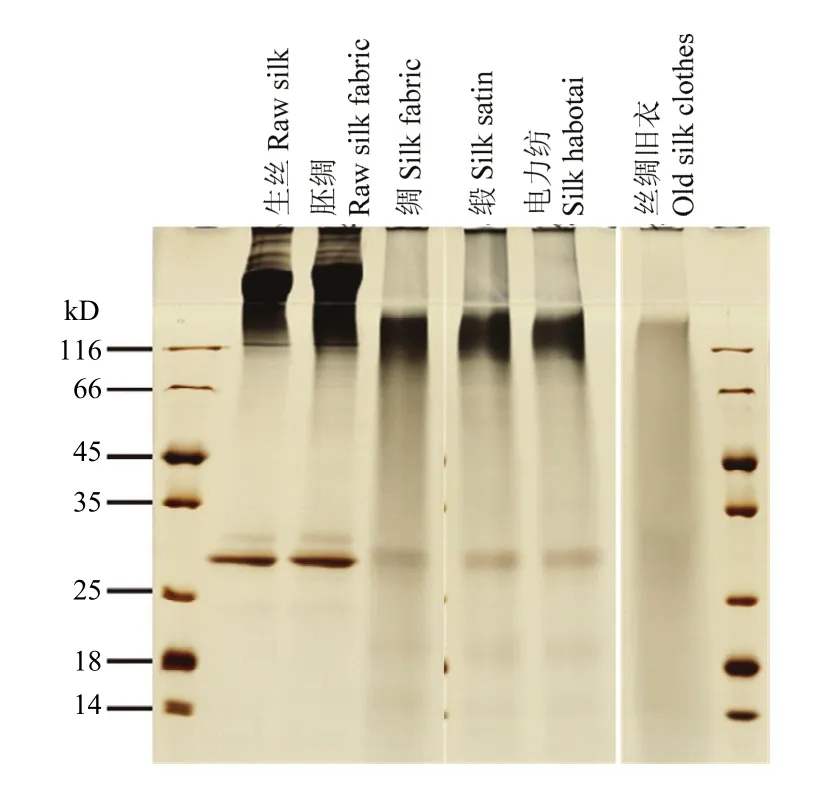
图4 蚕丝产品中蛋白质的SDS-PAGEFig. 4 SDS-PAGE of proteins from different silk products
2.4 不同蚕丝产品的蛋白质组学分析
利用液相色谱质谱联用的技术,对工业上生产中获得的各种蚕丝加工品进行了蛋白质组学分析。结果发现在生丝和胚绸中都能鉴定到近百种蛋白质(分别为95和100种),这与蚕茧的鉴定结果类似;但是,在绸、缎和电力纺中分别鉴定到了29、44和38种蛋白质,蛋白数量明显减少;在使用多年的丝绸旧衣中只能鉴定到10种蛋白质;这些结果与各种方法脱胶后蚕丝蛋白的鉴定结果相似。在生丝和胚绸中,能检测到大量蛋白质,主要成分包括3种丝素蛋白、丝胶1、seroin 1、osiris 9a、甘氨酸富含蛋白和蛋白酶抑制剂SPI51等(表2);在绸、缎和电力纺中,主要成分包括3种丝素蛋白和seroin 1等(表2);在使用多年的丝绸衣服中,仍然能鉴定到3种丝素蛋白和甘氨酸富含蛋白(图5),这一结果与不同方法脱胶的结果类似(表2)。
3 讨论
蚕丝作为纺织的原料已有5000年的历史。经过长期的经验积累和工艺改进,蚕丝的加工工艺已经十分成熟,主要包括脱胶和整理丝素等工艺。本研究参考已报道的多种脱胶方法,利用电泳检测与质谱鉴定的方法,发现碱水法无法去掉丝胶,而其他4种方法都能有效地去除绝大部分的丝胶蛋白。木瓜蛋白酶法在去除丝胶的同时能够最大程度地保持丝素纤维的完整性,这可能是由于蚕丝中的丝素蛋白疏水性强,形成高度有序排列的β折叠[28-29],而丝胶是水溶性的糖蛋白,以无规则结构为主[30]。因此木瓜蛋白酶较容易作用于结构疏松的亲水性丝胶,而很难作用于排列紧密的疏水性丝素。中性皂、碳酸钠和尿素法会对丝素造成损伤,推测原因为这3种方法的处理温度较高。这些结果表明完全脱掉丝胶是很困难的,采用剧烈的条件去除丝胶的同时会导致丝素蛋白的降解,进而导致蚕丝机械性能的降低[22]。之前有研究发现用尿素溶液在80℃溶解丝胶蛋白,当处理时间小于5 min时,能保持丝胶蛋白不降解[9,31]。这表明较剧烈的溶剂也可以保持丝蛋白的稳定性,但处理温度不能太高,时间也不能太长。
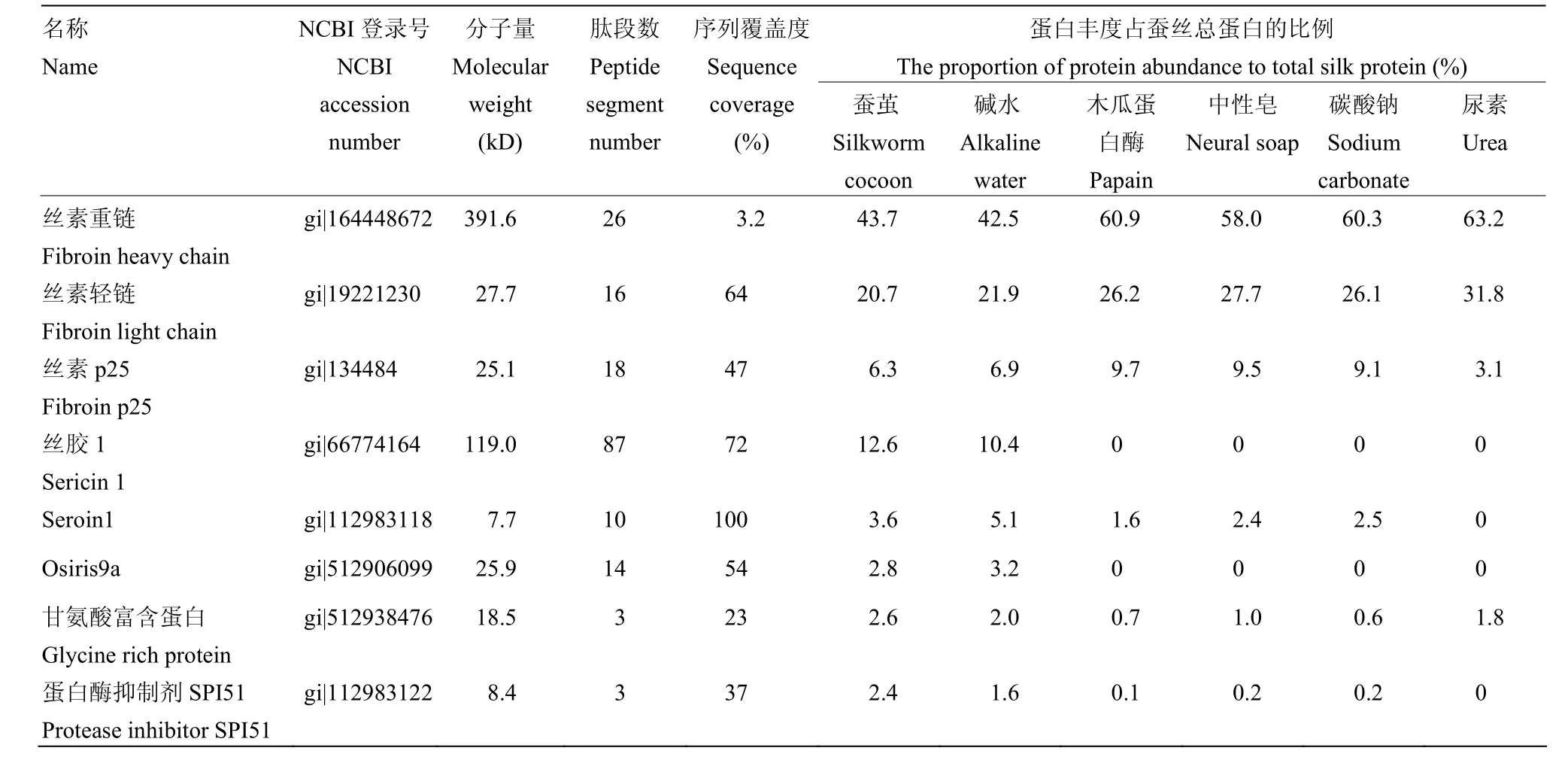
表2 蚕丝加工产品中主要蛋白质的信息列表Table 2 List of major proteins in the different silk products

图5 蚕丝加工产品中蛋白质的非标定量分析Fig. 5 Label-free quantitative analysis of proteins from different silk products
从蛋白种类上看,木瓜蛋白酶、中性皂、碳酸钠和尿素 4种方法几乎都能够完全去除丝胶 1。木瓜蛋白酶和中性皂脱胶后,主要残余丝素蛋白和seroin1蛋白,碳酸钠和尿素脱胶后,残余的蛋白主要是丝素蛋白和甘氨酸富含蛋白。之前的研究发现,seroin1蛋白在中部丝腺和后部丝腺都能合成,同时存在于丝素层与丝胶层中[14-16]。甘氨酸富含蛋白在中部丝腺中区和后区表达[12],存在于丝胶的内层。这些结果表明 seroin1和甘氨酸富含蛋白可能存在于丝胶内层,因此多种脱胶方法都难以将这两种蛋白除净。
对多种蚕丝产品进行蛋白电泳检测发现生丝和胚绸中的丝素蛋白比较完整,这可能是由于这两者的加工时间较短,处理条件较温和的缘故。绸、缎和电力纺由于经历了后续更剧烈的条件,丝素蛋白已发生了部分降解,分子量明显降低,力学性能也随之降低。从蛋白成分与含量来看,生丝和胚绸中保留了很多种类的丝蛋白,包括丝素、丝胶1、seroin 1、osiris9a、甘氨酸富含蛋白、蛋白酶抑制剂和其他蛋白;而绸、缎和电力纺中主要是丝素和seroin 1。
4 结论
蚕丝的加工过程实质上是脱胶的过程。比较5种不同的脱胶方法发现,碱水脱胶的效果最差;木瓜蛋白酶脱胶法可以去掉大部分丝胶蛋白,同时最大程度地保持丝素纤维的完整性;中性皂、碳酸钠和尿素法的脱胶程度都比较好,但是会对丝素造成损伤。比较5种蚕丝工业产品可以发现,蚕丝加工为生丝或胚绸后,丝胶蛋白含量很高,丝素纤维还很完整。蚕丝加工为绸、缎或电力纺后,丝胶蛋白基本被去除干净了,但是丝素纤维已经出现部分程度的降解。
[1]DONG Z M, ZHAO P, WANG C, ZHANG Y, CHEN J P, WANG X,LIN Y, XIA Q Y. Comparative proteomics reveal diverse functions and dynamic changes ofBombyx morisilk proteins spun from different development stages.Journal of Proteome Research, 2013,12(11): 5213-5222.
[2]ZHANG Y, ZHAO P, DONG Z M, WANG D D, GUO P C, GUO X M, SONG Q R, ZHANG W W, XIA Q Y. Comparative proteome analysis of multi-layer cocoon of the silkworm,Bombyx mori.PLoS ONE, 2015, 10(4): e0123403.
[3]ZHANG Y, ZHAO D C, MENG Z, DONG Z M, LIN Y, CHEN S Y,XIA Q Y, ZHAO P. Wild silkworm cocoon contains more metabolites than domestic silkworm cocoon to improve its protection.Journal of Insect Science, 2017, 17(5): 105.
[4]MONDAL M, TRIVEDY K, KUMAR S N. The silk proteins, sericin and fibroin in silkworm,Bombyx moriLinn., - a review.Caspian Journal of Environmental Sciences, 2007, 5(2): 63-76.
[5]INOUE S, TANAKA K, ARISAKA F, KIMURA S, OHTOMO K,MIZUNO S. Silk fibroin ofBombyx moriis secreted, assembling a high molecular mass elementary unit consisting of H-chain, L-chain,and P25, with a 6:6:1 molar ratio.TheJournal of Biological Chemistry, 2000, 275(51): 40517-40528.
[6]YAMAGUCHI K, KIKUCHI Y, TAKAGI T, KIKUCHI A, OYAMA F, SHIMURA K, MIZUNO S. Primary structure of the silk fibroin light chain determined by cDNA sequencing and peptide analysis.Journal of Molecular Biology, 1989, 210(1): 127-139.
[7]SHIMURA K, KIKUCHI A, KATAGATA Y, OHTOMO K. The occurrence of small component proteins in the cocoon fibroin ofBombyx mori.TheJournal of Sericultural Science of Japan, 1982,51(1): 20-26.
[8]GAREL A, DELEAGE G, PRUDHOMME J C. Structure and organization of theBombyx morisericin 1 gene and of the sericins 1 deduced from the sequence of the Ser 1B cDNA.Insect Biochemistry and Molecular Biology, 1997, 27(5): 469-477.
[9]TAKASU Y, HATA T, UCHINO K, ZHANG Q. Identification of Ser2 proteins as major sericin components in the non-cocoon silk ofBombyx mori.Insect Biochemistry and Molecular Biology, 2010,40(4): 339-344.
[10]KLUDKIEWICZ B, TAKASU Y, FEDIC R, TAMURA T, SEHNAL F, ZUROVEC M. Structure and expression of the silk adhesive protein Ser2 inBombyx mori.Insect Biochemistry and Molecular Biology, 2009, 39(12): 938-946.
[11]TAKASU Y, YAMADA H, TAMURA T, SEZUTSU H, MITA K,TSUBOUCHI K. Identification and characterization of a novel sericin gene expressed in the anterior middle silk gland of the silkwormBombyx mori.Insect Biochemistry Molecular Biology, 2007, 37(11):1234-1240.
[12]DONG Z M, ZHAO P, ZHANG Y, SONG Q R, ZHANG X L, GUO P C, WANG D D, XIA Q Y. Analysis of proteome dynamics inside the silk gland lumen ofBombyx mori.Scientific Reports, 2016, 6:21158.
[13]GUO X M, DONG Z M, ZHANG Y, LI Y S, LIU H W, XIA Q Y,ZHAO P. Proteins in the cocoon of silkworm inhibit the growth ofBeauveria bassiana.PLoS ONE, 2016, 11(3): e151764.
[14]ZUROVEC M, YANG C S, KODRIK D, SEHNAL F. Identification of a novel type of silk protein and regulation of its expression.The Journal of Biological Chemistry, 1998, 273(25): 15423-15428.
[15]GRZELAK K, COUBLE P, GAREL A, KLUDKIEWICZ B,ALROUZ H. Low molecular weight silk proteins inGalleria mellonella.Insect Biochemistry, 1988, 18(3): 223-228.
[16]NIRMALA X, MITA K, VANISREE V, ZUROVEC M, SEHNAL F.Identification of four small molecular mass proteins in the silk ofBombyx mori.Insect Molecular Biology, 2001, 10(5): 437-445.
[17]SINGH C P, VAISHNA R L, KAKKAR A, ARUNKUMAR K P,NAGARAJU J. Characterization of antiviral and antibacterial activity ofBombyx moriseroin proteins.Cellular Microbiology, 2014, 16(9):1354-1365.
[18]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Analytical Biochemistry, 1976, 72: 248-254.
[19]WISNIEWSKI J R, ZOUGMAN A, NAGARAJ N, MANN M.Universal sample preparation method for proteome analysis.Nature Methods, 2009, 6(5): 359-362.
[20]COX J, MANN M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification.Nature Biotechnology, 2008, 26(12):1367-1372.
[21]COX J, NEUHAUSER N, MICHALSKI A, SCHELTEMA R A,OLSEN J V, MANN M. Andromeda: a peptide search engine integrated into the MaxQuant environment.Journal of Proteome Research, 2011, 10(4): 1794-1805.
[22]WANG H Y, ZHANG Y Q. Effect of regeneration of liquid silk fibroin on its structure and characterization.Soft Matter, 2013, 9:138-145.
[23]张雨青. 蚕丝脱胶方法的比较分析. 蚕业科学, 2002, 28(1): 75-79.ZHANG Y Q. Comparison analysis of degumming procedures for silkworm silk.Acta Sericologica Sinica, 2002, 28(1): 75-79. (in Chinese)
[24]MCCONLOGUE W A. Industrial uses of soap and synthetic detergents.TheJournal of the American Oil Chemists’ Society, 1952,29(11): 526-529.
[25]YUKSEK M, KOCAK D, BEYIT A, MERDAN N. Effect of degumming performed with different type natural soaps and through ultrasonic method on the properties of silk fiber.Advances in Environmental Biology, 2012, 6(2): 801-808.
[26]RODBUMRER P, ARTHAN D, UYEN U, YUVANIYAMA J,SVASTI J, WONGSAENGCHANTRA P Y. Functional expression of aBombyx moricocoonase: potential application for silk degumming.Acta Biochimica et Biophysica Sinica, 2012, 44(12): 974-983.
[27]FREDDI G, MOSSOTTI R, INNOCENTI R. Degumming of silk fabric with several proteases.Journal of Biotechnology, 2003, 106(1):101-112.
[28]CRAIG C L, RIEKEL C. Comparative architecture of silks, fibrous proteins and their encoding genes in insects and spiders.Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2002, 133(4): 493-507.
[29]LOTZ B, COLONNA CESARI F. The chemical structure and the crystalline structures ofBombyx morisilk fibroin.Biochimie, 1979,61(2): 205-214.
[30]SINOHARA H. Glycopeptides isolated from sericin of the silkworm,Bombyx mori.Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 1979, 63(1): 87-91.
[31]TAKASU Y, YAMADA H, TSUBOUCHI K. Isolation of three main sericin components from the cocoon of the silkworm,Bombyx mori.Bioscience, Biotechnology, Biochemistry, 2002, 66(12): 2715-2718.

