代乳粉对早期断奶沂蒙黑山羊羔小肠发育、菌群多样性及葡萄糖转运载体基因表达的影响
李永洙,金太花,韩照清,夏春峰,晁洪雨,张乃锋,王世琴,刁其玉
(1中国农业科学院饲料研究所,农业部饲料生物技术重点实验室,北京 100081;2临沂大学农林科学学院,山东临沂276000)
0 引言
【研究意义】在现代养羊业生产中,为充分发挥母羊繁殖性能,对羔羊采取早期断奶,并利用代乳粉替代母乳。羔羊从母乳到代乳粉、固体饲料的替换以及无反刍到有反刍阶段的转变,都会对早期断奶羔羊生长发育产生不良影响。其中,断奶应激影响羔羊肠道菌群的平衡,造成肠道消化不良、生长发育缓慢、消化系统功能紊乱[1]等。葡萄糖转运载体影响小肠黏膜上皮细胞对单糖的吸收转运,进而影响羔羊肠道发育[2-3]。因此,探讨早期断奶羔羊饲喂代乳粉,其肠道菌群定植以及葡萄糖在小肠中吸收转运规律,对于促进早期断奶羔羊生长发育具有重要的意义。【前人研究进展】已有研究表明,日粮中养分的均衡度、可消化吸收的难易程度、微生物数量及产生的毒素等均可导致肠道发育和功能发生程序化改变[4]。胃肠道微生物区系是影响胃肠道正常消化功能的主要因素之一,有助于分解饲料中各种纤维、淀粉、蛋白等营养物质,其微生态平衡与饲粮、品种、健康状况、生活环境及环境中共生微生物间的群体效应等有关[5-6],而羔羊瘤胃初期尚未发育健全,因此其养分消化吸收与小肠生理功能的发挥直接有关。哺乳动物机体通过 SGLT-1激活蛋白激酶C(PKC)依赖性通路调节GLUT-2对葡萄糖的转运,决定小肠转运葡萄糖的效率,进而影响小肠发育程度[7-8]。此外,有研究报道,营养条件的改变会使得SGLT-1和GLUT-2的基因表达量降低[9],还可能影响动物基因的表达[10]和蛋白的合成,包括酶的分泌、受体的合成等[11],而基因表达以及蛋白合成的改变也可能会直接或间接的影响动物的生长速度。【本研究切入点】但是目前关于饲喂代乳粉条件下,沂蒙黑山羊双胎羔羊的小肠发育与菌群定植规律、小肠葡萄糖转运载体基因表达量的研究尚未见报道。沂蒙黑山羊属于肉皮绒兼用,具有适应性强、抗病力强、耐粗饲等优点的山东省优良地方品种之一,其繁殖性能为全年发情,可达到1年1胎或2年3胎,每胎产羔 1—2只等特点[12]。本试验采用沂蒙黑山羊双胎羔羊作为研究对象,针对早期断奶沂蒙黑山羊羔羊在饲喂代乳粉条件下肠道发育及菌群定植规律、小肠葡萄糖转运载体基因表达量的影响进行研究。【拟解决的关键问题】旨在揭示饲喂代乳粉对早期断奶沂蒙黑山羊羔羊小肠发育与菌群定植规律以及葡萄糖转运载体基因表达量相关性问题,为羔羊饲喂代乳粉及开食料提供理论依据。
1 材料与方法
1.1 试验时间和地点
试验于2015年10月至2016年4月在山东省临沂市沂南县龙吟庄园黑山羊养殖专业合作社进行。
1.2 试验设计
选用双胎沂蒙黑山羊羔羊 36只(初生重 1.84±0.86kg,均为公羊),分成2组,每组6个重复,每个重复3只。对照组(Ⅰ组)随母哺乳至75日龄,试验组(Ⅱ组)于8日龄开始逐步断奶,并在第10日龄完全断奶后饲喂代乳粉,所有羔羊第 15日龄起补饲开食料,试验期为75 d。分别于第10、15、25、45和75天称重,并各取3只进行屠宰、称十二指肠、空肠、回肠重量以及收集其内容物、黏膜组织样品。屠宰前停食、停水12 h。
1.3 试验饲粮
中国农业科学院饲料研究所提供本试验所需的代乳粉(主要参照发明专利ZL201210365927.6[13])和开食料。其原料组成与营养水平见表1、2。
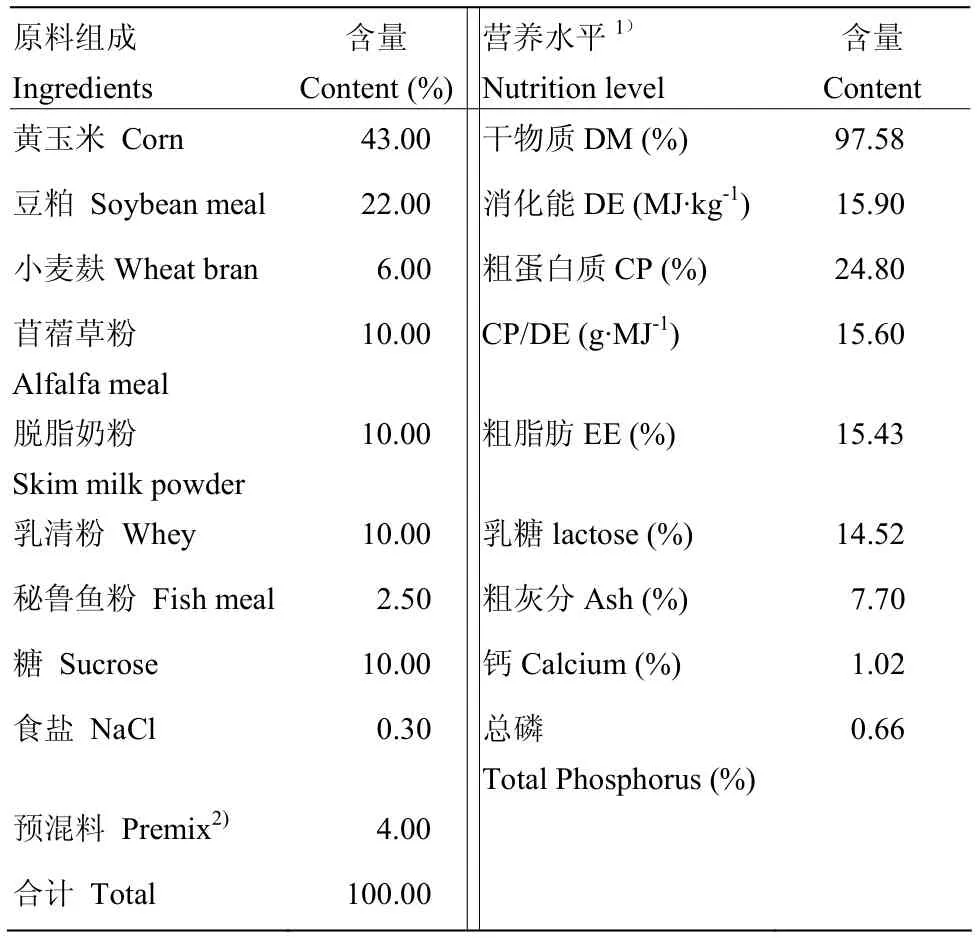
表1 代乳粉的组成及营养水平 (干物质基础)Table 1 Composition and nutrient levels of milk replacer(DM basis)
1.4 测定日粮的方法
1.4.1 饲料样品 代乳粉和开食料各采样点收集 1次,各混合搅拌均匀后冷冻保存,检测前在烘箱中48h制备风干样品,采用常规分析法[14]测定代乳粉和开食料中相关的养分含量。另外,各采样点的代乳粉稀释液、母乳和开食料收集1次,混合后过滤冷冻保存,最终10、15、25、45和75 d的各自混合物再度混合成食糜中微生物的待测样。
1.4.2 母乳养分及活性物质 在10、45、75 d收集早晨哺乳前母乳2 mL,并在4℃、6 000 r/min转速下离心20 min,移除上层乳脂和沉淀物,取上清液放置-80℃冰箱中冻存待测。母乳中类胰岛素因子(IGF-1)、表皮细胞生长因子(EGF)、超氧化物歧化酶(SOD),均使用双抗体夹心生物素-亲和素酶联免疫吸附(ABC-ELISA)试剂盒,试剂盒均为美国R&D公司提供。利用酶标分析仪(DNM-9602G)测定吸光度,其波长为450 nm,操作严格按照试剂盒说明书执行。
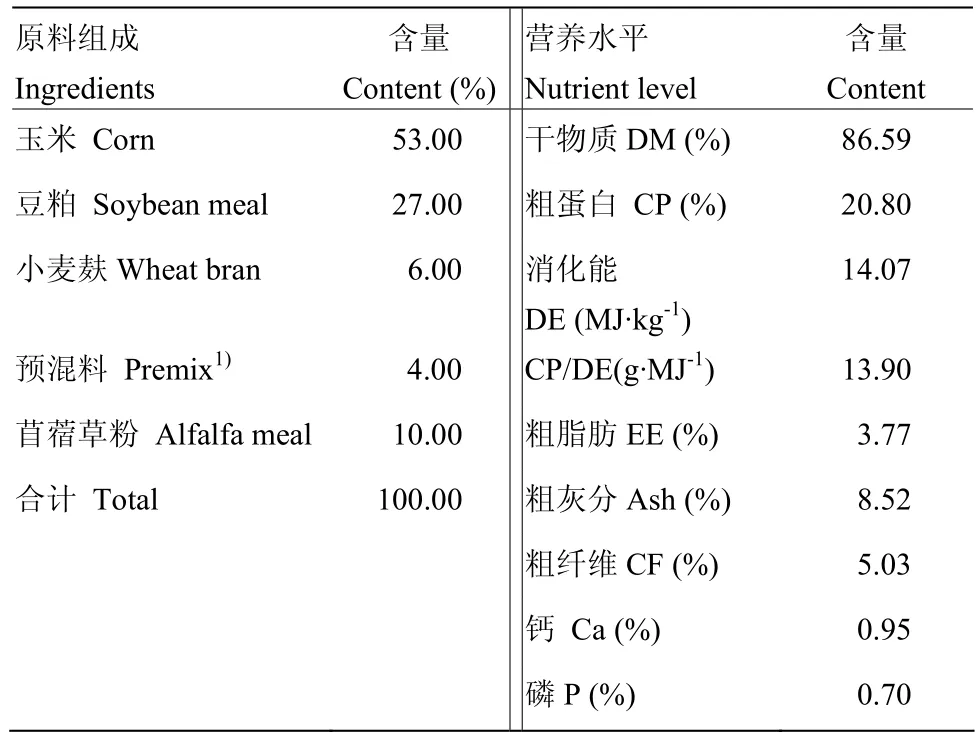
表2 开食料原料组成及营养水平(干物质基础)Table 2 Composition and nutritional level of starters (DM basis)
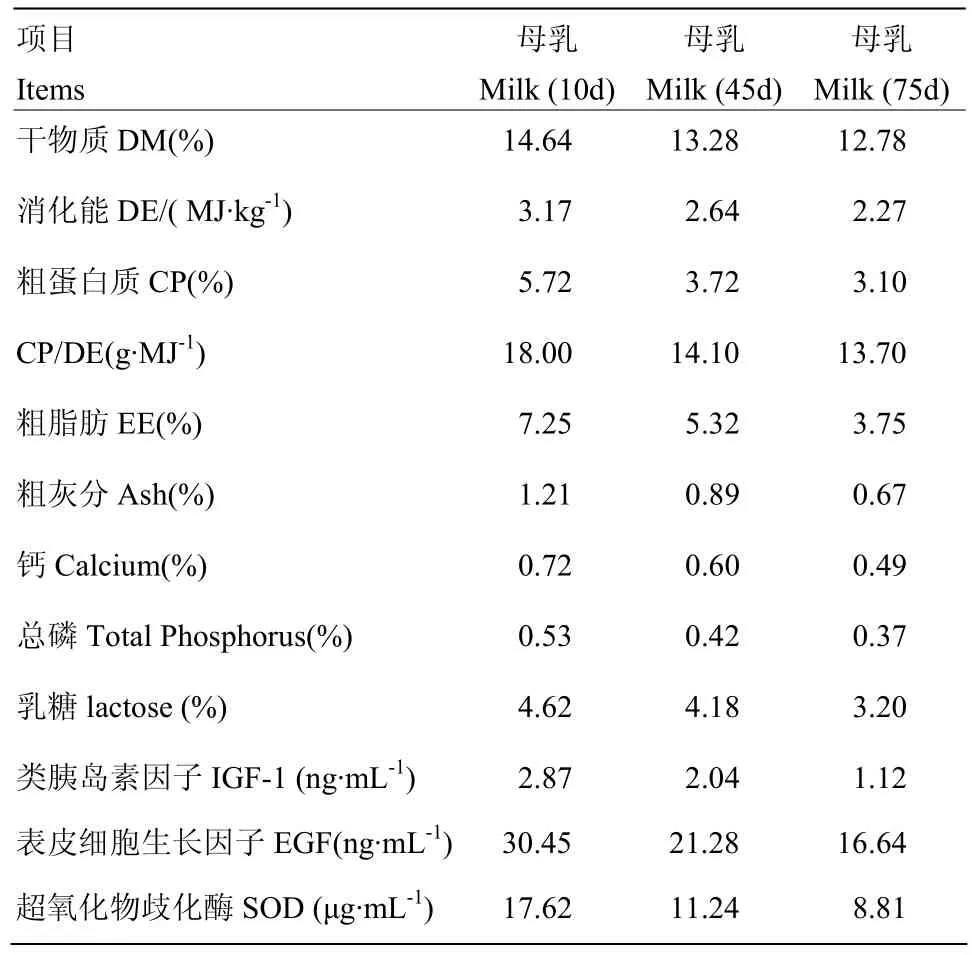
表3 沂蒙黑山羊母乳营养及活性物质水平Table 3 The level of nutrition and active substance in the milk of Yimeng black goat
1.5 饲养管理
参照王海超等[15]方法哺喂羔羊,羔羊均于15 d开始训练采食相同的开食料,自由采食和饮水。表4为两组羔羊从15 d开始在不同日龄阶段日均开食料干物质采食量。
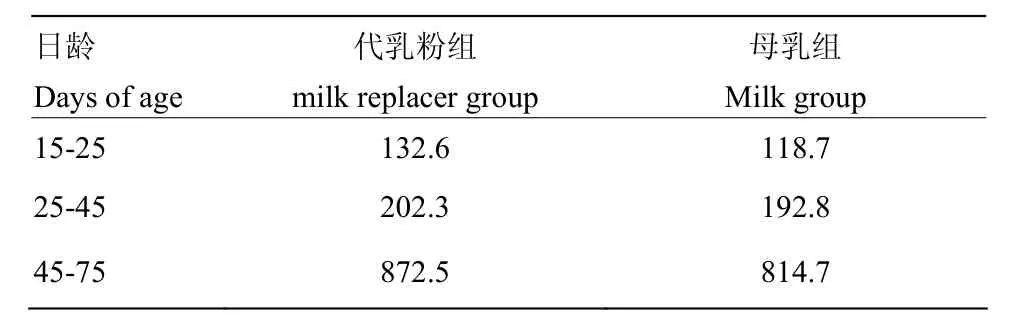
表4 沂蒙黑山羊羔羊不同日龄阶段日均干物质采食量Table 4 Average daily DM intake of Yimeng black goat lambs at different days of age(g)
1.6 屠宰及样品采集
屠宰时采用颈静脉放血,屠宰后,打开腹腔,立即结扎贲门瓣、直肠远段,将羔羊胃肠道取出,小心剥离并在肠段连接处进行结扎、剪断。在无菌操作台下,分别收集十二指肠、空肠和回肠的内容物,将3只羔羊各自不同部位肠内容物均匀混合,分装到2 mL离心管,-20℃保存备用,用于分析菌群多样性。另外,去除肠系膜与小肠外部脂肪,分离小肠各肠段,用生理盐水漂洗后,分别对十二指肠近端(5 cm处)、空肠近端1/4处及回肠末端(靠近盲肠20 cm处)剪开,并用载玻片刮取黏膜组织样,及时装入已消毒的离心管,速用液氮冷冻并转入-80℃冰箱储存,用于分析相关基因表达量。
1.7 小肠菌群多样性分析
1.7.1 提取细菌总DNA 利用QIA amp® DNA Stool Mini Kit试剂盒提取细菌总DNA。采用核酸浓度测定仪(ND-2000)测定总DNA浓度,-20 ℃保存待测。
1.7.2 分析基因组总 DNA 16S rDNA V3区扩增片段参照李永洙等[16]方法,PCR 反应体系(50 μL):10×缓冲液 5 μL(含 15 mmol·L-1MgCl2),d NTP(10 mmol·μL-1)4 μL,引物(27f-GC、1495r, 10μmol·μL-1)1 μL、模板 DNA1.0 μL,Taq DNA 聚合酶(5U·μL-1)0.5 μL,ddH2O补足50 μL。用于扩增细菌16S rDNA V3区基因的通用引物序列为,上游引物:AD27f-GC(5'-AGAGTTTGA TCCTGG-3')和下游引物:1495 r(5'-CTACGGCTACCTTGTA -3'),由上海生工生物技术有限公司合成。
1.7.3 分析基因组总DNA 16S rDNA V3区扩增片段以及割胶回收、提纯和基因载体的连接、检测 参照李永洙等[16]方法,使用Bio-Rad Dcode进行DGGE凝胶电泳,并对相应的微卫星引物(27f和1495r)进行二次PCR扩增。此后,用无菌手术刀将凝胶电泳割胶回收,对其回收产物进行提纯,构建克隆文库,并用PCR和电泳确定克隆片段的正确性。PCR产物经过处理后用310型DNA测序仪测序。所得上述结果在Gen Bank数据库中进行检索对比,确定细菌种类和名称,并进行同源性分析。
1.8 小肠葡萄糖转运载体基因相对表达量的分析
1.8.1 小肠内容物中总RNA提取 取十二指肠、空场和回肠内容物100 mg,使用Trizol(in vitro gen)试剂盒提取总RNA,核酸浓度测定仪(ND-2000)测定RNA浓度及纯度。
1.8.2 总RNA质量及反转录效果检测 通过1%的琼脂糖凝胶电泳评估总RNA的质量见图1。总RNA的28 S和18 S两条带清晰,无DNA污染条带及明显降解条带,表明提取总RNA纯度较高,质量可靠。
图1 总RNA凝胶电泳图Fig. 1 The electrophoresis gram of total RNA
1.8.3 引物检测 以不同组织总RNA的逆转录产物为模板,采用常规 PCR法对所设计的 2对引物(SGLT-1和GLUT-2)进行扩增,经1 %的琼脂糖凝胶电泳检测见图2。

图2 SGLT-1和GLUT-2 mRNA实时荧光定量PCR电泳图Fig. 2 The electrophoresis gram of SGLT1 and GLUT-2 mRNA by real-time fluorescence quantitative PCR
1.8.4 DNA消化和反转录 分别取3 μg总RNA,对其利用DNA酶(Fermentas)去除痕量DNA后,之后反转录获得各样品RNA的c DNA产物。并保存于-20℃备用。
1.8.5 目的基因引物设计和 RT-PCR反应条件建立使用Primer 5软件设计引物,依托上海生工生物技术有限公司合成,引物序列及参数见表5。以ß-actin管家基因作为内标,采用Real-Time PCR法对SGLT-1、GLUT-2mRNA表达量进行分析。以最小Ct值和最高荧光值为标准。
1.8.6 PCR产物克隆、序列测定及RT-PCR分析 分析扩增产物,并对切胶回收纯化之后,将纯化产物连接于载体中(pGEM-T Easy)。把连接产物转接到E.coliDH5a 感受态细胞上,采用菌落PCR法鉴定阳性克隆和测序,将上述测序结果依据 Gen-Bank登录的SGLT-1、GLUT-2和ß-actin 基因序列进行比对分析。
1.8.7 实时荧光定量PCR 参照TAVERNIERS等[17]方法,提取阳性克隆质粒,其浓度用紫外分光光度仪(UV-6000PC)测定,使用已优化条件的 PCR进行RT-PCR,纵坐标为Ct值,横坐标为稀释倍数的对数,绘制相对定量标准曲线。以ß-actin为内标,对SGLT-1、GLUT-2相对表达量定量分析。
1.9 数据统计分析
1.9.1 使用分析软件 Bio Numerics 3.0(Applied Maths, Sint-Martens-Latem, Belgium)来分析 PCRDGGE 指纹图谱进行条带计数,利用 Dice法计算相似性指数Cs,采用UPGM-A(un weighted pair group mean average)进行聚类分析。
1.9.2 采用 2△△CT法[18]计算相关基因相对表达量,数据以平均值±标准差(Mean ±SD)表示,n=3,用SAS 8.0统计软件进行单因子方差分析(One-way ANOVA),以Duncan氏方法进行多重比较。

表5 Real-Time PCR中使用的各种引物Table 5 Primers for Real-Time PCR
2 结果
2.1 饲喂代乳粉对沂蒙黑山羊羔羊日增重以及肠道发育的影响
从表6中可见,Ⅱ组平均日增重第10、15天时小于Ⅰ组,到 25 d时大于Ⅰ组,但差异均不显著(P>0.05),而45 d时显著高于Ⅰ组(P<0.05),第75 天时其差异极显著(P<0.01)。另外,10—25d间Ⅱ组十二指肠重量小于Ⅰ组,25d后大于Ⅰ组,但差异均不显著(P>0.05);Ⅱ组空肠、回肠重量25 d时大于Ⅰ组,但差异均不显著(P>0.05),而45 d时其差异显著(P<0.05),第75 天时回肠差异极显著(P<0.01)。
2.2 饲喂代乳粉对沂蒙黑山羊羔羊小肠微生物菌群多样性的影响
从图3中可见,尽管哺喂母乳和代乳粉,但由于统一使用开食料,所以不可避免的产生共性条带;在小肠同一部位,不同日龄平均条带数差异显著(P<0.05),其中空肠、回肠平均条带数显著高于十二指肠(P<0.05)。两组空肠内容物混合物中细菌种类分别 14、14、9、11、12(共 60)和 11、10、12、15、13(共61)条;而十二指肠中细菌种类分别15、14、15、8、12(共 64)和 12、13、11、11、13(共 60)条;回肠中细菌种类分别13、10、14、11、9(共57)和8、12、13、14、13(共60)条。结果表明十二指肠在45、75 d,空肠在15 d,回肠在10 d时两组间菌群变化较为明显(P<0.05)。
采用Shannon-Wiener指数和Simpson指数方法对小肠部位菌群多样性进行分析,其结果见表7。Ⅰ、Ⅱ组菌群多样性变化较为相似,10、25 d时多样性指数Ⅰ组大于Ⅱ组,而45、75 d时Ⅱ大于Ⅰ组;Ⅰ组回肠平均多样性指数大于Ⅱ组,而十二指肠平均多样性指数小于Ⅱ组,且差异不显著(P>0.05);对于小肠各肠段菌落多样性指数,从高到低依次排序,分别为回肠、空肠和十二指肠,且差异不显著(P>0.05)。
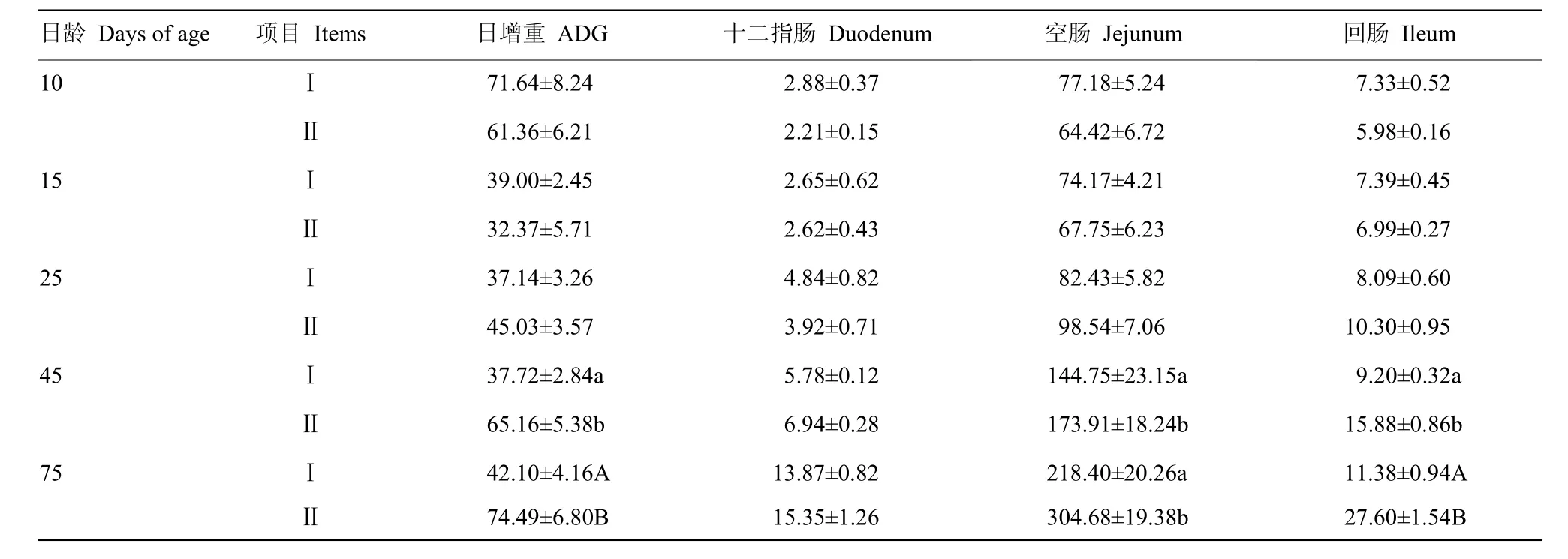
表6 代乳粉对沂蒙黑山羊羔羊日增重及肠道发育的影响Table 6 Effect of milk replacer on daily gain and development of intestine of Yimeng black goat lambs (g)
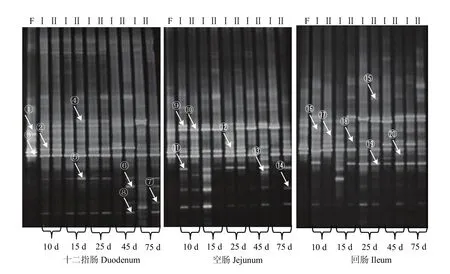
图3 不同肠段微生物细菌16S rDNA基因V3区共性、特异性PCR-DGGE指纹图谱Fig. 3 Common character and specificity PCR-DGGE DNA fingerprint of the V3 region of 16S rDNA gene in the microbial bacteria of different intestinal segments
2.3 饲喂代乳粉对沂蒙黑山羊小肠内容物中菌落组成的影响
从图4中可见,Ⅰ组十二指肠菌群相似性指数在15 d时达到高峰,且极显著高于45、75 d(P<0.01),Ⅱ组10 d时显著高于25、45 d(P<0.05),而45 d后呈上升趋势;Ⅰ、Ⅱ组空肠分别在25、15 d时达到高峰,且均显著高于 75 d(P<0.05);Ⅰ组回肠在15、75 d 相似性指数显著低于 10、25、45 d(P<0.05),而Ⅱ组15 d后呈上升趋势,且75 d时差异极显著高于15 d(P<0.01)。结果表明Ⅰ组空肠、回肠相似性指数在25 d后呈下降趋势,且回肠在75 d时显著下降(P<0.05);Ⅱ组15 d后空肠相似性指数下降,而回肠上升,且差异极显著(P<0.01)。
Ⅰ、Ⅱ组 16S rDNA 基因 V3 区PCR-DGGE图谱的PCA分析见图5。结果显示,Ⅰ、Ⅱ组10、15 d时各肠段菌群组成与食糜(F)相似,而25 d时Ⅰ、Ⅱ组的空肠与回肠菌群组成有分开趋势,45 d空肠与回肠菌群组成分开明显。
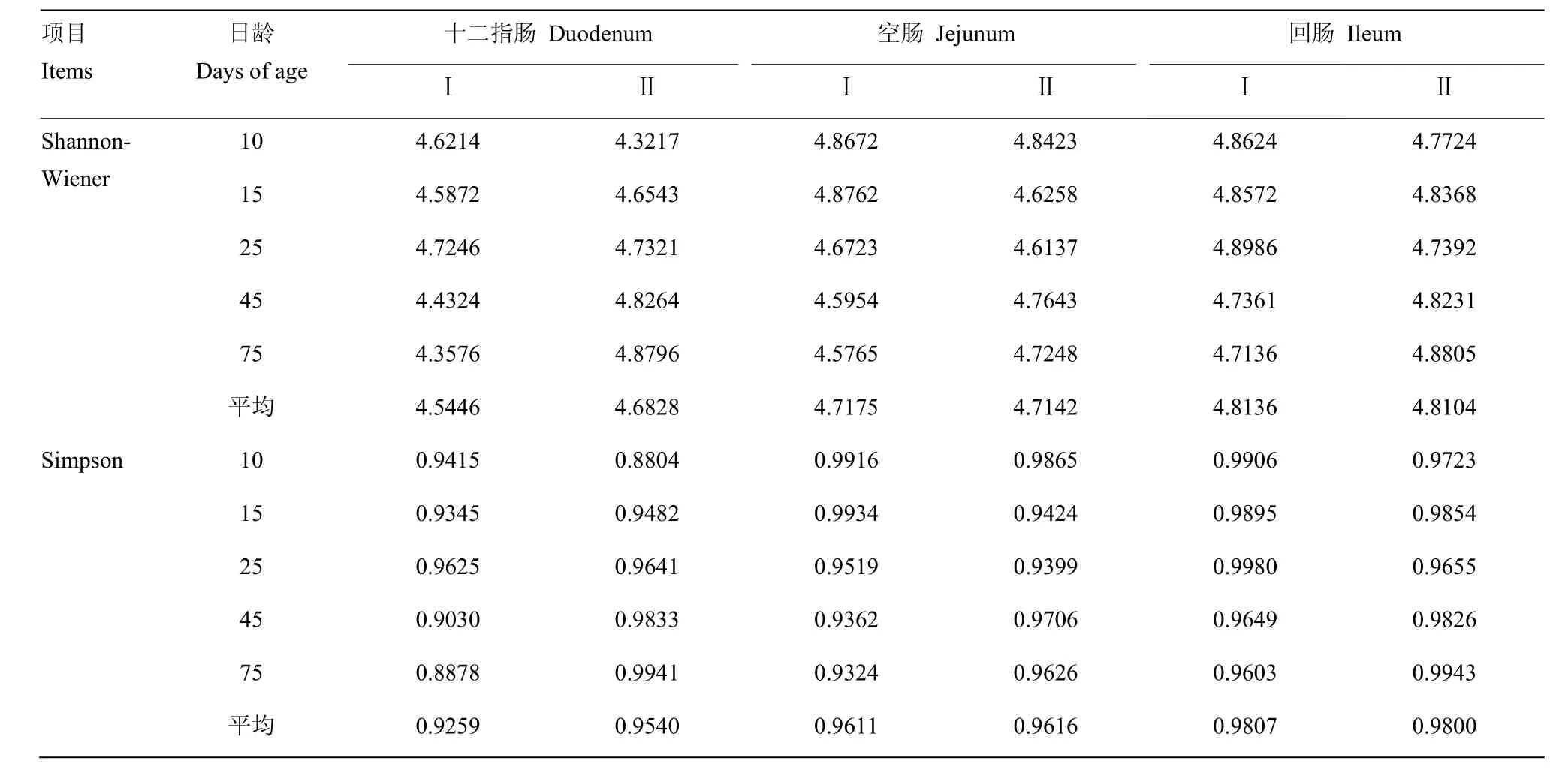
表7 不同肠段肠道菌群的Shannon-Wiener指数和Simpson指数变化Table 7 Shannon-Wiener and Simpson index changes of intestinal flora in the different intestinal segments
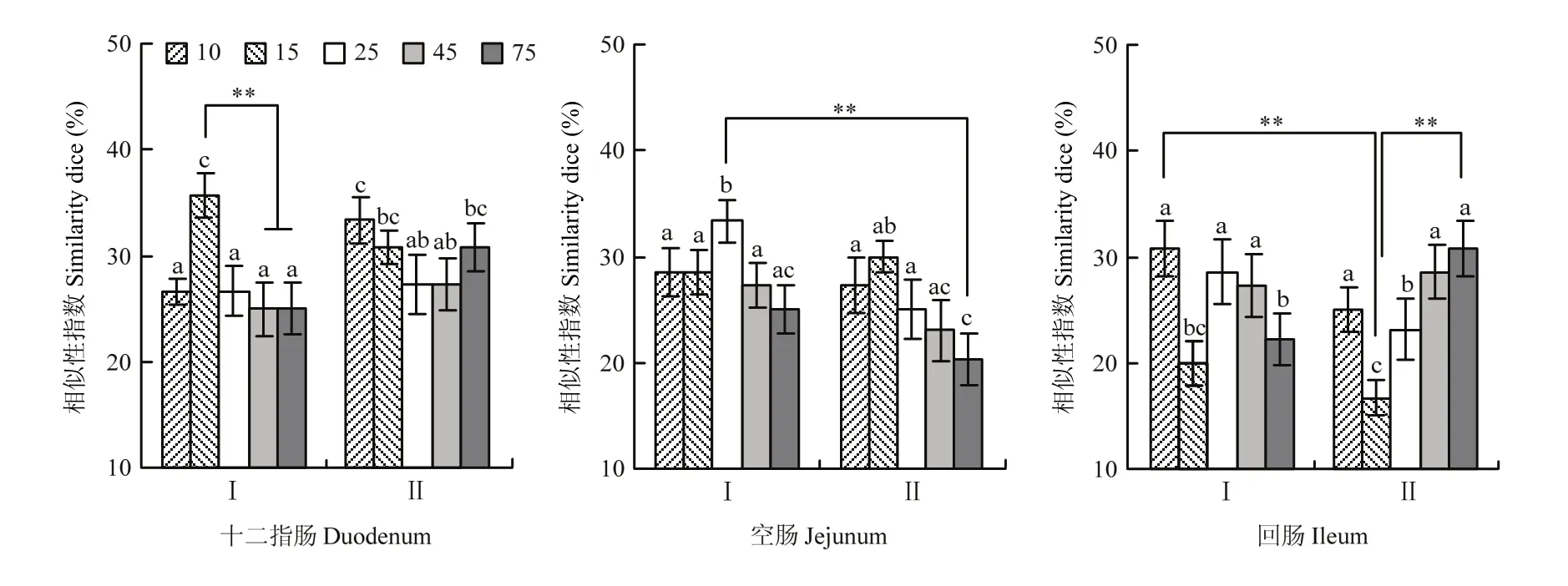
图4 肠道不同部位主要菌群相似性系数关系Fig. 4 Similarity coefficient relation of the main flora in the different parts of the intestine
2.4 饲喂代乳粉对沂蒙黑山羊羔羊小肠肠道内容物菌落物种多样性的影响
图3中箭头所指的指纹图谱中分别割胶回收测序结果见表8。两组各肠段部位菌群定植受到食糜中的溶淀粉乳杆菌(Lactobacillus amylolyticus strain2条带)、普雷沃氏菌(Prevotella species3条带)影响较大。Ⅰ组十二指肠的草酸杆菌(Oxalobacteraceae bacterium5条带)、发酵乳杆菌(Lactobacillus vaginalispartial8条带)在45 d时消失,而75 d时可检测;与Ⅰ组相比,Ⅱ组草酸杆菌(Oxalobacteraceae bacterium5条带)提前在25 d时消失,45 d时可检测发酵乳杆菌(Lactobacillus vaginalis partial8条带)。Ⅰ组空肠的约氏乳杆菌(Lactobacillus johnsonii11条带)、巨大芽孢杆菌(Bacillus megaterium strain14条带)、不可培养细菌(Uncultured Acetanaero bacterium sp15条带)在25 d后消失,而Ⅱ组25 d后可检测约氏乳杆菌,45、75 d时均可检测到不可培养细菌(Uncultured Acetanaero bacterium sp15条带)、巨大芽孢杆菌(Bacillus megaterium strain14条带)。Ⅰ组回肠的不可培养细菌(Uncultured Acetanaero bacterium sp15条带)在10 d消失,而Ⅱ组在15d之后均可检测;Ⅰ组回肠的发酵乳杆菌(Lactobacillus vaginalis partial8条带)、食淀粉乳杆菌(Lactobacillus_amy-lovorus20条带)在25 d后消失,而Ⅱ组25 d后均可检测。本试验测序结果与Gen Bank数据库微生物同源性比较分析来看,其同源性大部分超过98%甚至100%。然而,对于具有92、90、92、90%同源性的3、5、12、17条带的普雷沃氏菌(Prevotella species)、草酸杆菌(Oxalobacteraceae bacterium)、瘤胃球菌(Ruminococcaceae)和氨基酸球菌(AcidaMinoCoccaceae)可推测为新种。
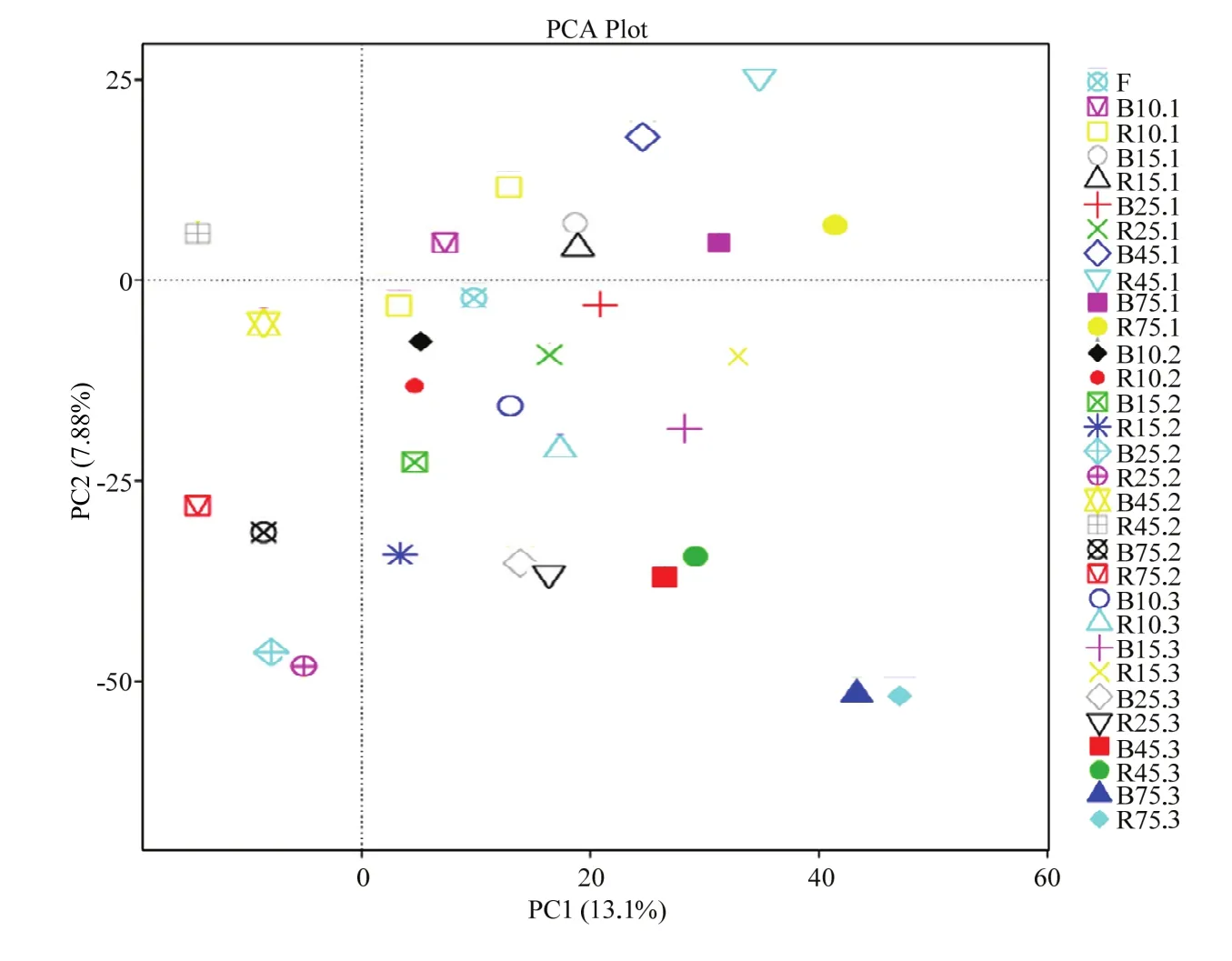
图5 不同肠段微生物细菌16S rDNA基因V3区PCR-DGGE指纹图谱的PCA分析Fig. 5 PCA analysis of the V3 region PCR-DGGE finger print of 16S rRNA gene of microbial bacterial in the different intestinal segments
2.5 沂蒙黑山羊羔羊小肠组织中葡萄糖转运载体(SGLT-1、GLUT-2)基因mRNA表达量分析
图6中可见,Ⅰ组各肠段中SGLT-1和GLUT-2mRNA表达量25 d时最低,而后逐渐升高,但差异不显著(P>0.05);Ⅱ组除空肠黏膜中GLUT-2mRNA表达量以外(P<0.05),各肠段中SGLT-1和GLUT-2mRNA表达量10 d时最低(P<0.01),而25 d后其表达量显著高与10d(P<0.05);Ⅱ组各肠段中SGLT-1和GLUT-2mRNA表达量在 25 d后均高于Ⅰ组;SGLT-1和GLUT-2基因表达量呈现肠段部位间差异。其中,SGLT-1mRNA表达量在空肠最为明显,其次为回肠,十二指肠最低,而GLUT-2mRNA表达量在十二指肠最为明显,其次为空肠和回肠。
3 讨论
3.1 代乳粉对沂蒙黑山羊羔羊日增重以及肠道发育的影响
刁其玉等[19]认为,代乳粉可以作为早期断奶羔羊母乳的代替品,但其效果受到诸多方面影响。譬如,代乳粉营养素的组成、饲喂方式、断奶日龄、羔羊健康状态、设施环境等。已有研究表明,代乳粉组在试验初期与母乳组比较体重差异不明显,而后期代乳粉组平均体重及日增重均大于母乳组,羔羊体增重和平均日增重相对于母羊哺乳的羔羊分别高于 26.4%和18.6%。另外,代乳粉组羔羊的十二指肠、空肠、回肠鲜重分别比对照组高14.85%、10.61%、75.28%。其中,回肠发育差异较大[20-21]。此外,张庆丽等[9]报道,早期能量与蛋白质缺乏对 28日龄断奶羔羊胃肠道器官发育有显著影响。本研究中,25 d时饲喂代乳粉羔羊的日增重速度和肠道发育较慢,显著低于母乳组,而45 d时羔羊平均日增重、空肠和回肠重量显著高于母乳组,且75 d时差异极显著,与前者试验结果相一致。这可能是与母乳和代乳粉营养物质的组成直接相关,本研究检测母乳中营养物质以及活性物质,其结果显示25 d后母乳中活性物质指标显著下降,并且蛋白能量比与代乳粉组比较逐渐降低,这些蛋白能量营养素的短缺影响瘦肉组织沉积和蛋白质合成周转,导致日增重偏低[22],而代乳粉中养分含量相对稳定,虽然在试验初期应激较大,但经过20 d左右适应过程促进羔羊的肠道发育乃至生长发育。
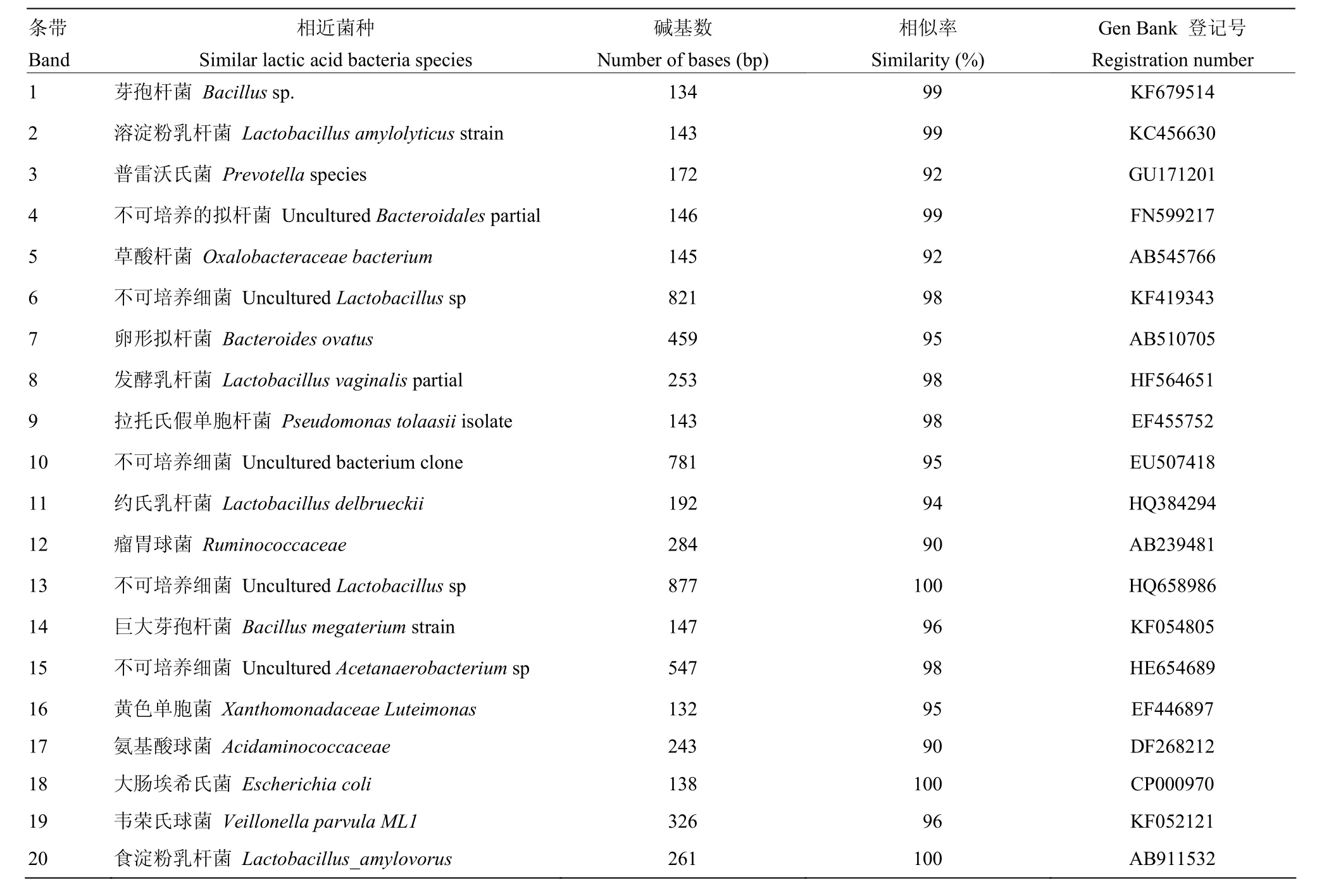
表8 PCR-DGGE共性条带和特异性条带的基因片段序列的比对结果Table 8 The comparison results of gene fragment sequences of PCR-DGGE common and specific bands analysis
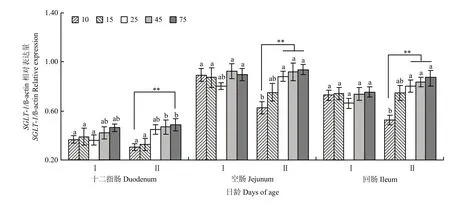
图6 SGLT-1mRNA在沂蒙黑山羊羔羊小肠中的差异性表达Fig. 6 The differential expression of SGLT-1 mRNA in small intestine of Yimeng black goat lambs
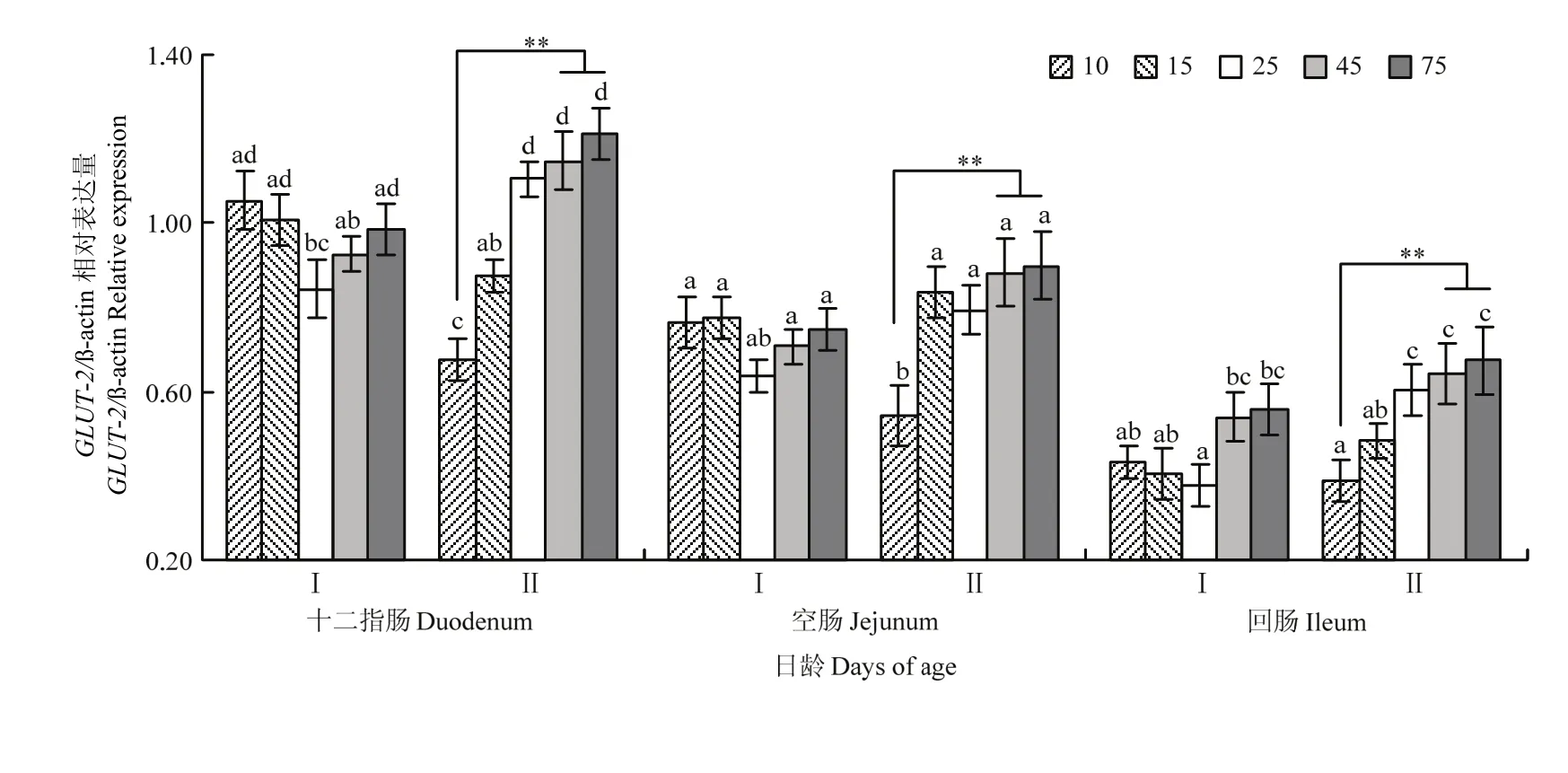
图7 GLUT-2 mRNA在沂蒙黑山羊羔羊小肠中的差异性表达Fig. 7 The differential expression of GLUT-2 mRNA in small intestine of Yimeng black goat lambs
3.2 饲喂代乳粉对沂蒙黑山羊羔羊小肠微生物菌群多样性的影响
已有研究报道[19-20],饲粮组成、日龄以及环境条件均影响肠道菌群结构。其中,日龄因素对肠道早期菌群定植影响较大,而到成熟期肠道菌群定植趋于相对平衡,此后肠道菌群多样性主要受到饲料组成和饲养环境条件的影响[23]。李小鹏等[24]认为,反刍动物胃肠道内微生物区系不是一出生就存在的,而是出生后随着与母体和环境的接触,经过消化道环境的适应和选择,经定植、存活和繁殖逐步建立起来的。当家畜发生应激(环境条件)时,可引起宿主肠道菌落结构的变化,导致消化道菌群紊乱,微生态平衡破坏[25]。相似性指数的高低间接地说明共性菌群以外的菌群情况[26]。本研究结果表明,Ⅰ组回肠在25 d后相似性指数呈下降趋势,而Ⅱ组回肠在15 d后逐渐上升。笔者认为,瘤胃功能尚未健全之际,作为微生物较为丰富的回肠,在代乳粉饲喂25 d后共性菌群比率逐渐增加,促进其菌群平衡,反映羔羊肠道适应环境应激状态。对于反刍动物而言,按不同的生理阶段分为非反刍阶段(1—20日龄),过渡阶段(21—56日龄),反刍阶段(57日龄后),而在反刍功能逐渐完善过程中胃肠道生理机能和菌落会发生较大变化[27-28]。本试验结果表明,空肠和回肠在 25 d后菌群变化较为明显,而十二指肠在45、75 d时菌群变化较大。有研究已证实,除了瘤胃具有强大的降解纤维物质的能力外,反刍动物小肠(包括空肠和回肠)对饲粮纤维类物质亦有很强的补偿消化能力,说明反刍动物后消化道消化能力的建立和完善与后肠道定植的细菌数量和种类直接相关[29-30]。本研究结果也反映代乳粉饲喂对后肠道菌群定植有一定的影响作用,Ⅱ组十二指肠发酵乳杆菌,空肠约氏乳杆菌、巨大芽孢杆菌,回肠发酵乳杆菌、食淀粉乳杆菌等有益菌与Ⅰ组相比提前定植,本试验结果与UYENO等[31]分析荷斯坦母牛从出生到 12周的肠道菌群结构变化结果相吻合。
3.3 沂蒙黑山羊羔羊小肠组织黏膜葡萄糖转运载体基因的表达
钠依赖性葡萄糖转运载体-1(SGLT-1)和促葡萄糖转运载体-2(GLUT-2)是小肠中葡萄糖的吸收所需要的特殊葡萄糖转运载体[33]。家畜肠道葡萄糖转运载体基因 mRNA表达量的变化反映了动物胃肠道中营养物质吸收的状态,哺乳动物从出生至断奶阶段,SGLT-1基因在肠道中的表达较强,对己糖的摄取能力强;断奶后,SGLT-1基因的表达量明显减少,对己糖的吸收也减少[34]。本试验结果也显示,Ⅱ组 8 d开始断奶后10 d时SGLT-1和GLUT-2mRNA表达量最低,而25 d后Ⅱ组表达量均高于Ⅰ组,此结果与Ⅱ组沂蒙黑山羔羊断奶过渡阶段羔羊机体组织从依赖母乳中葡萄糖转换为依靠肠道生酮作用而提供能量的生理变化适应过程直接相关。另外,25 d后Ⅰ组母乳中蛋白能量比的逐渐下降,会导致羔羊生长发育严重受阻,且机体组织细胞发育、增殖的调控转录表达都受到抑制[35],以及影响胃肠道葡萄糖转运载体相关基因表达[36]。羔羊由于处在特殊的生理阶段,对碳水化合物的消化吸收与单胃动物相似。本研究结果显示,饲喂代乳粉25 d时有益菌定植,有助于肠道分解消化能力,导致胃肠道内葡萄糖浓度有所升高。当肠腔中葡萄糖的含量较高时,反刍动物可以通过增加葡萄糖转运载体的数量从而调整它们的吸收能力以提高小肠中葡萄糖的吸收效率[37-38],进而肠道的吸收功能得到增强,有利于断奶后羔羊胃肠道功能的正常发挥。
总之,本研究结果表明,各肠段SGLT-1和GLUT-2mRNA表达量在25 d后Ⅱ组均高于Ⅰ组,此时空肠和回肠的菌群变化最大,并且有益菌定植比Ⅰ组提前,而日增重与空肠和回肠发育均在45d时Ⅱ组均显著高于Ⅰ组。这一结果说明除日粮(包括母乳)营养素原因之外,可能还有代乳粉饲喂25d时有益菌提前定植,提高肠道分解消化能力,造成胃肠道内葡萄糖浓度有所升高,影响空肠和回肠中SGLT-1和GLUT-2mRNA表达量,而葡萄糖转运载体基因表达量的变化直接影响肠道组织发育乃至机体生长发育,至于其分子机制需要进一步研究。
4 结论
饲喂代乳粉第 25天时促进沂蒙黑山羊早期断奶羔羊空肠、回肠有益菌提前定植,并通过调控葡萄糖转运载体基因表达而引起葡萄糖吸收转运的改变,进而影响羔羊后期肠道组织及机体的生长发育。
[1]THEISS A L, FRUCHTMAN,LUND P K. Growth factors in inflammatory bowel disease: The actions and interactions of growth hormone and insulin-like growth factor-I.Inflammatory Bowel Diseases2004, 10(6): 871-880.
[2]张航, 刘强, 王聪, 张延利, 裴彩霞, 王永新, 郭刚, 霍文婕, 张拴林. 2-甲基丁酸对犊牛小肠酶活及葡萄糖转运载体基因表达的影响. 中国农业科学, 2016, 49(5): 979-987.ZHANG H, LIU Q, WANG C, ZHANG Y L, PEI C X, WANG Y X,GUO G, HUO W J, ZHANG S L. Effects of 2-methylbutyrate on digestive enzymes activities and gene expression of glucose cotransporter of small intestine in calves.Scientia Agricultura Sinica,2016, 49(5): 979-987. (in Chinese)
[3]VELAYUDHAN B T, DANIELS K M, HORRELL D P, HILL S R,MCGILLIARD M L, CORL B A, JIANG H, AKERS R M.Developmental histology, segmental expression, and nutritional regulation of somatotropic axis genes in small intestine of pre-weaned dairy heifers.Journal of Dairy Science, 2008, 91(9): 3343-3352.
[4]SUN Z H, HE Z X, ZHANG Q L, TAN Z L, HAN X F, TANG S X,ZHOU C S, WANG M, ZHANG E P. Effects of protein and /or energy restriction for six weeks on antioxidation capacity of Plasma and gastrointestinal epithelial tissues of weaned kids.Livestock Science, 2012, 149(3): 232-241.
[5]MACKIE R I, WHITE B A. Recent advances in rumen microbial ecology and metabolism: Potential impact on nutrient output.Journal of Dairy Science, 1990,73(10): 2971-2995.
[6]卢玉飞, 周凌云, 赵圣国, 卜登攀, 孙鹏, 赵国琦. 近 10年瘤胃微生物分离培养研究进展. 中国微生态学杂志, 2012, 24(9): 856-862.LU Y F, ZHOU L Y, ZHAO S G, BU D P, SUN P, ZHAO G Q.Progress on isolation and culture of rumen microorganisms in recent ten years.Chinese Journal of Microecology, 2012, 24(9): 856-862. (in Chinese)
[7]KELLETT G L. The facilitated component of intestinal glucose absorption.Journal of Physiology, 2001, 531(3): 585-595.
[8]梁艳, 刘强, 王聪, 张延利, 裴彩霞, 王永新, 郭刚, 霍文婕, 张拴林, 石彩叶, 刘建新. 异丁酸对犊牛瘤胃及小肠黏膜基因表达的影响. 动物营养学报, 2015, 27(8): 2483-2492.LIANG Y, LIU Q, WANG C, ZHANG Y L, PEI C X, WANG Y X,GUO G, HUO W J, ZHANG S L, SHI C Y, LIU J X. Effects of isobutyrate on gene expressions of ruminal and small intestinal mucosa of calves.Chinese Journal of Animal Nutrition, 2015, 27(8):2483-2492. (in Chinese)
[9]LIU J, LIU Z, GAO L, CHEN L, ZHANG H. Nutrient-intake-leveldependent regulation of intestinal development in newborn intrauterine growth-restricted piglets via glucagon-like Peptide-2.Animal, 2016, 10(10): 1645-1654.
[10]BRANDSTETTER A M, PFAFFL M W, HOCQUETTE J F,GERRARD D E, PICARD B, GEAY Y, SAUERWEIN H. Effects of muscle type, castration, age, and compensatory growth rate on androgen receptor mRNA expression in bovine skeletal muscle.Journal of Animal Science, 2000, 78: 629-637.
[11]HAN H C, AUSTIN K J, NATHANIELSZ P W, FORD S P,NIJLAND M J, HANSEN T R. Maternal nutrient restriction alters gene expression in the ovine fetal heart.The Journal of Physiology,2004, 558(1): 111-121.
[12]王建民, 曹洪防, 王桂芝, 谢之景, 刘珊珊. 山东及国内优良羊品种介绍(下). 农业知识: 科学养殖, 2011: 6-12.WANG J M, CAO H F, WANG G Z, XIE Z J, LIU S S. Introduction of fine sheep breeds in Shandong and in domestic (next) .Agricultural Knowledge: Scientific Breeding, 2011: 6-12. (in Chinese)
[13]屠焰, 刁其玉, 岳喜新. 一种0-3月龄羔羊的代乳品及其制备方法:中国, 201210365927.6[P]. 2013.TU Y, DIAO Q Y, YUE X X. The Milk replacer for 0-3 month of lambs and its preparation method: China, 201210365927.6 [P]. 2013.(in Chinese)
[14]张丽英. 饲料分析及饲料质量检测技术. 北京:中国农业大学出版社 2007.ZHANG L Y.Feed Analysis and Feed Quality Inspection Technology.Beijing: China Agricultural University Press, 2007. (in Chinese)
[15]王海超, 张乃锋, 柴建民, 王波, 刁其玉. 培育方式对双胞胎湖羊羔羊肝基因表达的影响. 畜牧兽医学报, 2016, 47(4): 733-744.WANG H C, ZHANG N F, CHAI J M, WANG B, DIAO Q Y. Effect of different rearing systems on hepatic gene expression of early weaned Hu Twin Lambs.Acta Veterinaria et Zootechnica Sinica,2016, 47(4): 733-744. (in Chinese)
[16]李永洙, 陈常秀, Yong-quan Cui. 热应激对蛋鸡肠道菌群结构、碱性磷酸酶活性及氨基酸转运载体mRNA表达丰度的影响. 中国农业科学, 2013, 46(20): 4378-4387.LI Y Z,CHEN C X,CUI Y Q. Effect of heat stress on the intestinal flora structure and alkaline phosphatase activities and mRNA expression of amino acid transporters of layer.Scientia Agricultura Sinica, 2013, 46(20): 4378-4387. (in Chinese)
[17]TAVERNIERS I, BOCKSTAELE E V, LOOSE M D. Cloned plasmid DNA fragments as calibrators for controlling GMOs: different real-time duplex quantitative PCR methods.Analytical and Bioanalytical Chemistry, 2004, 378 (5): 1198-1207.
[18]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method.Methods, 2001, 25(4): 402-408.
[19]刁其玉, 屠焰, 于雪初, 张林. 羔羊专用代乳粉的营养特性. 中国饲料, 2003, (7) : 18-19.DIAO Q Y, TU Y, YU X C, ZHANG L. The nutritional properties of the milk replacer special for lambs.China Feed, 2003, (7): 18-19. (in Chinese)
[20]江喜春, 夏伦志, 张乃锋, 谢俊龙, 陈丽园, 柴建民, 刁其玉. 代乳粉能量水平对早期断奶湖羊羔羊生长性能和物质代谢的影响. 中国畜牧杂志, 2015, 51(7): 50-53.JIANG X C, XIA L Z, ZHANG N F, XIE J L, CHEN L Y, CHAI J M,DIAO Q Y. Effect of energy level of milk replacer on growth performance and nutrient utilization in Hu Lambs.Chinese Journal of Animal Science, 2015, 51(7): 50-53. (in Chinese)
[21]岳喜新, 刁其玉, 马春晖, 邓凯东, 屠焰, 姜成钢, 杜红芳. 早期断奶羔羊代乳粉饲喂水平对营养物质消化代谢及血清生化指标的影响. 中国农业科学, 2011, 44(21): 4464-4473.YUE X X, DIAO Q Y, MA C H, DENG K D, TU Y, JIANG C G, DU H F. Effects of feeding levels of a milk replacer on digestion and metabolism of nutrients, and serum biochemical indexes in lambs.Scientia Agricultura Sinica, 2011, 44(21): 4464-4473. (in Chinese)
[22]CHIBA L I, LEWIS A J, PEO JR E R. Amino acid and energy interrelationships in pigs weighing 20 to 50 kilograms: I. Rate and efficiency of weight gain.Journal of Animal Science, 1991, 69:696-707.
[23]刘艳丰, 侯广田, 唐淑珍, 王文奇. 代乳品对羔羊早期断奶生产性能的影响. 饲料研究, 2011, (11): 63-64.LIU Y F, HOU G T, TANG S Z, WANG W Q. The effect of the milk replacer on the performance of early weaned lambs.Feed Research,2011, (11): 63-64. (in Chinese)
[24]李小鹏, 焦金真, 颜琼娴, 谭支良. 山羊羔羊回肠细菌群落定植与消化功能的发育性变化. 动物营养学报, 2016, 28(3): 731-738.LI X P, JIAO J Z, YAN Q X, TAN Z L. Developmental changes in bacterial colonization and digestive function in ileum of lambs.Chinese Journal of Animal Nutrition, 2016, 28(3): 731-738. (in Chinese)
[25]BONNET S, GERAERT P A, LESSIRE M, CARRE B,GUILLAUMIN S. Effect of high ambient temperature on feed digestibility in broilers. Poultry Science, 1997, 96:857-863.
[26]HUME M E, KUBENA L F, EDRINGTON T S, DONSKEY C J,MOORE R W, RICKE S C, NISBET D J. Poultry digestive microflora biodiversity as indicated by denaturing gradient Gel electrophoresis.Poultry Science, 2003, 82: 1100-1107.
[27]KRAUSE D O, NAGARAJA T G, WRIGHT A D G, CALLAWAY T R. Board-invited review: Rumen microbiology: Leading the way in microbial ecology.Journal of Animal Science, 2013, 91(1): 331-341.
[28]REY M, ENJALBERT F, MONTEILS V. Establishment of ruminal enzyme activities and fermentation capacity in dairy calves from birth through weaning.Journal of Dairy Science, 2012, 95(3): 1500-1512.
[29]TAN Z L, LU D X, HU M, NIU W Y, HAN C Y, REN X P, NA R,LIN S L. Effect of dietary structural to nonstructural carbohydrate ratio on rumen degradability and digestibility of fiber fractions of wheat straw in sheep .Asian-Australasian Journal of Animal Sciences,2002, 15(11): 1594-1598.
[30]TAN Z L, LU D X, HU M, NIU W Y, HAN C Y, REN X P, NA R,LIN S L. Effects of dietary nitrogen sources on fiber digestion and ruminal fluid characteristics in sheep fed wheat straw.Asian-Australasian Journal of Animal Sciences, 2001, 14(10): 1374-1382.
[31]UYENO Y, SEKIGUCHI Y, KAMAGATA Y. rRNA-based analysis to monitor succession of faecal bacterial communities in Holstein calves.Letter in Applied Microbiology, 2010, 51(5): 570-577.
[32]郭慧玲, 邵玉宇, 孟和毕力格, 张和平. 肠道菌群与疾病关系的研究进展. 微生物学通报, 2015, 42(2): 400-410.GUO H L, SHAO Y Y, MENGHEBILIGE, ZHANG H P. Research on the relation between gastrointestinal microbiota and disease.Microbiology China, 2015, 42(2): 400-410. (in Chinese)
[33]ZHAO F Q, OKINE E K, CHEESEMAN C I, SHIRAZI-BEECHEY S P, KENNELLY J J. Glucose transporter gene expression in lactating bovine gastrointestinal tract.Journal of Animal Science, 1998, 76(11):2921-2929.
[34]HAYASHI H, YONEZAWA T, KANETANI T, TERADA F,KATOH K, OBARA Y. Expression of mRNA for sodium-glucose transporter 1 and fatty acid translocase in the ruminant gastrointestinal tract before and after weaning.Animal Science Journal, 2005, 76(4):339-344.
[35]张庆丽.早期能量与蛋白限制饲养对1月龄断奶羔羊胃肠道发育的影响[D]. 杨凌:西北农林科技大学, 2010.ZHANG Q L. Effects of early energy and protein restricted feeding on gastrointestinal development of weaned lambs at age of 1 month[D].Yangling: Northwest A&F University, 2010. (in Chinese)
[36]吴建, 李小鹏, 贺志雄, 焦金真, 谭支良. 妊娠后期营养限制对母羊胃肠道葡萄糖转运载体相关基因表达的影响. 动物营养学报,2017, 29(2): 645-651.WU J, LI X P, HE Z X, JIAO J Z, TAN Z L. Effects of nutritional restriction during late gestation on gene expressions of glucose transporters in gastrointestinal tract of ewes Chinese Journal of Animal Nutrition, 2017, 29(2):645-651. (in Chinese)
[37]DYER J, VAYRO S, KING T P, SHIRAZI- BEECHEY S P. Glucose sensing in the intestinal epithelium.European Journal of Biochemistry,2003, 270: 3377- 3388.
[38]LOHRENZ A K, DUSKE K, SCHONHUSEN U, LOSAND B,SEYFERT H M, METGES C C, HAMMON H M. Glucose transporters and enzymes related to glucose synthesis in small intestinal mucosa of mid-lactation dairy cows fed 2 levels of starch.Journal of Dairy Science,2011, 94(9): 4546-4555.

