甘薯病毒病原相关的microRNA的挖掘及分析
李华伟,刘中华,张鸿,许泳清,李国良,林赵淼,邱永祥,罗文彬,纪荣昌,汤浩,邱思鑫
(福建省农业科学院作物研究所/农业部南方薯类科学观测实验站,福州350013)
0 引言
【研究意义】MicroRNA(miRNA)是一类内源性小分子非编码的单链RNA,其长度范围在19—25 nt。植物中的miRNA高度保守,在转录水平通过碱基互补配对的方式识别并调控靶基因的表达,进而参与植物抗逆性、生长发育、新陈代谢等生物学过程[1-2]。动植物中 miRNA表达受病毒感染调控,miRNA表达能够引起靶基因及其后续信号途径、代谢和免疫应答变化,引导细胞逃避或者抵抗病毒感染带来的损伤[3-5],另外,病毒感染可导致农作物产量和品质的下降[6-7],因此,鉴定植物中由病毒感染引起的miRNA表达差异,能够促进对植物抗病毒感染机制的深入了解。【前人研究进展】高通量测序技术的发展推动miRNA的挖掘分析,目前为止在植物中被鉴定出来miRNA已包含40多个miRNA家族。刘辛[8]报道了黄瓜花叶病毒(Cucumber mosaic virus,CMV)和番茄不孕病毒感染番茄植株后,对miRNA及其靶基因的表达有不同程度的影响;陈莎[9]采用深度测序方法挖掘并鉴定云南和贵州省玉米病毒的种类;王园龙等[10]利用高通量测序技术鉴定白花泡桐中与盐胁迫相关的差异 miRNA,发现 33个已知miRNA和80个新的miRNA表达具有差异性;陈洁[11]利用Solexa深度测序分析获得玉米根系中与重金属Pb胁迫相关的92个已知的miRNA和378个新的miRNA及其靶基因;马骢毓[12]运用高通量测序方法及生物信息学分析手段,鉴定出与马铃薯抗旱相关的89个已知miRNA和239个未知miRNA及其靶基因,因此,利用高通量测序是一种筛选与抗病毒相关miRNA的高效技术手段[13]。【本研究切入点】甘薯褪绿矮化病毒(Sweet potato chlorotic stunt virus,SPCSV)、甘薯羽状斑驳病毒(Sweet potato feathery mottle virus,SPFMV)、甘薯曲叶病毒(Sweet potato leaf curl virus,SPLCV)等 10多种病毒是甘薯(Ipomoea batatas)中常见的感染病原[14],这些病毒严重影响了甘薯的性状、产量以及品质。但目前为止,尚未有关于甘薯病毒相关的miRNA鉴定和分析的报道。【拟解决的关键问题】通过比较被病毒感染的甘薯样品之间的差异表达 miRNA,鉴定不同病毒感染引起的差异表达miRNA及其相关应答机制,明确与甘薯病毒感染相关的miRNA,为miRNA参与感染抗病毒胁迫的机制研究打下基础。
1 材料与方法
试验于2016年4月至2017年10月在福建省农业科学院作物研究所薯类中心试验室进行。
1.1 材料
甘薯品种龙薯9号材料均于2017年5月采自福建泉州地区,时间为植株自然发病。4个材料的病理症状包含了畸形黄化、疱疹、褪绿矮化、曲叶等症状(图1)。试验验证时,采用脱毒苗作为无病毒对照样本。
1.2 方法
1.2.1 RNA抽提、Illumina文库构建及测序 于甘薯生长期采样,每个症状的植株采样3株,收集等量叶片后混合,采用UNIQ-10柱式总RNA抽提试剂盒(上海生工)抽提叶片 RNA。总 RNA的质量检测由NanoDrop 2000超微量分光光度计(上海美普达仪器有限公司)和Agilent 2100生物分析仪(Agilent,美国)进行。miRNA测序文库的构建按照Illumina公司TruSeqTMSmall RNA Sample Prep Kits(Illumina,美国)试剂盒提供的标准流程进行。采用Illumina Hiseq 2500平台进行small RNA测序,读长为单端1×50 bp。
1.2.2 数据质控及分析 获得clean small RNA数据后,对其长度、种类及丰度分析,运用 Blast软件(http://blast.ncbi.nlm.nih.gov/)与 Rfam11数据库(http://Rfam.sanger.ac.uk/),过滤、剔除非small RNA序列(mRNA、rRNA、tRNA、snRNA和snoRNA等)。最后运用 Bowtie 软件(http://bowtie-bio.sourceforge.net/index.shtml)分析small RNA序列在基因组上的分布情况。通过与甘薯病毒库(http://www.ncbi.nlm.nih.gov/genome/viruses)比对,鉴定测序数据中的与病毒种类。
1.2.3 已知miRNA的鉴定 将small RNA序列与甘薯参考基因组中 miRNA前体及成熟体序列进行比对,进行已知 miRNA的鉴定,运用 RNAfold软件(http://www.tbi.univie.ac.at/RNA/)和 Mireap 软件(http://mireap.sourceforge.net/)预测和分析 miRNA二级结构。
1.2.4 新miRNA的鉴定 将未注释的small RNA序列数据运用Mireap软件(http://mireap.sourceforge.net/)进行序列二级结构分析和新 miRNA的预测,新miRNA预测标准参考MEYERS等描述,参考预测结果结合Dicer酶切位点信息、能量值等特征预测、鉴定新miRNA[10,15]:1、miRNA前体具有标志性发夹结构;2、序列长度在18—32 nt;3、最低自由能(MFE)≤-75 kJ·mol-1,且对称度为 7 nt,最长距离 100 nt,碱基配对数10 nt。
1.2.5 差异表达 miRNA鉴定及靶基因预测 根据每个 miRNA分别在样本文库中的相对表达丰度(TPTM),运用DEGseq和DEseq R语言包中Expdiff方法选择差异表达 miRNA及其显著性,差异表达miRNA的鉴定标准为│log2(TPTM1/TPTM2ratio)│≥1且P-value≤0.05。运用 TargetFinder对差异表达miRNA靶基因预测[16]。
1.2.6 差异表达miRNA靶基因GO和KEGG pathway富集分析 利用Goatools (https://github.com/tanghaibao/GOatools)软件进行GO分析,将miRNA靶基因按照生物学过程、构成细胞的组分,实现的分子功能等进行分类,Fisher精确检验,多重检验方法(Bonferroni,Holm, Sidak和false discovery rate,BH(FDR))对P值进行校正,校正后P值(P-FDR/ correctedP-value)≤0.05视为显著富集的 GO功能。采用 KOBAS(http://kobas.cbi.pku.edu. cn/home.do)进行差异表达miRNA靶基因KEGG pathway富集分析,满足校正后P值(correctedP-value)≤0.05的KEGG通路视为显著富集的KEGG通路。
1.2.7 差异表达 miRNA的实时荧光定量 PCR检测
miRNA的相对表达量检测采用stem-loop方法进行检测,设计miRNA的stem-loop引物、miR通用反向引物、PCR的正向引物(表1),用TaKaRa公司的荧光定量PCR试剂盒进行检测,使用ABI PRISM 7500实时荧光定量PCR系统进行扩增。扩增条件:95℃预变性5 min,然后95℃ 15 s,65℃ 45 s,40个循环,65℃保存。以actin作为内参,miRNA的相对表达量以 2-ΔΔCt公式进行计算。
1.2.8 半定量PCR及一代测序检测 半定量PCR检测病毒的表达,病毒相关序列及引物名称如表1,扩增体系为20 μL(含10 μL扩增混合物),扩增产物经1.2%琼脂糖凝胶电泳检测,回收阳性条带后进行一代测序,对所得序列与NCBI数据库进行比对分析。
2 结果
2.1 样本症状、测序数据质控及比对分析
如图1所示,4个样本之间的症状各有不同,分别表现为典型的畸形黄化、疱疹、褪绿矮化以及曲叶症状。4个样本所得测序数据clean reads Q20%值>98%,Q30%值>95%(表2)。对small RNA的长度分析显示3个文库中small RNA的长度在21、22和24 nt的丰度较高(图2),而Fj01样本的small RNA长度在18—21 nt间分布较多,各样本之间small RNA的长度峰值稍有不同。

表1 实时定量PCR引物序列Table 1 The primers for real-time PCR

图1 甘薯病毒感染后不同症状Fig. 1 Different symptoms after sweet potato virus infection

表2 Illumina测序数据统计表Table 2 Summary of the Illumina sequencing results
4个文库数据中非small RNA序列占比在0.31%—1.32%,比对到参考基因组的比率为 70.59%—92.34%,表明本次测序所得的数据质量较高(表3)。
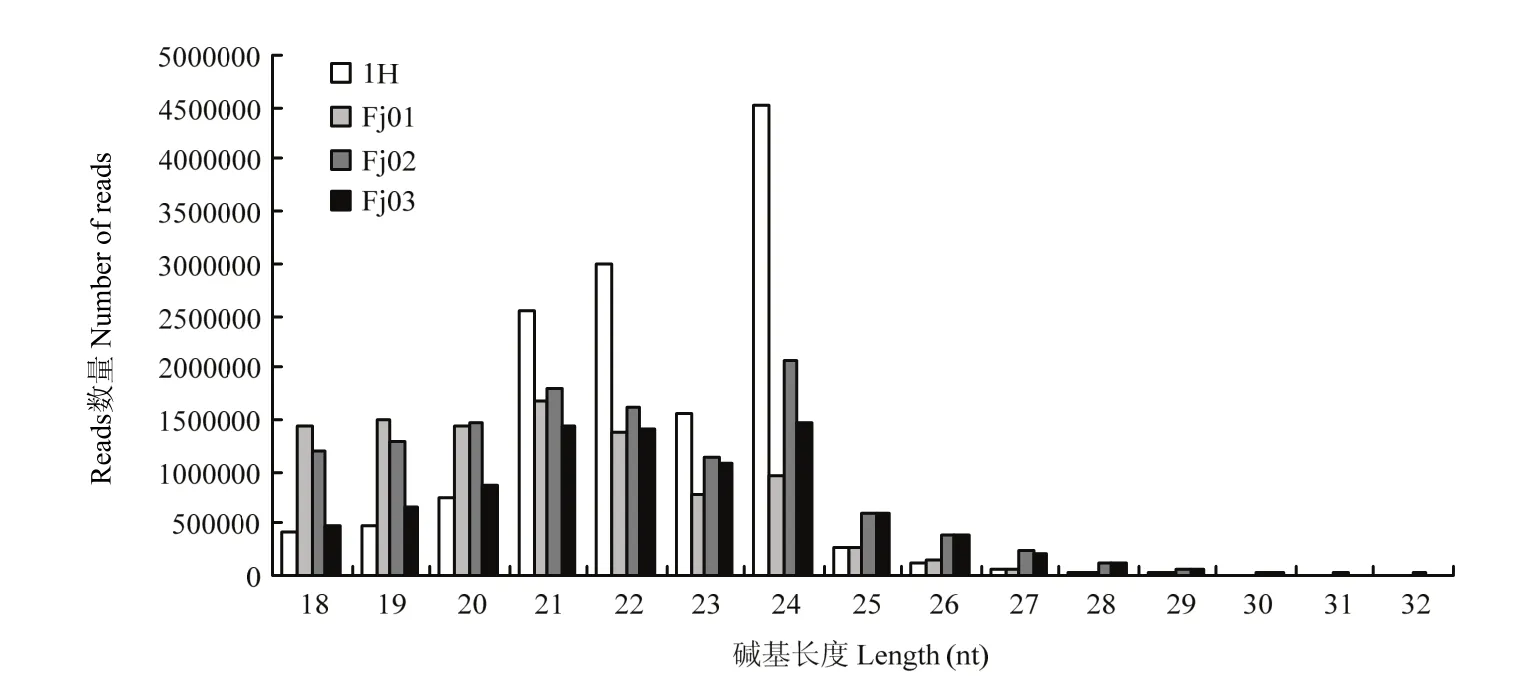
图2 Small RNA的长度分布Fig. 2 Distribution of small RNA length
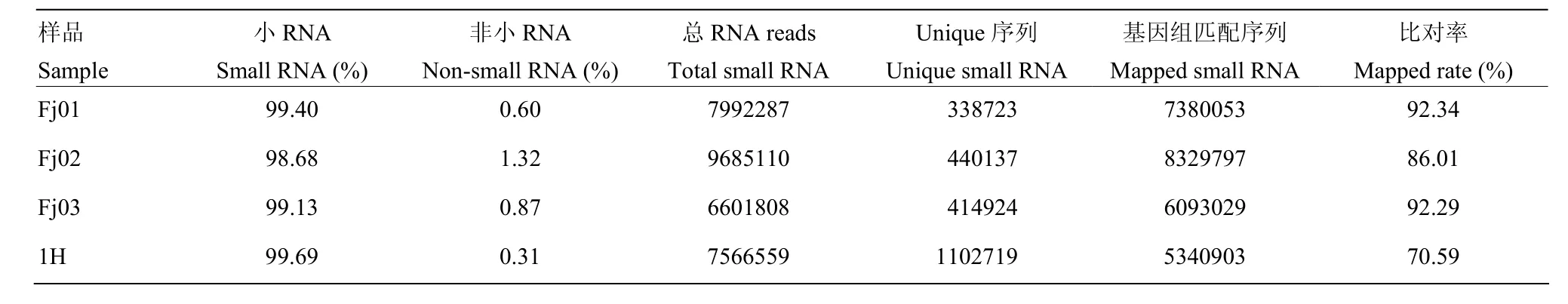
表3 Small RNA注释及参考基因组比对率Table 3 Annotation of small RNA and mapped rate to reference genome
2.2 病毒库比对结果分析
将所得的small RNA reads与甘薯病毒库进行比对(BLASTn),4个样本与病毒库匹配度为0.0002%—0.0048%(附表1),除1H外,均感染多种甘薯病毒,包括甘薯常见病毒甘薯 G病毒(Sweet potato virus G,SPVG)、甘薯病毒2号(Sweet potatovirus 2,SPV2)、甘薯C病毒、甘薯褪绿矮化病毒、甘薯羽状斑驳病毒、甘薯潜隐病毒(Sweet potato latent virus,SPLV)等。另外还有落葵皱纹花叶病毒(Basella rugose mosaic virus,BaRMV)、豇豆蚜传花叶病毒(Cowpea aphid-borne mosaic virus,CAMV)、葱花叶病毒(Scallion mosaic virus,ScaMV)、人参Y病毒(Panax virus Y,PanVY)等非甘薯常见病毒。
1H 样本除西部云杉色卷蛾颗粒体病毒(ChocGV)、沙门达病毒N/NSs(SHAV-N/NSs)和肠杆菌噬菌体病毒(Enterobacteria phage virus)外并无其他病毒感染。而其他3个样本之间的病毒感染相差不大,但种类特殊,如Fj02样本(疱疹)特异性感染了山药温和花叶病毒(Yam mild mosaic virus,YMMV)、马铃薯潜隐病毒(Potato latent virus,PLV)等,而Fj03样本中甘薯双生病毒种类较多,如甘薯上海曲叶病毒(Sweet potato leaf curl Shanghai virus,SPLCShV)和甘薯孟加拉曲叶病毒(Sweet potato leaf curl Bengal virus,SPLCBeV)。
采用半定量PCR检测了SPFMV和SPVC两个病毒在症状样本及无症状(脱毒苗,对照)样本中表达情况,发现SPFMV和SPVC两个病毒在对照样本中无表达,在4个症状样本中具有不同程度的表达(图3),一代测序结果与 NCBI数据库比对结果显示,Fj01-03样本中均检测到了 SPFMV和 SPVC病毒序列,但1H样本序列与NCBI数据库不匹配,与二代测序结果基本一致。
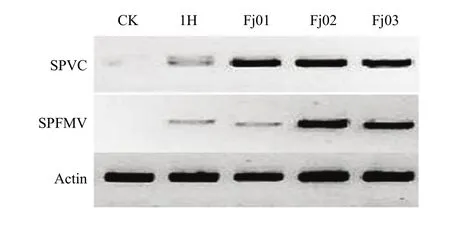
图3 PCR验证甘薯病毒在样本间的表达Fig. 3 Expression of sweet potato virus by PCR analysis
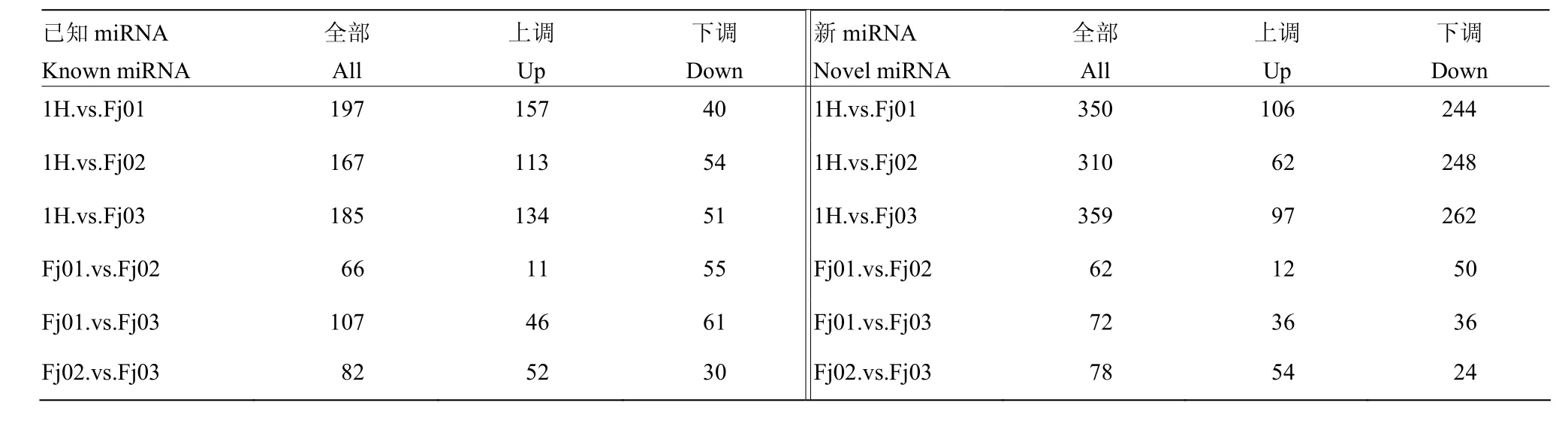
表4 样本间的差异表达miRNATable 4 Differentially expressed miRNA between samples
2.3 已知miRNA和新miRNA的鉴定
通过与 miRBase20数据库(http://www.mirbase.org/)中植物miRNA前体序列比对,共鉴定到679个已知miRNAs,其中包括常见的miRNA家族成员,如miR156、miR166、miR169等家族。另外运用Mireap软件鉴定到1 004个新的miRNA。
2.4 差异表达miRNA筛选及其靶基因预测
通过对不同症状样本数据的比较分析,共筛选到288个已知的差异miRNA和433个新的差异miRNA(图4、表4)。这288已知差异miRNA包括miR156、miR157、miR166、miR172等家族的全部或者部分成员,并预测到417个靶基因;433个新的差异miRNA有1 856个靶基因。这些靶基因多为转录因子家族成员,其编码蛋白多含有 ZFP、bHLH、SPL、lectin和homeobox-leucine zipper protein等功能区域。通过对已知的差异miRNA进行比较,发现miRNA家族部分或者全体均为差异 miRNA,如 miR156家族、miR157家族全体成员等在样本之间表达均有差异,部分miRNA 的成员,如 miR166d/e/t,miR169i/o/u、miR395b/c/d等在不同症状样本之间表达也具有差异,而且这些差异 miRNA在马铃薯、拟南芥、水稻、大豆、番茄中的保守性比较好。
通过 stem-loop PCR,检测了已知差异 miRNA(miR-156和 miR-319m)和新的差异 miRNA(novel-miR-40)的表达,结果显示这3个miRNA的表达模式与sRNA-seq分析结果相似(图5),这表明测序数据真实度较高。
2.5 病毒相关miRNA的差异表达
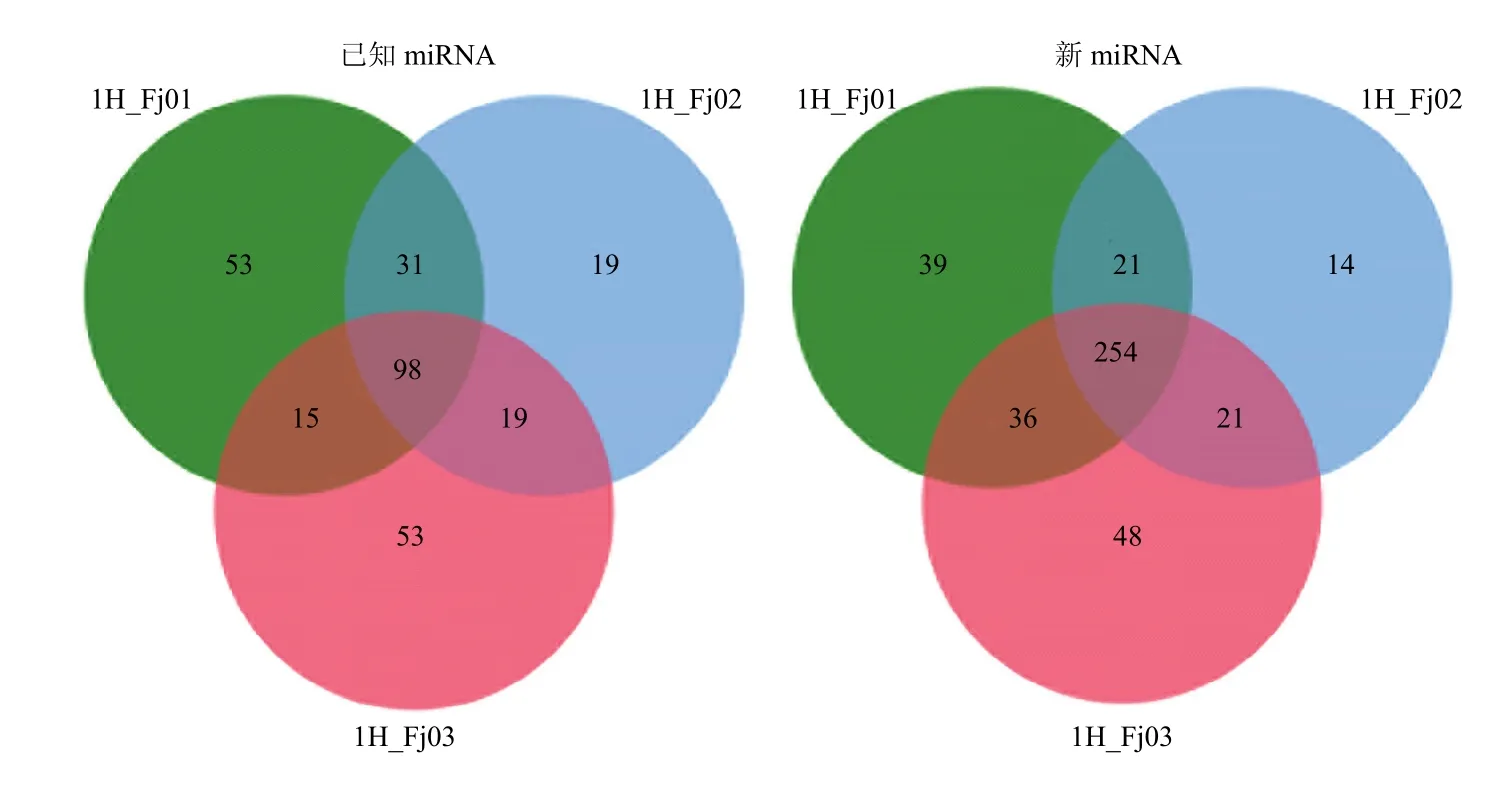
图4 差异表达miRNA的Venn图Fig. 4 Venn graphics of differentially expressed miRNA
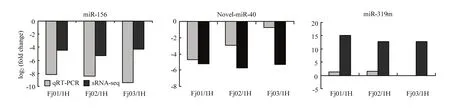
图5 差异表达miRNA的PCR验证与RNA-seq分析Fig. 5 Comparative analysis of the expression profiles of the differentially expressed miRNAs by PCR and RNA-seq
为了分析不同症状样本之间的差异miRNA,对4个样本进行配对比较分析,与1H样本比较,Fj01、02和03样本中的miR-156和miR-157表达量分别显著下降,miR-156家族的成员miR-156a/d/e/g/o和miR-157家族成员miR-157c在Fj01、02和03样本中的表达量均显著高于 1H样本,而 miR-156f/k和miR-157b/d/r的表达量在 1H样本中显著高于其他样本,对Fj01、02和03这3个样本之间两两比较发现,miR-156a/d/g/k在Fj01或Fj02中的表达量最高,Fj03中最低,miR-156e在Fj02中表达量最高,Fj01中次之,Fj03中最低,同样miR-157家族成员在3个样本中分别具有不同程度的上调或下调趋势,表明病毒感染能够引起 miR-156和 miR-157的差异表达。miR-159、miR-166、miR-167、miR-169、miR-319、miR-395、miR-396、miR-2630等家族的成员在4个样本之间的表达量也存在显著差异。
为了检测 miRNA表达与病毒感染的相关性,运用实时定量 PCR方法检测随机选择的 3个 miRNA(miR-160a、miR-2096和miR-5387b)在4个症状样本及对照(无病毒感染)样本中的表达情况,结果表明,与对照样本相比,这几个miRNA在1H和Fj01-03几个样本中表达量有不同程度的上调(图6),与上述分析结果基本一致,这表明病毒感染能够引起miRNA的差异表达,但由于田间感染病毒类型的多样性和症状的复杂性,病毒种类与差异 miRNA的相关性需要进一步的分析和验证。
2.6 差异表达miRNA的GO和KEGG pathway富集分析
2.6.1 已知的差异miRNA靶基因富集分析 通过对差异表达 miRNA靶基因的 GO富集分析,已知的差异miRNA靶基因的富集到19个显著富集的GO功能团(P-FDR≤0.05),表明这些差异miRNA的靶基因均与植物的生长发育、细胞分化、形态形成等相关(图7)。
KEGG pathway富集结果显示已知的差异miRNA靶基因没有显著富集的pathways(correctedP-value<0.05)。因此仅对前10个pathways分析,发现已知的差异miRNA靶基因与植物“病原加工与呈递”(ko04612)、“内质网蛋白加工”(ko04141)以及MAPK、mTOR等信号通路有关(附表2),如叶绿体热激蛋白(chloroplast heat shock protein 70-2,cpHSP70-2)。

图6 PCR验证差异表达miRNA在症状样本和对照之间的表达情况Fig. 6 The relative expression level of 3 miRNAs in sequenced data and control samples by PCR

图7 已知差异表达miRNA靶基因的前30个GO富集分析结果Fig. 7 The top 30 GO enrichment of known differentially expressed miRNA targets
2.6.2 新的 miRNA靶基因富集分析 新的差异miRNA靶基因并没有显著富集的 GO和 KEGG pathway(correctedP-value<0.05)。同样,对前 10个相对比较显著的pathway富集结果分析,发现新的miRNA靶基因与植物“植物病原菌互作”有关,包括novel-miR-808、838和1157的靶蛋白:钙依赖性蛋白激酶或钙结合蛋白(calcium-binding protein,CML22、CML31和 CML45)、novel-miR-300 靶蛋白NBS-NBS-LRR型抗病蛋白(NBS-NBS-LRR type disease resistance protein)等,这些靶蛋白通过直接或者间接的识别抗原,再通过不同的通路传递信号,参与植物的防御和抗病机制。
3 讨论
本研究中采用Illumina的高通量测序技术对具有不同病毒感染症状的4个甘薯样本的叶片(龙薯9号)进行 miRNA测序,从中筛选与病毒类型相关的差异miRNA。得到的数据与参考基因组比对率较高(70.59%—92.34%),不同样本RNA的长度分布具有差异性,表明small RNA长度分布可能与病毒感染有关。
不同于无菌实验室的单一病毒接种,大田自发病毒感染的样本中病毒种类比较复杂,类型多样,但不同症状样本感染的病毒类型大体相同,如3个样本(除1H)都感染了常见的甘薯病毒(如 SPVG、SPV2、SPVC、SPFMV、SPBV-B等甘薯常见病毒)[17-19],同时本研究中还鉴定到甘薯中不常见的病毒感染(DOVA、PanVY、ScaMV、PenMV等以及几类细菌噬菌体),这表明甘薯的病原物种类繁多,大田种植需要加紧防护病毒交叉感染,以提高甘薯品质和产量。
通过对病毒类型的分析,笔者推测导致感染性状之间差异的可能为少数几个病毒,如Fj01-03这3个样本都感染了甘薯常见病毒,但性状却并不一致,而3个样本均感染了SPCSV,样本表现的明显症状也不一致,只有Fj03表现出明显的褪绿矮化。因此,推断这些病毒对植株性状的影响可能取决于病毒的感染程度(病毒浓度),张爱红等[20]研究表明,玉米粗缩病株叶片内病毒的浓度与植株的病毒症状呈现正相关,病毒浓度越高植株病情越严重,并且其他研究表明病毒浓度的增加是导致病毒症状和代谢干扰程度加深的直接诱因[21-22],季志强等[22]研究表明,随着病毒浓度的加深,马铃薯脱毒苗的叶片含水量、叶绿素含量、光合和呼吸强度以及代谢干扰程度均下降。因此,高通量测序结合病毒浓度检测,精准的判定病毒感染种类以及感染程度,对大田农作物病害的诊断和防控具有重要意义。
通过对差异 miRNA的分析,笔者发现这些miRNA的差异表达与病毒感染有关,这与其他文献报道的 miRNA参与调控植物抵御病原微生物的结果一致[23]。部分miRNA(家族)的差异性表达可能与症状相关,如miR-156家族和miR-157家族全部成员同时存在差异性表达,而 miR-166d/e/t、miR-169i/o/u、miR-395b/c/d等 miRNA家族的部分成员在不同症状样本之间具有表达差异。miR-156和miR-157家族的靶蛋白多含SPL结构域(包含SBP盒子),据报道miR-156b的过表达会导致植物高度降低、矮化、分蘖数量增加,并且多与植物的生长发育、胁迫应答有关[24-26]。miR-166家族和miR-169家族的靶基因分别编码含有 HD-Zip结构域转录因子和 K Homology结构域转录因子,而这些转录因子通过各种途径参与植物的生长发育、信号传导、形态建成以及应激反应[26-29],表明这些miRNA(家族)的靶基因功能具有多样性。MiR-169家族是植物中最大的miRNA家族,其家族成员与植物的生长发育过程、抗胁迫性明显相关[30];HU 等[31]研究表明,番茄(Solanum lycopersicum)的HD-ZipI型转录因子SIH24能够正向调控抗坏血酸盐的累积,从而增加植物氧化应激耐受性;另外CHEN等[27]研究发现大豆(Glycine max)中59个HD-Zip家族基因对盐胁迫或者冷胁迫具有应激性表达。另外,通过对部分差异 miRNA的保守性分析,本研究所得的差异 miRNA在马铃薯、拟南芥、番茄等作物中的保守性较高,因此,笔者推测这些差异 miRNA通过调控靶基因在甘薯致病性感染和应激过程中发挥重要的作用。
此外,本研究还筛选了新的差异表达miRNA,这些miRNA的靶基因大多为ZFP、WD、Myb、SPL等转录因子家族成员,均参与植物的生长发育、信号传导、离子平衡等,参与并调控植物胁迫、病毒感染、抗逆性等多种生物和非生物胁迫[32-34]。运用GO功能富集分析发现这些差异基因大多与细胞分裂和分化、植株的生长和形态发育相关,另外,这些新的miRNA的靶基因与“植物病原菌互作”相关,这些靶蛋白包括钙离子依赖性激酶、钙结合蛋白,或者NBS-NBS-LRR型抗病蛋白,其中钙结合蛋白参与植物的抗逆性机制[35-37],NBS-NBS-LRR型抗病蛋白直接或者间接的与病原体因子结合后,激活下游信号,诱导植物细胞的程序性死亡并产生快速防御机制[38]。
4 结论
甘薯病毒感染与病理症状以及 miRNA差异表达存在一定相关性,对差异 miRNA靶基因的分析表明病毒感染引起的差异 miRNA靶基因多为转录调控因子,这些转录因子通过多种形式参与调控植物的生长发育和抗胁迫。通过对病毒种类的差异分析,笔者推测导致不同甘薯样本之间症状差异的因素,不仅与病毒种类有关,还应该与病毒的感染程度有关,因此判定病毒感染种类以及感染程度对甘薯病害的诊断和防控具有重要意义。尽管有许多文献表明差异表达的miRNA与植物生长和胁迫等相关,但针对植物的生长发育、胁迫应激反应等复杂机制,miRNA挖掘和验证仍有待进一步研究。
[1]王冰, 宋娜, 孙燕飞, 冯浩, 王晓杰, 康振生. MircoRNA156家族在小麦非生物胁迫中的表达分析. 植物病理学报, 2013, 43(2):201-204.WANG B, SONG N, SUN Y F, FENG H, WANG X J, KANG Z S.Expression analysis of wheat mircoRNA156 family in response to abiotic stress.Acta Phytopathologica Sinica, 2013, 43(2): 201-204. (in Chinese)
[2]冯静弦, 汪启明, 胡琪, 饶力群. 拟南芥中热胁迫相关 microRNA的差异表达. 湖南农业科学, 2012(3): 10-13.FENG J X, WANG Q M, HU Q, RAO L Q. Differential expression of heat stress related microRNA inArabidopsis thaliana.Hunan Agricultural Science, 2012(3): 10-13. (in Chinese)
[3]俞正, 庄然. 病毒感染 miRNA的免疫调控机制研究进展. 细胞与分子免疫学杂志, 2016, 32(2): 261-264.YU Z, ZHUANG R. Advances in immunoregulation mechanism of virus infection associated miRNA.Chinese Journal of Cellular and Molecular Immunology, 2016, 32(2): 261-264. (in Chinese)
[4]王维, 张玉娟, 陈洁, 刘聚波, 夏民旋, 沈法富. 植物逆境胁迫相关miRNA研究进展. 生物技术通报, 2015, 31(1): 1-10.WANG W, ZHANG Y J, CHEN J, LIU J B, XIA M X, SHEN F F.Research progress of microRNAs in plant stresses responses.Biotechnology Bulletin, 2015, 31(1): 1-10. (in Chinese)
[5]冉莉萍, 孔月琴, 方婷婷, 王幼平. 逆境胁迫下植物表观遗传机制的研究进展. 生物技术通报, 2014(8): 8-15.RAN L P, KONG Y Q, FANG T T, WANG Y P. Research progress of stress-induced epigenetic regulation mechanism in plant.Biotechnology Bulletin, 2014(8): 8-15. (in Chinese)
[6]ZHOU Q L, ZHANG Y J, HUANG Y D, LI Y M, HE S L, YANG H K,LIU L S, WANG M. Effects of SPVD on sweet potato yield formation.Agricultural Science & Technology, 2014, 15(9): 1446-1449.
[7]包改丽, 左瑞娟, 饶维力, LI Ru-Hui, 李凡. 云南甘薯病毒的检测及主要病毒的多样性分析. 微生物学通报, 2013, 40(2): 236-248.BAO G L, ZUO R J, RAO W L, LI R H, LI F. Detection of sweet potato viruses in Yunnan and genetic diversity analysis of the common viruses.Microbiology China, 2013, 40(2): 236-248. (in Chinese)
[8]刘辛. 番茄 microRNA及其靶基因对几种病毒侵染的反应[D]. 杭州: 浙江理工大学, 2008.LIU X. Response of tomato microRNA and their target mRNAs to virus infection[D]. Hangzhou: Zhejiang Sci-Tech University, 2008. (in Chinese)
[9]陈莎. 深度测序鉴定玉米病毒及感病玉米组织中小 RNA分析[D].杭州: 浙江大学, 2015.CHEN S. Identification of plant viruses from maize by deep sequencing and analysis of small RNA in virus infected maize[D].Hangzhou: Zhejiang University, 2015. (in Chinese)
[10]王园龙, 曹林, 邓敏捷, 马一平, 赵振利, 牛苏燕, 王晓丹, 范国强.利用高通量测序分析白花泡桐盐胁迫相关 microRNAs. 河南农业大学学报, 2015, 49(4): 461-467.WANG Y L, CAO L, DENG M J, MA Y P, ZHAO Z L, NIU S Y,WANG X D, FAN G Q. Analysis of salt stress-responsive microRNA inPaulownia fortuneiby high-throughout sequencing.Journal of Henan Agricultural University, 2015, 49(4): 461-467. (in Chinese)
[11]陈洁. 重金属铅胁迫下玉米苗期根系 miRNA的鉴定及相关miRNA的表达分析[D]. 雅安: 四川农业大学, 2010.CHEN J. Identification and expression analysis of miRNAs in immature maize root under the stress of heavy metal Pb[D]. Yaan:Sichuan Agricultural University, 2010. (in Chinese)
[12]马骢毓. 马铃薯抗旱相关 microRNA 的鉴定及分析[D]. 兰州: 甘肃农业大学, 2012.MA C Y. Identification and analysis of microRNA related to drought resistance of potato[D]. Lanzhou: Gansu Agricultural University, 2012.(in Chinese)
[13]詹琳琳. 烟草抗马铃薯Y病毒miRNA的筛选及相关miRNA的功能分析[D]. 杭州: 浙江农林大学, 2015.ZHAN L L. Screening for miRNA of tobacco resistance toPotatovirus Yand function analysis of relevant miRNA[D]. Hangzhou:Zhejiang A & F University, 2015. (in Chinese)
[14]乔奇, 张振臣, 张德胜, 秦艳红, 田雨婷, 王永江. 中国甘薯病毒种类的血清学和分子检测. 植物病理学报, 2012, 42(1): 10-16.QIAO Q, ZHANG Z C, ZHANG D S, QIN Y H, TIAN Y T, WANG Y J. Serological and molecular detection of viruses infecting sweet potato in China.Acta Phytopathologica Sinica, 2012, 42(1): 10-16. (in Chinese)
[15]MEYERS B C, AXTELL M J, BARTEL B, BARTEL D P,BAULCOMBE D, BOWMAN J L, CAO X, CARRINGTON J C,CHEN X, GREEN P J, GRIFFITHS-JONES S, JACOBSEN SE,MALLORY A C, MARTIENSSEN R A, POETHIG R S, QI Y,VAUCHERET H, VOINNET O, WATANABE Y, WEIGEL D, ZHU J K. Criteria for annotation of plant MicroRNAs.The Plant Cell, 2008,20(12): 3186-3190.
[16]LAVORGNA G, GUFFANTI A, BORSANI G, BALLABIO A,BONCINELLI E. TargetFinder: searching annotated sequence databases for target genes of transcription factors.Bioinformatics,1999, 15(2): 172-173.
[17]黄利利, BINHDAN P, 何芳练, 刘奕君, 刘义明, 陈保善, 廖咏梅.广西甘薯病毒病的病原病毒种类检测. 基因组学与应用生物学,2016, 35(5): 1213-1218.HUANG L L, BINHDAN P, HE F L, LIU Y J, LIU Y M, CHEN B S,LIAO Y M. The pathogenic virus species detection of sweet potato viral diseases in Guangxi.Genomics and Applied Biology, 2016, 35(5):1213-1218. (in Chinese)
[18]姜珊珊, 谢礼, 吴斌, 辛相启, 陈剑平, 赵玖华. 山东甘薯主要病毒的鉴定及多样性分析. 植物保护学报, 2017, 44(1): 93-102.JIANG S S, XIE L, WU B, XIN X Q, CHEN J P, ZHAO J H.Identification and genetic diversity analysis on sweet potato viruses in Shandong Province.Journal of Plant Protection, 2017, 44(1): 93-102.(in Chinese)
[19]彭小琴, 王浩然, 张俊, 张玮华, 郭灵芳, 方守国, 章松柏. 湖北甘薯病毒病的检测与鉴定. 中国植保导刊, 2017, 37(8): 20-23.PENG X Q, WANG H R, ZHANG J, ZHANG W H, GUO L F, FANG S G, ZHANG S B. Detection and identification of sweet potato virus diseases in Hubei.China Plant Protection, 2017, 37(8): 20-23. (in Chinese)
[20]张爱红, 苗洪芹, 朱宝成, 路银贵, 陈丹, 邸垫平. 水稻黑条矮缩病毒在不同抗性玉米自交系叶片内的积累研究. 河北农业大学学报, 2007, 30(2): 79-82.ZHANG A H, MIAO H Q, ZHU B C, LU Y G, CHEN D, DI D P.Studies on the concentration of RBSDV in corn inbred lines with different resistance to the disease.Journal of Agricultural University of Hebei, 2007, 30(2): 79-82. (in Chinese)
[21]刘起丽. 共生丛植菌根减轻番茄黄化卷叶撒丁岛病毒症状和降低病毒浓度. 农业生物技术学报, 2014, 22(2): 149.LIU Q L. The arbuscular mycorrhizal symbiosis attenuates symptom severity and reduces virus concentration in TYLCSV.Journal of Agricultural Biotechnology, 2014, 22(2): 149. (in Chinese)
[22]季志强, 杨青林, 桑利民, 盖颜欣. 脱毒马铃薯的增产机理和增产原因分析. 种子世界, 2014(5): 23.JI Z Q, YANG Q L, SANG L M, GAI Y X. Analysis of the mechanism and cause of increased production of detoxification potato plant.SeedWorld, 2014(5): 23. (in Chinese)
[23]牟慧芳, 齐雯雯, 刘艳玲, 李毅, 吴莹. microRNA参与调控植物抵御病原微生物的研究进展. 现代农业科技, 2016(23): 144-147.MU H F, QI W W, LIU Y L, LI Y, WU Y. Research advances of microRNAs in plant resistance to pathogens.Modern Agricultural Sciences and Technology, 2016(23): 144-147. (in Chinese)
[24]王晟. 水稻小RNA的基因组分布和分子进化研究[D]. 杭州: 浙江大学, 2008.WANG S. Genome-wide profiling and evolution of small RNAs in rice[D].Hangzhou: Zhejiang University, 2008. (in Chinese)
[25]CHUCK G, CIGAN A M, SAETEURN K, HAKE S. The heterochronic maize mutantCorngrass1results from overexpression of a tandem microRNA.Nature Genetics, 2007, 39(4): 544-549.
[26]雷凯健, 刘浩. 植物调控枢纽miR156及其靶基因SPL家族研究进展. 生命的化学, 2016, 36(1): 13-20.LEI K J, LIU H. Research advances in plant regulatory hub miRNA156 and target SPL family.Chemistry of Life, 2016, 36(1):13-20. (in Chinese)
[27]CHEN X, CHEN Z, ZHAO H L, ZHAO Y, CHENG B J, XIANG Y.Genome-wide analysis of soybean HD-Zip gene family and expression profiling under salinity and drought treatments.PLoS ONE, 2014, 9(2):e87156.
[28]GONZÁLEZ-GRANDÍO E, PAJORO A, FRANCO-ZORRILLA J M,TARANCÓN C, IMMINK R G, CUBAS P. Abscisic acid signaling is controlled by a BRANCHED1/HD-ZIP I cascade inArabidopsis axillary buds.Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(2): E245-E254.
[29]王宏, 李刚波, 张大勇, 蔺经, 盛宝龙, 韩金龙, 常有宏. 植物HD-Zip转录因子的生物学功能. 遗传, 2013, 35(10): 1179-1188.WANG H, LI G B, ZHANG D Y, LIN J, SHENG B L, HAN J L,CHANG Y H. Biological functions of HD-Zip transcription factors.Hereditas, 2013, 35(10): 1179-1188. (in Chinese)
[30]董云, 王毅, 靳丰蔚, 孙万仓, 刘自刚, 方彦, 徐妙云, 王磊. 油菜Bna-miR169d基因的分离与过表达初步分析. 西北农业学报, 2016,25(12): 1809-1815.DONG Y, WANG Y, JING F W, SUN W C, LIU Z G, FANG Y, XU M Y, WANG L. Isolation and preliminary overexpression ofBna-miR169dgene inoilseed rape.Acta Agriculturae Boreali-occidentalis Sinica,2016, 25(12): 1809-1815. (in Chinese)
[31]HU T, YE J, TAO P, LI H, ZHANG J, ZHANG Y, YE Z. The tomato HD-Zip I transcription factor SlHZ24 modulates ascorbate accumulation through positive regulation of the D-mannose/L-galactose pathway.ThePlant Journal, 2016, 85(1): 16-29.
[32]许振华, 谢传晓. 植物 microRNA 与逆境响应研究进展. 遗传,2010, 32(10): 1018-1030.XU Z H, XIE C X. Advances in plant microRNA and stresses response.Hereditas, 2010, 32(10): 1018-1030. (in Chinese)
[33]王炳南. 小麦SPL基因的比较分析和功能研究[D]. 北京: 中国农业科学院, 2015.WANG B N. Comparative analysis and functional study ofSQUAMOSA promoter binding protein-like(SPL) genes in wheat[D].Beijing: Chinese Academy of Agricultural Sciences, 2015. (in Chinese)
[34]伍翀, 杨兆春, 秦双双, 袁媛, 黄璐琦, 陈平. 植物MYB转录因子研究进展//中华中医药学会中药鉴定学术会议暨中药材鉴定方法和技术研讨会, 2010.WU C, YANG Z C, QIN S S, YUAN Y, HUANG L Q, CHEN P.Advances in plant MYB transcription factors//China ChineseMedicine Institute Academic Conference on Chinese Medicine Identification, the Seminar of Chinese Medicine Identification Method and Technic, 2010. (in Chinese)
[35]REN L, SUN J, CHEN S, GAO J, DONG B, LIU Y, XIA X, WANG Y,LIAO Y, TENG N, FANG W, GUAN Z, CHEN F, JIANG J. A transcriptomic analysis ofChrysanthemum nankingenseprovides insights into the basis of low temperature tolerance.BMC Genomics,2014, 15(1): 844.
[36]郭彤. 低温胁迫下菊花叶片转录组比较分析[D]. 郑州: 河南农业大学, 2016.GUO T. Comparative transcriptome analysis of the regulation of responding to low temperature inDendranthema morifoliumby RNA-seq[D]. Zhengzhou: Henan Agricultural University, 2016. (in Chinese)
[37]刘维. 番茄钙调蛋白和类钙调蛋白的抗病调控功能分析[D]. 杭州:浙江大学, 2015.LIU W. Functional analyses of tomato calmodulin and calmodulin-like genes in disease resistance[D]. Hangzhou: Zhejiang University, 2015.(in Chinese)
[38]RADWAN O, GANDHI S, HEESACKER A, WHITAKER B,TAYLOR C, PLOCIK A, KESSELI R, KOZIK A, MICHELMORE R W, KNAPP S J. Genetic diversity and genomic distribution of homologs encoding NBS-LRR disease resistance proteins in sunflower.Molecular Genetics and Genomics, 2008, 280(2): 111-125.

