荞麦mate的克隆及表达分析
常雪玲,张宗文,李艳琴,高佳
(1山西大学生物技术研究所,太原030006;2中国农业科学院作物科学研究所,北京100081;3国际生物多样性中心中国办事处,北京100081)
0 引言
【研究意义】转运蛋白(transport protein)是膜蛋白的一大类,介导生物膜内外的化学物质以及信号交换。多药物和有毒化合物外排家族(multidrug and toxic compound extrusion family,MATE),属于次级转运蛋白家族,是生物中5类解毒输出转运蛋白家族之一[1]。近年来,越来越多的遗传学、生物化学和分子生物学研究表明 MATE转运蛋白参与植物类黄酮运输。原花青素(proanthocyanidin,PA)是植物酚类物质中普遍存在的组分之一,在植物界广泛存在,呈现出多样的生物和生物化学活性[2-6],并对人体健康有潜在的有益作用[7-11]。荞麦属于蓼科荞麦属植物,是一种具有很高食用价值和医疗保健作用的经济作物,也是一种极具开发潜力的功能性食品原料。荞麦mate的研究为解析 MATE转运蛋白家族在荞麦次生代谢产物运输和逆境胁迫中的作用奠定基础。【前人研究进展】MATE转运蛋白首先在副溶血性弧菌和大肠杆菌中被发现,功能为多药物排出,但由于与其他转运蛋白缺乏序列同源性而被认定为新的转运蛋白家族并命名为MATE家族[12-13]。随着研究深入,研究学者发现MATE家族成员分布广泛,遍布古细菌、细菌、酵母、动物和植物,且家族直系同源成员较多,如研究发现拟南芥中至少有56个MATE家族基因[14],亚洲棉中有 34个,雷蒙德氏棉中有42个[15]。现阶段对于 MATE家族大多数成员的功能知之甚少,已研究得到的植物中 MATE型转运蛋白的功能涉及异生物外排,次生代谢物包括生物碱和类黄酮的积累、铁(Fe3+)易位、铝(Al3+)解毒和植物激素信号传导等[16]。拟南芥tt12编码一种类黄酮循环必需的、属于MATE家族的多药次生类转运蛋白,其生物学功能是将胞浆内合成的花青素、原花青素等多酚类色素的单体物转运到液泡等亚细胞器官中,然后花青素在酸性条件下显色或原花青素进一步聚合后形成有色色素[17];参与Al3+解毒的MATE转运蛋白首先在高粱(Sorghum bicolor,SbMATE)和大麦(Hordeum vulgare,HvAACT1)中被鉴定;它们的基因表达水平与从根部释放的柠檬酸的量以及在Al3+存在下的根伸长率相关,表明这些 MATE转运蛋白的高表达对于Al3+耐受是必需的[18-20]。拟南芥Atfrd3编码MATE型转运蛋白负责将柠檬酸盐(Fe的螯合剂)转运到根木质部以高效地转运铁[21]。【本研究切入点】荞麦种子转录组测序中[22],发现mate注释的unigene共有54个。但MATE在荞麦中的研究报道较少,只有 LEI等[23]在荞麦中发现2个mate——FeMATE1和FeMATE2,并通过功能分析得到两者与荞麦中 Al离子胁迫相关。【拟解决的关键问题】本研究拟通过RACE的方法从荞麦中克隆2条mate全长,并对其功能进行验证,以期为筛选高营养成分含量和抗逆性较强的种质资源提供依据。
1 材料与方法
1.1 植物材料
试验所用材料为普通荞麦(FagopyrumesculentumMoench),来自国家中期种质库(No.000677),于2016年9月栽培于中国农业科学院作物科学研究所温室中。采集成株期的根、茎、叶、花苞和花及开花后7、14、21和28 d的籽粒经液氮速冻后于-80℃保存,用于总RNA的提取。
1.2 总RNA的提取和cDNA的合成
取液氮中保存的材料约 100 mg,采用 RNeasy Plant Mini Ki(tQIAGEN,USA)提取植物样品总RNA。参照QuantiTect Reverse Transcription Kit(QIAGEN,USA)说明书,以纯化好的2 μg RNA为模板逆转录合成cDNA,保存于-20℃备用。
1.3 荞麦mate全长cDNA克隆
用 BLAST在线网上工具对荞麦转录组测序已获得的部分mate序列与其他物种已发表的基因序列进行比对,选取保守区域设计引物扩增合成cDNA中间片段,引物序列信息列于表1,扩增产物经电泳回收纯化后连接pMD19-T载体并转化大肠杆菌DH5α感受态细胞,经蓝白斑筛选重组子,挑取阳性克隆送至生工(上海生物工程股份有限公司)测序,并在 NCBI数据库中比对分析测序结果。
以获得的cDNA中间片段为模板,设计荞麦mate的RACE用特异引物(表1)。根据SMARTer RACE 5′/3′ Kit(TaKaRa, Dalian)说明书进行巢式 PCR 扩增。利用 DNAMAN软件将mate的 5′端序列和 3′端序列以及中间cDNA序列进行拼接获得荞麦mate全长cDNA序列。参照拼接所得cDNA序列设计引物(表1),以cDNA为模板扩增出mate全长cDNA序列。

表1 荞麦mate克隆所用引物序列信息Table 1 Sequence information of primers used for cloning buckwheat mate gene
1.4 荞麦mate生物信息学分析
利用DNAMAN软件搜索并翻译mate的ORF区域,得到的氨基酸序列与已发表的其他物种基因编码的氨基酸序列进行同源分析。利用 MEGA软件中的NJ法构建荞麦MATE蛋白与其他物种MATE的系统发育树。通过ExPASy中的protparam对MATE蛋白的分子量及等电点进行预测;利用ProtScale对该蛋白的氨基酸序列进行疏水性分析;利用 TMHMMv对MATE蛋白的跨膜区域进行预测;利用SOPMA预测MATE蛋白的二级结构。
1.5 qRT-PCR分析
依据Fett12cDNA序列设计引物 FeTT12-RTF/FeTT12-RT-R(表1),以荞麦根、茎、叶、花和花苞,开花后7、14、21和28 d的种子材料cDNA为模板进行PCR扩增,以检测各部分Fett12的表达水平,以H3为内参基因,每个样品重复3次。
1.6 荞麦原花青素(PAs)含量的测定
参照吴楠等[24]DMACA-HCl的方法测定荞麦花苞、花及不同发育阶段种子中可溶的和不可溶的PA含量。取组织冻干样品100 mg,加入10 mL甲醇,超声波萃取1 h,其间每隔20 min旋涡震荡1 min,4 500 r/min离心10 min,上清即为可溶的PAs;用10 mL含有1% HCl的甲醇重悬沉淀,60℃水浴1 h;水浴后,4℃ 4 500 r/min离心10 min,上清即为不溶性的PA。采用分光光度法对原花青素含量进行测定,以儿茶素标品为对照,作标准曲线。分别取200µL含有原花青素的提取液和2.8 mL的反应液(含有0.1% DMACA和5% HCl的甲醇溶液)加入5 mL离心管中,室温下反应15 min,然后测定643 nm的吸光度,原花青素的含量参照儿茶素的标准曲线进行计算。
2 结果
2.1 荞麦mate克隆
利用RACE克隆的方法,从荞麦中获得2条mate全长cDNA序列,分别命名为Fett12和Femate3。核苷酸序列分析表明,Fett12的全长cDNA为1 707 bp,包含69 bp的5'非翻译区,159 bp的3'非翻译区和1 479 bp的开放阅读框;Femate3全长cDNA为2 163 bp,包含1 548 bp的开放阅读框、387 bp的5'非翻译区和228 bp的3'非翻译区。通过ExPASy中的protparam在线分析得到Fett12编码一个含有492个氨基酸残基的假定蛋白,其分子量为 53.81 kD,等电点为 6.75;Femate3编码一个含有516个氨基酸残基的假定蛋白,分子量为56.12 kD,等电点为6.52。进一步对其疏水性,跨膜区域及二级结构分析预测(图1),Fett12编码的假定蛋白二级结构主要以 α螺旋为主,占44.51%,含有10个跨膜结构域;Femate3编码的假定蛋白二级结构同样以α螺旋为主,占54.84%,含有9个跨膜结构域。
2.2 荞麦FeTT12和FeMATE3的系统进化与同源分析
目前,研究发现植物MATE型转运蛋白的转运底物有烟碱、原花青素、花青素、柠檬酸盐、脱落酸等,并以此发挥不同的功能[1]。本研究选取已发表的其他物种的原花青素MATE转运蛋白、花青素MATE转运蛋白、柠檬酸盐MATE转运蛋白的氨基酸序列与克隆的2条荞麦MATE氨基酸序列构建系统发育树(图2)。从图中可以看出,选取的氨基酸序列按其功能被分成了3组,FeTT12被分到了第一组,暗示其在荞麦中可能参与原花青素的转运与累积。进一步将 FeTT12氨基酸序列与其他植物TT12编码的氨基酸序列进行比对(图3)和同源性分析(表2),得到荞麦FeTT12与其他物种的TT12蛋白的氨基酸序列具有极高的同源性,其中与桑属TT12蛋白同源性最高,为 77.3%;与拟南芥 TT12蛋白同源性最低,为41.5%。

图2 FeTT12和FeMATE3系统进化树分析Fig. 2 FeTT12 and FeMATE3 phylogenetic trees
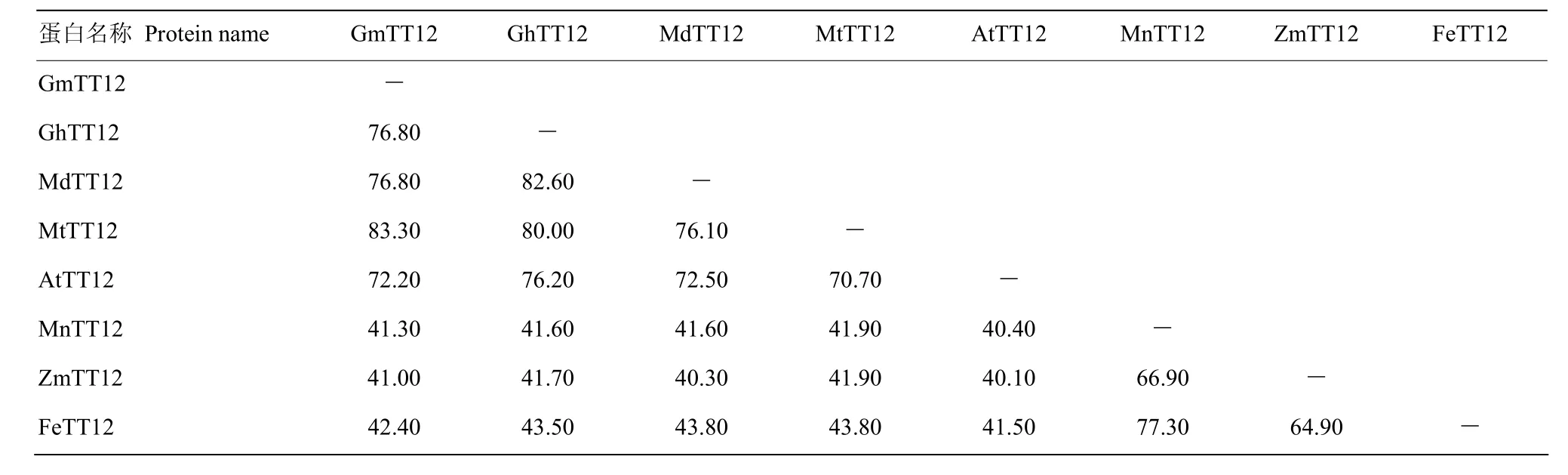
表2 FeTT12与其他物种TT12之间的同源分析Table 2 The homology analysis of FeTT12 with TT12 from other species (%)

图3 荞麦Fett12与已公开其他植物tt12编码的氨基酸序列比对Fig. 3 Amino acid sequence alignment of Fett12 gene of buckwheat with the tt12 gene of other plants
FeMATE 3被分到了第三组,暗示其功能可能与荞麦的离子胁迫相关。通过与其他物种中转运柠檬酸盐的MATE型蛋白氨基酸多序列比对(图4)及同源分析(表3),发现其与Al离子胁迫相关的荞麦MATE蛋白FeMATE2的一致性达到96.33%,由此可以说明两者为同一基因序列,但可能由于选用材料的不同,导致存在个别氨基酸残基差异(红色标注),主要集中在第二个跨膜区与第三个跨膜区之间和羧基端。

图4 FeMATE3氨基酸序列比对图Fig. 4 Multiple alignment of FeMATE3

表3 FeMATE3同源分析表Table 3 The homology analysis of FeMATE3 (%)
2.3 荞麦Fett12在不同组织中的表达模式
为进一步分析FeTT12在荞麦各个组织中相对表达量,以荞麦的根、茎、叶、花苞、花和种子为材料进行qRT-PCR分析。结果(图5)表明,Ftt12在荞麦的各个组织中均有表达,其中在叶中的表达量最高。为研究Fett12在荞麦种子不同发育阶段种子中的表达模式,同时也测定了荞麦开花后7、14、21和28 d种子中Fett12的相对表达量,结果表明,伴随着荞麦种子的不断发育成熟,Fett12的相对表达量逐渐增高,在成熟期(28DPA)种子中的表达量最高。
2.4 荞麦不同组织中PA的含量测定
基于同源分析得到FeTT12可能与原花青素的转运和累积相关,进一步检测荞麦不同组织及不同发育阶段种子中可溶和不可溶的PA的含量。相比其他组织,PA在荞麦花中的含量明显较高;在不同发育阶段种子中的含量模式为随着种子的不断成熟,PA的含量逐渐降低;其中可溶的 PA的含量在从14DPA到21DPA阶段的种子材料中下降明显,21DPA到28DPA阶段的种子材料中变化不明显。

图5 Fett12在荞麦不同组织中的相对表达量Fig. 5 Relative expression of Fett12 in different tissues of buckwheat
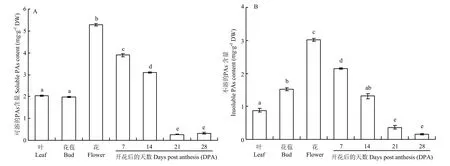
图6 荞麦不同组织中可溶和不可溶的PA的含量测定Fig. 6 Determination of PAs (soluble and insoluble) in different groups of buckwheat
3 讨论
3.1 荞麦mate序列特征
研究发现,所有的MATE蛋白没有明显的共有保守序列,但大多数成员都具有大约40%的序列相似性[25]。在结构上,由 400—550个氨基酸残基组成,具有12个跨膜螺旋。在荞麦中克隆到的2条MATE蛋白,分别由492和516个氨基酸残基组成;与其余已发表物种的 MATE蛋白的序列相似性都达到 40%及以上,编码的假定蛋白均为疏水性极强的膜蛋白。通过进一步构建系统发育树及同源分析,发现 2条mate被分到了不同的组里,其中一条mate为拟南芥tt12在荞麦中的同源基因,并因此命名为Fett12;Femate3与其他物种中转运底物为柠檬酸盐的mate聚集到一起,并与LEI等[23]在荞麦中发现的Al离子胁迫相关的Femate2的序列相似性达到96%,只有个别氨基酸残基存在差异,主要集中在第二个跨膜区与第三个跨膜区之间,同时这一区段也是不同物种这一同源基因进行氨基酸序列比对时差异最多的区段。结合跨膜区预测结果分析获得,其差异主要存在于胞内区域和跨膜区域且跨膜区域的氨基酸差异之间的极性一致。
3.2 FeTT12参与荞麦中原花青素的累积
荞麦是一种高黄酮含量的作物,有着与其他植物物种相似的类黄酮生物合成通路。原花青素作为合成通路中的一员,其在荞麦中的含量,合成与转运等被广泛的研究。PA前体的聚合及随后转化为棕色氧化产物发生在液泡中,PA和花青素也积累在其中[26]。但花青素还原酶(anthocyanidin reductase,ANR)是一种可溶性胞质酶,因此,用于PA生物合成的表儿茶素或其衍生物可能具有外源性,需要一个机制将其从细胞质转运至液泡中。拟南芥tt12编码一个定位于液泡膜的 MATE型转运蛋白,tt12突变体的显微分析显示原花青素在拟南芥内皮细胞空泡中的积累强烈减少[17]。进一步研究表明拟南芥TT12在体内功能性运输表儿茶素 3′-O-葡萄糖苷作为原花青素合成的前体[27]。本次研究中克隆得到的Fett12为拟南芥tt12在荞麦中的同源基因;同时,与棉花[24]、苹果[28]、桑[29]、葡萄[30]等物种中的tt12同源基因有较高的序列相似度,因此 FeTT12有可能在荞麦中发挥转运原花青素前体的功能。随后,研究了Fett12在荞麦不同组织中的表达差异和PA的含量之间的相关性。基因表达模式研究表明其具有组织表达特异性,且在叶中的表达量最高;在PA的含量测定中,发现作为次级代谢产物PA的分布具有明显的组织器官差异,且在荞麦花中的含量明显较高,这也与 ZIELIŃSKA等[31]通过测定荞麦茎、叶、花、未成熟与成熟种子的总黄酮及芦丁含量,得到其在荞麦花中的含量最高的结果一致。因之前很多研究表明,PA主要积累在植物种子中[25],因此我们也测定了Fett12在荞麦不同成熟阶段种子中的表达量及 PA的含量变化。随着种子的不断成熟Fett12的表达量逐渐增高,PA的含量逐渐降低,表明两者之间存在一定关联。在可溶的PA的含量测定中,其在14DPA到21DPA阶段的种子材料中下降明显,可能与此阶段合成结构复杂的原花青素进而转变为不溶的PA相关。
3.3 FeMATE3与荞麦的Al离子胁迫相关
与其他物种如小麦相比,荞麦对Al毒害具有较高的耐受性;此外,它还在叶子中累积高Al而不会表现出毒性症状[32-34]。植物 MATE的功能研究中,发现MATE型转运蛋白能通过转运柠檬酸盐来解除重金属对植物的毒害。此次在荞麦中克隆到的Femate3在系统进化分析中被归类到柠檬酸盐 MATE型转运蛋白,表明其可能在荞麦中Fe异位或Al解毒发挥重要作用。参考LEI等[23]最近发表的荞麦中与AL胁迫相关的2条mate,通过多序列比对,发现FeMATE3与他发表的FeMATE2的氨基酸一致性达到96%,进而可以一定程度说明FeMATE3在荞麦Al解毒方面发挥重要作用。
4 结论
从荞麦中成功克隆获得 2条mate——Fett12和Femate3,且Fett12与荞麦中原花青素的转运和累积相关。
[1]OMOTE H, HIASA M, MATSUMOTO T, OTSUKA M,MORIYAMA Y. The MATE proteins as fundamental transporters of metabolic and xenobiotic organic cations.Trends in Pharmacological Sciences, 2006, 27(11): 587-593.
[2]HE F, PAN Q H, SHI Y, DUAN C Q. Biosynthesis and genetic regulation of proanthocyanidins in plants.Molecules, 2008, 13(10):2674-2703.
[3]KOES R, VERWEIJ W, QUATTROCCHIO F. Flavonoids: A colorful model for the regulation and evolution of biochemical pathways.Trends in Plant Science, 2005, 10(5): 236-242.
[4]FEENY P. Seasonal changes in Oak leaf tannins and nutrients as a cause of spring feeding by winter moth caterpillars.Ecology, 1970,51(4): 565-581.
[5]BAIS H P, VEPACHEDU R, GILROY S, CALLAWAY R M,VIVANCO J M. Allelopathy and exotic plant invasion: From molecules and genes to species interactions.Science, 2003, 301(5638):1377-1380.
[6]RIOR R L, GU L. Occurrence and biological significant of proanthocyanidins in the american diet.Phytochemistry, 2005, 66(18):2264-2280.
[7]ZHAO M, YANG B, WANG J, LIU Y, YU L, JIANG Y.Immunomodulatory and anticancer activities of flavonoids extracted from litchi (Litchi chinensisSonn) pericarp.International Immunopharmacology, 2007, 7(2): 162-166.
[8]RAO L J, YADA H, ONO H, OHNISHIKAMEYAMA M, YOSHIDA M. Occurrence of antioxidant and radical scavenging proanthocyanidins from the Indian minor spice nagkesar (Mammea longifoliaplanch and triana syn).Bioorganic & Medicinal Chemistry, 2004, 12(1): 31-36.
[9]SUBARNAS A, WAGNER H. Analgesic and anti-inflammatory activity of the proanthocyanidin shellegueain A from Polypodium feei METT.Phytomedicine International Journal of Phytotherapy &Phytopharmacology, 2000, 7(5): 401-405.
[10]Sato M, Maulik G, Ray P S, Bagchi D, Das D K. Cardioprotective effects of grape seed proanthocyanidin against ischemic reperfusion injury.Journal of Molecular & Cellular Cardiology, 1999, 31(6):1289-1297.
[11]SANO T, ODA E, YAMASHITA T, NAEMURA A, IJIRI Y,YAMAKOSHI J, YAMAMOTO J. Anti-thrombotic effect of proanthocyanidin, a purified ingredient of grape seed.Thrombosis Research, 2005, 115(1/2): 115-121.
[12]BROWN M H, PAULSEN I T, SKURRAY R A. The multidrug efflux protein NorM is a prototype of a new family of transporters.Molecular Microbiology, 1999, 31(1): 394-395.
[13]MORITA M, SHITAN N, SAWADA K, VAN MONTAGU M C E,INZE D, RISCHER H, GOOSSENS A, OKSMAN-CALDENTEY K M, MORIYAMA Y, YAZAKI K. NorM, a Putative Multidrug Efflux Protein, of Vibrio parahaemolyticus and Its Homolog in Escherichia coli.Antimicrobial Agents & Chemotherapy, 1998, 42(7): 1778-1782.
[14]LI L, HE Z, PANDEY G K, TSUCHIYA T, LUANET S. Functional cloning and characterization of a plant efflux carrier for multidrug and heavy metal detoxification.Journal of Biological Chemistry, 2002,277(7): 5360-5368.
[15]沈知临, 许磊, 陈文, 吴楠, 蔡永萍, 林毅, 高俊山. 亚洲棉和雷蒙德氏棉MATE基因家族生物信息学及其同源基因在陆地棉中的表达分析. 棉花学报, 2016, 562(3): 215-226.SHEN Z L, XU L, CHEN W, WU N, CAI Y P, LIN Y, GAO J S.Bioinformatic analysis of the multidrug and toxic compound extrusion gene family inGossypium arboreumandGossypium raimondii, and expression of orthologs inGossypium hirsutum.Cotton Science,2016,562(3): 215-226. (in Chinese)
[16]TAKANASHI K, SHITAN N, YAZAKI K. The multidrug and toxic compound extrusion (MATE) family in plants.Plant Tissue Culture Letters, 2014, 31(5): 417-430.
[17]MARINOVA K, POURCEL L, WEDER B, SCHWARZ M, BARRON D, ROUTABOUL J M, DEBEAUJON I, KLEIN M. TheArabidopsisMATE transporter TT12 acts as a vacuolar flavonoid/H+-antiporter active in proanthocyanidin-accumulating cells of the seed coat.The Plant Cell, 2007, 19(6): 2023-2038.
[18]SIVAGURU M, LIU J, KOCHIAN L V. Targeted expression of SbMATE in the root distal transition zone is responsible for sorghum aluminum resistance.Plant Journal for Cell & Molecular Biology,2013, 76(2): 297-307.
[19]MAGALHAES J V, LIU J, GUIMARÃES C T, LANA U G, ALVES V M, WANG Y H, SCHAFFERT R E, HOEKENGA O A,PIÑEROS M A, SHAFF J E, KLEIN P E, CARNEIRO N P, COELHO C M,TRICK H N, KOCHIAN L V. A gene in the multidrug and toxic compound extrusion (MATE) family confers aluminum tolerance in sorghum.Nature Genetics, 2007, 39(9): 1156-1161.
[20]FURUKAWA J, YAMAJI N, WANG H, MITANI N, MURATA Y,SATO K, KATSUHARA M, TAKEDA K, MA J F. An aluminumactivated citrate transporter in barley.Plant & Cell Physiology, 2007,48(8): 1081-1091.
[21]DURRETT T P, GASSMANN W, ROGERS E E. The FRD3-mediated efflux of citrate into the root vasculature is necessary for efficient iron translocation.Plant Physiology, 2007, 144(1): 197-205.
[22]Gao J, Wang T T, Liu M X, Liu J, Zhang Z W. Transcriptome analysis of filling stage seeds among three buckwheat species with emphasis on rutin accumulation.Plos One, 2017, 12(12):e0189672.
[23]LEI G J, YOKOSHO K, YAMAJI N, MA J F. Two MATE transporters with different subcellular localization are involved in Al tolerance in buckwheat.Plant & Cell Physiology, 2017, 58(12): 2179-2189.
[24]GAO J S, WU N, SHEN Z L, LV K, QIAN S H, GUO N, SUN X,CAI Y P, LIN Y. Molecular cloning, expression analysis and subcellular localization of a Transparent Testa 12 ortholog in brown cotton (Gossypium hirsutumL.).Gene, 2016, 576(2): 763-769.
[25]WANG L, BEI X, GAO J, LI Y, HU Y. The similar and different evolutionary trends of MATE family occurred between rice andArabidopsis thaliana.BMC Plant Biology, 2016, 16(1): 207-225.
[26]LEPINIEC L, DEBEAUJON I, ROUTABOUL J M, BAUDRY A,POURCEL L, NESI N, CABOCHE M. Genetics and biochemistry of seed flavonoids.Annual Review of Plant Biology, 2006, 57(1): 405-430.
[27]ZHAO J, DIXON R A. MATE transporters facilitate vacuolar uptake of epicatechin 3'-O-glucoside for proanthocyanidin biosynthesis inMedicago truncatulaandArabidopsis.The Plant Cell, 2009, 21(8):2323-2340.
[28]FRANK S, KECK M, SAGASSER M, NIEHAUS K, WEISSHAAR B, STRACKE R. Two differentially expressed MATE factor genes from apple complement theArabidopsistransparent testa12 mutant.Plant Biology, 2011, 13(1): 42-50.
[29]HE N, ZHANG C, QI X, ZHAO S, TAO Y, YANG G, LEE T H,WANG X, CAI Q, LI D, LU M, LIAO S, LUO G, HE R, TAN X, XU Y, LI T, ZHAO A, JIA L, FU Q, ZENG Q, GAO C, MA B, LIANG J,WANG X, SHANG J, SONG P, WU H, FAN L, WANG Q, SHUAI Q,J ZHU J, WEI C, KEYAN ZS, JIN D, WANG J, LIU T, YU M, TANG C, WANG Z, DAI F, CHEN J, Y LIU Y, ZHAO S, LIN T, ZHANG S,J WANG J, WANG J, YANG H, YANG G, WANG J, PATERSON A H,XIA Q, JI D, XIANG Z. Draft genome sequence of the mulberry treeMorus notabilis.Nature Communications, 2013, 4(9): 2445-2454.
[30]PÉREZDÍAZ R, RYNGAJLLO M, PÉREZDÍAZ J, PEÑA-CORTÉS H, CASARETTO J A, GONZÁLEZ-VILLANUEVA E, RUIZ-LARA S. VvMATE1 and VvMATE2 encode putative proanthocyanidin transporters expressed during berry development inVitis viniferaL.Plant Cell Reports, 2014, 33(7): 1147-1159.
[31]ZIELIŃSKA D, TUREMKO M, KWIATKOWSKI J, ZIELIŃSKI H.Evaluation of flavonoid contents and antioxidant capacity of the aerial parts of common and tartary buckwheat plants.Molecules, 2012, 17(8):9668-9682.
[32]ZHENG S J, MA J F, MATSUMOTO H. Continuous secretion of organic acids is related to aluminium resistance during relatively long-term exposure to aluminium stress.Physiologia Plantarum,2010, 103(2): 209-214.
[33]MA J F, RYAN P R, DELHAIZE E. Aluminium tolerance in plants and the complexing role of organic acids.Trends in Plant Science,2001, 6(6): 273-278.
[34]MA J. Detoxifying aluminum with buckwheat.Nature, 1997,390(6660): 569-570.

