抗菌肽Sublancin与黄芪多糖对小鼠免疫调节作用的比较研究
杨天任 王 帅 黄 烁 尚丽君 于海涛 曾祥芳 谯仕彦*
(1.中国农业大学动物科技学院,生物饲料添加剂北京市重点实验室,北京 100193; 2.华中农业大学动物科技学院,武汉 430070)
抗菌肽(antimicrobial peptides,AMPs)是生物进化上最古老的抗微生物感染多肽,是从原核生物到人类等各种生物先天性免疫系统的重要组成部分,构成宿主防御病原微生物入侵的第1道屏障[1-2]。抗菌肽具有广谱抗菌活性,因其不易产生耐药性而成为抗生素替代品研究的热点[3-4]。近年来的研究表明,抗菌肽除了具有直接抑菌活性外,还具有调节炎症反应、趋化免疫细胞、促进细胞分化、激活先天性和获得性免疫反应等多种免疫调节功能,并与机体抵抗病原微生物感染以及免疫疾病密切相关[2,5]。有研究显示,抗菌肽可以提高动物对抗原特异性体液免疫和细胞免疫的应答水平,增加疫苗免疫效果[6-8],展示了其在人类及动物健康、疾病防治方面的广阔应用前景。Sublancin是美国马里兰大学Hansen研究团队从枯草芽孢杆菌发酵产物中分离鉴定到一种抗菌肽,是由37个氨基酸以及2个二硫键组成的阳离子肽,其氨基酸序列为GLGKAQCAALWLQCASGGTIGCGGGAVACQNYRQFCR,分子质量约为3 875.74 u[9-10]。Sublancin的性质极其稳定,可耐受1.5~9.5的pH,可在高温环境中稳定存在,能够抑制革兰氏阳性菌的出芽生长和繁殖分裂[11]。本实验室的前期研究表明,免疫调节是Sublancin抵抗金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌、魏氏梭菌感染小鼠和肉鸡的重要功能,且剂量为1.0和2.0 mg/kg的Sublancin在小鼠试验中均有显著的作用效果[12]。我国农业部批准使用的免疫调节剂有黄芪多糖、羊胎盘转移因子和紫锥菊3种,其中黄芪多糖目前使用最为广泛[13],因此,本试验以黄芪多糖为对照物,比较研究抗菌肽Sublancin和黄芪多糖对小鼠免疫功能的调节效果,为抗菌肽Sublancin作为免疫增强剂在动物生产中的应用提供理论依据。
1 材料与方法
1.1 试剂及试验动物

4~6周龄SPF级雌性BALB/c小鼠购自北京华阜康生物科技股份有限公司。本试验在农业部饲料效价和安全评价监督检验测试中心(北京)鼠营养代谢室进行。采用电脑控制鼠房温度、湿度和光照,鼠房温度为18~22 ℃,相对湿度为35%~55%,昼夜光照交替时间为12 h∶12 h。小鼠自由采食和饮水。小鼠饲粮为商品饲粮,购自北京华阜康生物科技股份有限公司。
1.2 试验设计
将60只4~6周龄健康雌性BALB/c小鼠随机分成6组,每组10只。各组小鼠先连续灌胃7 d、每天1次、每只0.2 mL的下列物质:空白对照组,灌胃生理盐水;攻毒组,灌胃生理盐水;12.0 mg/kg BW黄芪多糖组,灌胃12.0 mg/kg BW的黄芪多糖溶液;48.0 mg/kg BW 黄芪多糖组,灌胃48.0 mg/kg BW的黄芪多糖溶液;1.0 mg/kg BW Sublancin组,灌胃1.0 mg/kg BW的Sublancin溶液;2.0 mg/kg BW Sublancin组,灌胃2.0 mg/kg BW的Sublancin溶液。除空白对照组外,其余5组在灌胃结束24 h后均灌胃浓度为1×109CFU/mL的鼠伤寒沙门氏菌进行攻毒,每只200 μL。分别在攻毒3和24 h后从每组随机选取5只小鼠进行样品采集。
1.3 样品采集
将每组随机选取的5只小鼠进行眼眶采血,每只收集200~300 μL血样至1.5 mL无菌离心管中;室温静置2 h后,将血样在4 ℃条件下3 000 r/min离心10 min;之后在无菌条件下,用移液枪吸出上层淡黄色血清并分装,贮存于-80 ℃冰箱中待测。采血完成后,将小鼠脱臼处死,无菌取脾脏,制备切片;无菌条件下,取部分盲肠内容物。
1.4 检测指标
1.4.1 血清中细胞因子含量
首先参考Luminex平台ProcartaPlex多因子分析技术中方法进行磁珠混合液、清洗缓冲液、质控品和标准品的制备以及血清样本的稀释。然后在96孔芯片相应孔中分别加入25 μL空白品、标准品、质控品和稀释的待测血清样本(1∶400),再向每孔加入25 μL磁珠混合液,封膜置于平板摇床上4 ℃避光孵育过夜。清洗芯片3次,以去除多余的血清中未结合成分,然后每孔加入50 μL检测抗体,室温(20~25 ℃)避光振摇1 h,再次清洗后,向每孔加入50 μL链霉素偶联的藻红蛋白(PE)荧光染料,室温避光振摇30 min。最后,清洗芯片3次,加入100 μL鞘液,室温避光振荡10 min重悬磁珠。采用Magpix仪器检测血清中白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、白细胞介素-25(IL-25)、γ-干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)及单核细胞趋化蛋白-1(MCP-1)的含量。

1.4.3 肠道内容物中沙门氏菌的数量
取攻毒后3和24 h小鼠的盲肠内容物各0.1 g,分别于900 μL生理盐水中溶解,并分别稀释至10-3、10-4以及10-5水平,选取100 μL进行涂板,涂板选用沙门氏菌-志贺氏菌琼脂培养基(SS琼脂培养基),37 ℃培养24 h,对菌落进行计数。
1.5 统计方法
用SAS 9.4中的一般线性模型(GLM)程序对数据进行单因素方差分析,方差分析差异显著者,以LSD法比较平均值间的差异显著性。统计结果以平均值和均值标准误(SEM)表示,P<0.05表示差异显著。
2 结果与分析
2.1 抗菌肽Sublancin和黄芪多糖对小鼠血清中细胞因子含量的影响
由表1可知,经沙门氏菌攻毒3 h后,与空白
对照组相比,攻毒组血清中IL-6、IL-10、IFN-γ、TNF-α和MCP-1的含量显著增加(P<0.05)。与攻毒组相比,12.0和48.0 mg/kg BW的黄芪多糖以及2.0 mg/kg BW的Sublancin显著降低了血清中IL-6和IFN-γ的含量(P<0.05);12.0和48.0 mg/kg BW的黄芪多糖显著降低了血清中IL-10的含量(P<0.05),1.0 mg/kg BW的Sublancin则显著提高了血清中IL-10的含量(P<0.05);12.0和48.0 mg/kg BW的黄芪多糖以及1.0和2.0 mg/kg BW的Sublancin均显著降低了血清中TNF-α的含量(P<0.05),同时12.0 mg/kg BW的黄芪多糖和1.0 mg/kg BW的Sublancin未对血清MCP-1含量产生显著影响(P>0.05)。综合上述指标,抗菌肽Sublancin和黄芪多糖均能调节沙门氏菌感染小鼠的免疫功能,但以1.0 mg/kg BW Sublancin的效果最好。
由表2可知,经沙门氏菌攻毒24 h后,与空白对照组相比,攻毒组血清中IL-6、IL-10、IFN-γ、TNF-α和MCP-1的含量显著增加(P<0.05)。与攻毒组相比,2.0 mg/kg BW的Sublancin显著降低了血清中IL-6、IFN-γ、TNF-α和MCP-1的含量(P<0.05);1.0 mg/kg BW的Sublancin对血清中除IFN-γ外的其他细胞因子的含量无显著影响(P>0.05);12.0 mg/kg BW的黄芪多糖显著降低了血清中MCP-1的含量(P<0.05),对血清中其他细胞因子含量无显著影响(P>0.05);48.0 mg/kg BW的黄芪多糖显著降低了血清中IL-10、TNF-α和MCP-1的含量(P<0.05)。综合上述指标,抗菌肽Sublancin对感染沙门氏菌小鼠24 h后的免疫调节效果略优于黄芪多糖。
2.2 抗菌肽Sublancin和黄芪多糖对小鼠脾细胞中T淋巴细胞亚群数量及其比例的影响

表1 沙门氏菌攻毒3 h后抗菌肽Sublancin和黄芪多糖对小鼠血清中细胞因子含量的影响

表2 沙门氏菌攻毒24 h后抗菌肽Sublancin和黄芪多糖对小鼠血清中细胞因子含量的影响
2.3 抗菌肽Sublancin和黄芪多糖对小鼠肠道内容物中沙门氏菌数量的影响
由表5可知,沙门氏菌攻毒3 h后,空白对照组肠道内容物中沙门氏菌数量为0,与空白对照组相比,攻毒组肠道内容物中沙门氏菌的数量显著增加(P<0.05)。与攻毒组相比,各剂量的Sublancin组与黄芪多糖组肠道内容物中沙门氏菌的数量没有显著变化(P>0.05),但从数值上看2.0 mg/kg BW Sublancin组与48.0 mg/kg BW黄芪多糖组肠道内容物中沙门氏菌数量比攻毒组低。
3 讨 论


表3 沙门氏菌攻毒3 h后抗菌肽Sublancin和黄芪多糖对小鼠脾细胞中T

表4 沙门氏菌攻毒24 h后抗菌肽Sublancin和黄芪多糖对小鼠脾细胞中
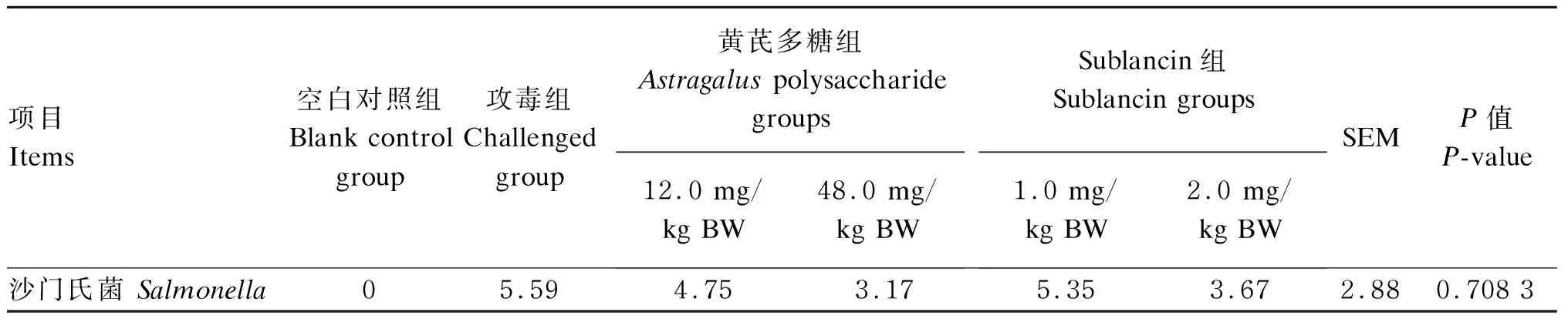
表5 沙门氏菌攻毒3 h后抗菌肽Sublancin和黄芪多糖对小鼠肠道内容物中沙门氏菌数量的影响
试验研究证明,黄芪多糖对机体特异性免疫与非特异性免疫、细胞免疫与体液免疫有广泛的影响。作为生物免疫调节剂,主要通过以下几个途径作用于机体的免疫系统:激活巨噬细胞;促进T细胞转化;活化细胞毒性T(Tc)细胞;诱生多种免疫因子,如干扰素(IFN)、白细胞介素-2(IL-2)和肿瘤坏死因子(TNF)等[13]。林爱华等[16]试验证明,黄芪可使刀豆蛋白A(ConA)激发的T淋巴细胞增殖反应明显增强,有明显的免疫增强作用。蒋瑞雪等[17]试验证明,黄芪多糖具有显著的免疫增强作用,且正常情况下,3.0 mg/kg的黄芪多糖可以显著增强小鼠机体的先天性免疫和细胞免疫功能,是一种很好的免疫调节剂。此外,李树义[18]的研究表明,黄芪多糖可以增强小鼠机体先天性免疫、细胞免疫和体液免疫功能。
研究表明黄芪多糖可以促进抑炎因子分泌[18]。抗菌肽β-防御素2(β-defensin 2)、hLF1-11和阳离子合成肽IDR-1018可以通过激活先天性免疫系统,启动获得性免疫,如诱导树突状细胞、巨噬细胞的分化[19-21]。抗菌肽LL37可以直接充当中性粒细胞、单核细胞、肥大细胞和T辅助(Th)细胞的趋化因子或刺激宿主细胞中性粒细胞和单核细胞趋化因子的释放,使它们能快速聚集在炎症反应部位,发挥其相应的功能并消除炎症。抗菌肽LL37除了具有直接的趋化活性外,还能通过受体依赖机制刺激许多先天性免疫细胞释放趋化因子和细胞因子而发挥间接趋化作用[22]。杨青[23]研究表明,适宜剂量的Sublancin可以诱导卵白蛋白(OVA)免疫小鼠产生Th1和Th2细胞混合型免疫反应,增强体液免疫和细胞免疫功能。本试验结果表明,在小鼠感染沙门氏菌3 h后,与空白对照组相比,抗菌肽Sublancin和黄芪多糖可不同程度地提高血清中IL-10、IFN-γ和MCP-1的含量。IL-10是一种重要的抗炎性细胞因子,可抑制树突状细胞的成熟及产生IL-12,有助于树突状细胞诱导Th2细胞的免疫反应,IFN-γ则可通过上调转录因子T-bet促进Th1细胞免疫反应,MCP-1是机体最重要的免疫细胞趋化因子,上述结果说明,在急性感染期,抗菌肽Sublancin和黄芪多糖均对增加IL-10的表达存在有利作用,抗菌肽Sublancin则在促进Th1和Th2细胞免疫反应以及免疫趋化方面具有比黄芪多糖更加全面的作用。
先天免疫系统的过量激活和放大会对宿主造成损害,而抗菌肽则可以抑制体内过量的炎症反应,如抑制细菌产物(如脂多糖、脂壁酸)诱导产生对宿主有害的细胞因子,抑制促炎性细胞因子(如IL-6、TNF-α)基因的转录,避免细菌产物(如脂多糖、脂壁酸)引起内毒素血症的发生[24]。黄芪多糖可以在促进抑炎因子分泌的同时抑制促炎因子的分泌[18]。本实验室前期研究表明,抗菌肽Microcin J25显著降低了断奶仔猪血清中IL-6、TNF-α等的含量,从而增强了断奶仔猪的先天性免疫功能[25]。本试验研究表明,在小鼠感染沙门氏菌3 h后,黄芪多糖和抗菌肽Sublancin显著降低了血清中IL-6、TNF-α的含量;在小鼠感染沙门氏菌24 h后,抗菌肽Sublancin显著降低了血清中IL-6、TNF-α的含量,黄芪多糖则仅能显著降低血清中TNF-α的含量,同时黄芪多糖和抗菌肽Sublancin还不同程度地降低了血清中IFN-γ和MCP-1的含量,说明抗菌肽Sublancin和黄芪多糖都能抑制小鼠急性感染期促炎性细胞因子基因的转录;感染24 h后抗菌肽Sublancin和黄芪多糖则全面抑制炎症反应,抗菌肽Sublancin比黄芪多糖的作用更全面。

在小鼠感染沙门氏菌3 h后,通过对其肠道内容物沙门氏菌数量进行检测,发现各组之间不存在显著差异,但是根据数值上可以看出,Sublancin和黄芪多糖具有降低肠道内容物中沙门氏菌数量的趋势。
4 结 论
① 通过对比空白对照组和攻毒组相关指标可知,本试验成功构建了沙门氏菌感染小鼠模型。

③ 与黄芪多糖相比,抗菌肽Sublancin对感染沙门氏菌小鼠免疫功能的调节更加全面。
[1] ZASLOFF M.Antimicrobial peptides of multicellular organisms[J].Nature,2002,415(6870):389-395.
[2] LAI Y P,GALLO R L.AMPed up immunity:how antimicrobial peptides have multiple roles in immune defense[J].Trends in Immunology,2009,30(3):131-141.
[3] NGUYEN L T,HANEY E F,VOGEL H J.The expanding scope of antimicrobial peptide structures and their modes of action[J].Trends in Biotechnology,2011,29(9):464-472.
[4] BALTZER S A,BROWN M H.Antimicrobial peptides:promising alternatives to conventional antibiotics[J].Journal of Molecular Microbiology and Biotechnology,2011,20(4):228-235.
[5] MANSOUR S C,PENA O M,HANCOCK R E W.Host defense peptides:front-line immunomodulators[J].Trends in Immunology,2014,35(9):443-450.
[6] FRITZ J H,BRUNNER S,BIRNSTIEL M L,et al.The artificial antimicrobial peptide KLKLLLLLKLK induces predominantly a Th2-type immune response to co-injected antigens[J].Vaccine,2004,22(25/26):3274-3284.
[7] ZHANG H H,YANG X M,XIE Q M,et al.The potent adjuvant effects of chicken β-defensin-1 when genetically fused with infectious bursal disease virus VP2 gene[J].Veterinary Immunology and Immunopathology,2010,136(1/2):92-97.
[8] ACOSTA J,CARPIO Y,VALDÉS I,et al.Co-administration of tilapia alpha-helical antimicrobial peptides with subunit antigens boost immunogenicity in mice and tilapia (Oreochromisniloticus)[J].Vaccine,2014,32(2):223-229.
[9] OMAN T J,BOETTCHER J M,WANG H,et al.Sublancin is not a lantibiotic but an S-linked glycopeptide[J].Nature Chemical Biology,2011,7(2):78-80.
[10] STEPPER J,SHASTRI S,LOO T S,et al.Cysteine S-glycosylation,a new post-translational modification found in glycopeptide bacteriocins[J].FEBS Letters,2011,585(4):645-650.
[11] PAIK S H,CHAKICHERLA A,HANSEN J N.Identification and characterization of the structural and transporter genes for,and the chemical and biological properties of,sublancin 168,a novel lantibiotic produced byBacillussubtilis168[J].Journal of Biological Chemistry,1998,273(36):23134-23142.
[12] WANG S,WANG Q W,ZENG X F,et al.Use of the Antimicrobial peptide sublancin with combined antibacterial and immunomodulatory activities to protect against methicillin-resistantStaphylococcusaureusinfection in mice[J].Journal of Agricultural and Food Chemistry,2017,65(39):8595-8605.
[13] 张小梅.黄芪多糖的免疫调节作用及抗肿瘤作用研究进展[J].大连大学学报,2003,24(6):101-104.
[14] 王庆伟.细菌素sublancin对金黄色葡萄球菌的抑制作用及其机制的研究[D].博士学位论文.北京:中国农业大学,2014.
[15] 徐歆.紫锥菊提取物对小鼠免疫和抗沙门氏菌感染能力的影响及其机理研究[D].博士学位论文.杭州:浙江大学,2014.
[16] 林爱华,李予蓉.黄芪对小鼠免疫功能的影响[J].医学争鸣,2003,24(17):389-390.
[17] 蒋瑞雪,赵宪,孙艳,等.黄芪多糖对小鼠免疫功能的影响[J].齐齐哈尔医学院学报,2011,32(4):510-511.
[18] 李树义.黄芪多糖对小鼠机体免疫功能的影响[D].硕士学位论文.唐山:河北联合大学,2014.
[19] BIRAGYN A,RUFFINI P A,LEIFER C A,et al.Toll-like receptor 4-dependent activation of dendritic cells by β-defensin 2[J].Science,2002,298(5595):1025-1029.
[20] VAN DER DOES A M,JOOSTEN S A,VROOMANS E,et al.The antimicrobial peptide hLF1-11 drives monocyte-dendritic cell differentiation toward dendritic cells that promote antifungal responses and enhance Th17 polarization[J].Journal of Innate Immunity,2012,4(3):284-292.
[21] PENA O M,AFACAN N,PISTOLIC J,et al.Synthetic cationic peptide IDR-1018 modulates human macrophage differentiation[J].PLoS One,2013,8(1):e52449.
[22] ELSSNER A,DUNCAN M,GAVRILIN M,et al.A novel P2X7 receptor activator,the human cathelicidin-derived peptide LL37,induces IL-1 beta processing and release[J].Journal of Immunology,2004,172(8):4987-4994.
[23] 杨青.抗菌肽Sublancin增强小鼠获得性免疫的研究[D].硕士学位论文.北京:中国农业大学,2016.
[24] HIEMSTRA P S,FERNIE-KING B A,MCMICHAEL J,et al.Antimicrobial peptides:mediators of innate immunity as templates for the development of novel anti-infective and immune therapeutics[J].Current Pharmaceutical Design,2004,10(23):2891-2905.
[25] YU H T,DING X L,LI N,et al.Dietary supplemented antimicrobial peptide microcin J25 improves the growth performance,apparent total tract digestibility,fecal microbiota,and intestinal barrier function of weaned pigs[J].Journal of Animal Science,2017,95(11):5064-5076.
[26] SHIMIZU M,PAN I C,HESS W R.T and B lymphocytes in porcine blood[J].American Journal of Veterinary Research,1976,37(3):309-317.
[27] SAMSOM J N,VOERMANS J J M,DE BRUIN M G M,et al.Direct cytolytic activity of PBMC from pigs infected with porcine reproductive and respiratory syndrome[J].Veterinary Research,2000,31:44.
[28] 张芮琪,陈正礼,罗启慧.黄芪多糖干预环磷酰胺所致免疫抑制小鼠的免疫功能[J].中国实验动物学报,2015,23(4):389-394.

