苗药赤胫散提取物的体外抑菌活性研究Δ
刘兰,黄家宇,陈俊,母艳华,周贤霞,潘柳岑,郭雨柔,李莉(贵州医科大学药学院,贵阳550025)
赤胫散(Polygonum runcinatum)为蓼科蓼属植物,广泛分布于贵州、四川、湖南等多个省份,为民间常用药;其以根及全草入药,性寒,味苦、涩,具有清热解毒、活血止血等功效,主治急性胃肠炎、月经不调和跌打损伤等[1]。目前对赤胫散的研究报道主要集中在质量研究方面[2-4],虽也有文献报道其具有体外菌活性[5-6],但缺乏系统研究。为了进一步明确赤胫散的体外抑菌作用,本研究根据赤胫散的民间用法并参考文献5]选择水和95%乙醇为提取溶剂,筛选得体外抑菌效果更好的95%乙醇提取物作为试验对象;同时,考察95%乙醇提取物的乙酸乙酯及正丁醇萃取部位的抑菌活性,进一步明确赤胫散的抑菌活性部位。本文旨在为赤胫散的抑菌活性研究和药材资源的开发利用提供实验依据。
1 材料
1.1 仪器
SW-CJ-1FD型净化工作台(广州瑞智科学仪器公司);AUY120型电子天平(日本岛津公司);GH-500隔水式培养箱(北京市永光明医疗仪器厂)。
1.2 药品、试剂与培养基
氯霉素原料药(上海源叶生物科技有限公司,批号:Y27N6C6020,纯度:98%);氟康唑原料药(北京索莱宝科技有限公司,批号:1127A031,纯度:98%);95%乙醇、乙酸乙酯、正丁醇、二甲基亚砜(DMSO)等均为分析纯,水为蒸馏水。
水解酪蛋白(M-H)琼脂培养基(批号:20160817)、M-H肉汤培养基(批号:20160817)均购自北京索莱宝科技有限公司;沙氏琼脂培养基(青岛尼赛欣合生物技术有限公司,批号:20151025);无菌生理盐水(贵州科伦药业有限公司,批号:D17033101)。
1.3 药材
赤胫散于2015年7月采收自贵州省息烽县(批号:20150701),经由贵州医科大学生药学教研室龙庆德教授鉴定为蓼科蓼属植物(P.runcinatumBuch.-Ham.Var.Sinene Hemsl.)。药材自然晾干后粉碎为粗粉,室温储存备用。
1.4 标准菌株
伤寒杆菌(CMCC 50037)、金黄色葡萄球菌(ATCC 292131)、大肠埃希菌(ATCC 25922)、福氏志贺氏菌(CMCC 52337)、枯草芽孢杆菌(ATCC 9372)、绿脓杆菌(ATCC 27853)、乙型溶血性链球菌(ATCC 19615)、白色念珠菌(ATCC 10231)、新生隐球菌(D 247)均由贵州医科大学感染与免疫学实验室提供。
2 方法与结果
2.1 菌种的活化及菌悬液的制备
按无菌操作法[7-10],将各标准菌株接种在相应的琼脂培养基上复苏(细菌用M-H琼脂培养基在37℃条件下培养18~24 h;真菌用沙氏琼脂培养基在37℃条件下培养24~48 h),转接1次;用灭菌生理盐水调整菌悬液浓度至0.5麦氏浊度单位,此时菌悬液菌浓度约为1.5×108CFU/mL;再取少量菌悬液,用灭菌生理盐水稀释至1.5×106CFU/mL,备用。
2.2 赤胫散提取物及不同极性部位萃取物的体外抑菌作用考察
2.2.1 药液的制备 (1)水提物药液:取赤胫散粗粉50 g,以10倍量水充分浸泡过夜后,煎煮3次,每次3 h;减压抽滤,合并3次滤液,水浴蒸干,得水提物14.85 g。将水提物以无菌生理盐水溶解,制成质量浓度为100 mg/mL的药液(按生药计算相当于337 mg/mL),备用。(2)95%乙醇提取物药液:取赤胫散粗粉50 g,以10倍量95%乙醇回流提取3次,每次3 h;减压抽滤,合并3次滤液,旋蒸减压回收乙醇,水浴蒸干,得95%乙醇提取物19.24 g。将该提取物用含10%DMSO的无菌生理盐水溶解,制成质量浓度为100 mg/mL的药液(按生药计算相当于260 mg/mL),备用。(3)95%乙醇提取物不同极性萃取部位药液:取赤胫散95%乙醇提取物适量,用水混悬后,先用乙酸乙酯萃取,剩余药液用正丁醇萃取。旋蒸减压回收不同极性溶剂,真空干燥,分别得乙酸乙酯、正丁醇萃取部位8.81、6.59 g。将不同极性萃取部位分别用含10%DMSO的无菌生理盐水溶解,制备成质量浓度均为50 mg/mL的药液(按生药计算相当于284、379 mg/mL),备用。(4)对照药液:将氯霉素和氟康唑用无菌生理盐水溶解,制成质量浓度均为300 μg/mL的药液,备用。试验前所有药液均用0.22 μm滤膜过滤除菌。
2.2.2 体外抑菌作用考察 采用管碟法[11-13]进行测定。按无菌操作法[7-10],分别吸取“2.1”项下菌悬液(1.5×108CFU/mL)100 μL至相应培养基表面(细菌用M-H琼脂培养基,真菌用沙氏琼脂培养基),用无菌棉签涂布均匀,室温下放置2~3 min,等距分散放置灭菌牛津杯(外径为8 mm,内径为6 mm,高度为10 mm),静置10~15 min使其固定,向每个牛津杯中加入“2.2.1”项下各药液100 μL,室温下放置2 h使药液扩散。每个平板均设置3个药液平行组、1个药物对照组(细菌用氯霉素、真菌用氟康唑为对照)和1个溶剂对照组(含10%DMSO的无菌生理盐水)。将各培养皿于37℃培养(细菌培养18~24 h,真菌培养24~48 h),然后取出观察抑菌圈并测量直径。每种菌株平行操作3次。结果判定标准:抑菌圈直径<10 mm为抗药(可认为无抑菌活性),10 mm为轻度敏感,11~15 mm为中度敏感,16~20 mm为高度敏感;抑菌圈直径越大,则表明待测药物抑菌作用越强[9]。抑菌圈直径测定结果见表1。
由表1可见,赤胫散水提物抑菌圈大多在10 mm临界值或以下,表明其几乎无抑菌活性;95%乙醇提取物对除乙型溶血性链球菌以外的6种细菌的抑菌圈均大于10 mm,表明其有抑菌活性,其中对福氏志贺氏菌的抑制作用最强,且对福氏志贺氏菌和伤寒杆菌的抑制作用与对照药物氯霉素相当,但是对2种真菌抑制效果不佳;乙酸乙酯部位对7种细菌的抑菌圈均大于10 mm,表明其均有不同程度的抑菌作用,且对伤寒杆菌和枯草芽孢杆菌的抑制作用最强,但对真菌无抑制作用;正丁醇部位对伤寒杆菌和枯草芽孢杆菌的抑菌圈均大于10 mm,表明其对这2种细菌有抑菌作用,但对其他菌株抑制效果不佳。综合比较,赤胫散不同提取物的抑菌作用强度排序为:乙酸乙酯部位>95%乙醇提取物>正丁醇部位>水提物。本研究进一步就赤胫散95%乙醇提取物及其乙酸乙酯、正丁醇部位对6种细菌的最低抑菌浓度(MIC)和最低杀菌浓度(MBC)进行考察。
表1 赤胫散提取物的抑菌圈直径测定结果(±s,n=3,mm)Tab 1 Diameters results of antibacterial circle for the extract from P.runcinatum(±s,n=3,mm)
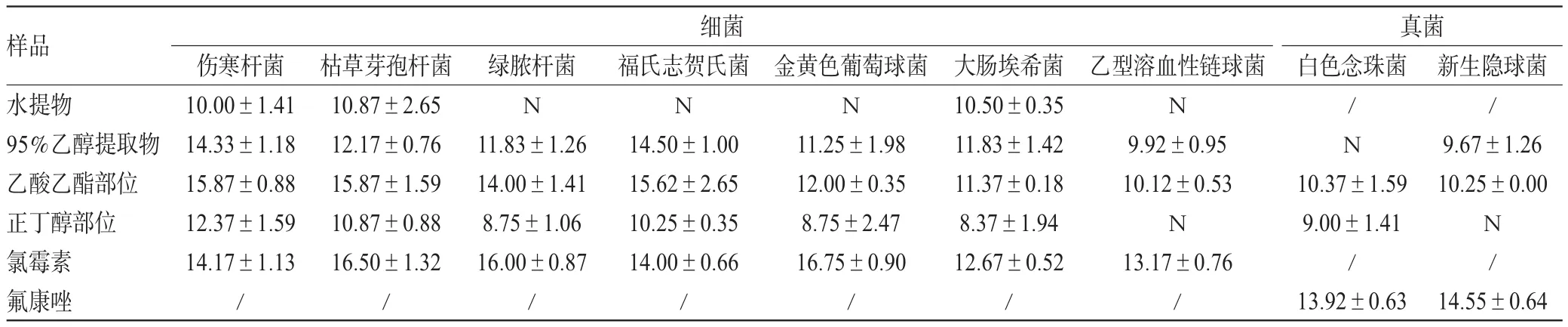
表1 赤胫散提取物的抑菌圈直径测定结果(±s,n=3,mm)Tab 1 Diameters results of antibacterial circle for the extract from P.runcinatum(±s,n=3,mm)
注:“/”为未进行试验;“N”为无抑菌圈Note:“/”means not tested;“N”means no antibacterial circle
样品水提物95%乙醇提取物乙酸乙酯部位正丁醇部位氯霉素氟康唑细菌真菌白色念珠菌/N伤寒杆菌10.00±1.41 14.33±1.18 15.87±0.88 12.37±1.59 14.17±1.13/枯草芽孢杆菌10.87±2.65 12.17±0.76 15.87±1.59 10.87±0.88 16.50±1.32/绿脓杆菌N 11.83±1.26 14.00±1.41 8.75±1.06 16.00±0.87/福氏志贺氏菌N 14.50±1.00 15.62±2.65 10.25±0.35 14.00±0.66/金黄色葡萄球菌N 11.25±1.98 12.00±0.35 8.75±2.47 16.75±0.90/大肠埃希菌10.50±0.35 11.83±1.42 11.37±0.18 8.37±1.94 12.67±0.52/乙型溶血性链球菌N 9.92±0.95 10.12±0.53 N 13.17±0.76/10.37±1.59 9.00±1.41/13.92±0.63新生隐球菌/9.67±1.26 10.25±0.00 N/14.55±0.64
2.3 赤胫散95%%乙醇提取物及其乙酸乙酯、正丁醇部位对6种细菌的MIC和MBC测定
2.3.1 MIC 采用微量肉汤稀释法[9-13]进行测定。按无菌操作法[7],取一次性无菌96孔板(每排12孔),各加入M-H肉汤培养基100 μL,再分别吸取赤胫散95%乙醇提取物及其乙酸乙酯、正丁醇部位药液100 μL加入第1孔,混匀后吸取100 μL加入第2孔,如此连续倍比稀释至第10孔,第10孔中吸取100 μL弃去,此10个孔作为试验组;第11孔只加培养基和菌液,用以观察培养基是否适合菌株生长,作为生长对照组;第12孔只加培养基,用以观察培养基是否被污染,作为培养基对照组。吸取浓度为1.5×106CFU/mL的菌悬液100 μL,依次加入到上述1~11孔中,充分混匀,此时各孔菌浓度均为7.5×105CFU/mL;吸取M-H肉汤培养基100 μL加入到第12孔中,充分混匀。将96孔板加盖置于37℃恒温培养箱中培养18~24 h后,取出观察菌株生长情况。在黑色背景光源下,若与生长对照孔中生长特性相同(如肉汤浑浊或孔底出现浑浊),则判断为有菌生长[9-10]。以无菌生长试验孔所对应的最低药物质量浓度记为该药物的MIC。每种菌株平行操作3次,结果详见表2~表4。

表2 赤胫散95%%乙醇提取物对6种菌株的MIC测定结果(n=3)Tab 2 MIC results of 95%%ethanol extract from P.runcinatum to 6 kinds of bacteria(n=3)

表3 赤胫散95%%乙醇提取物的乙酸乙酯部位对6种菌株的MIC测定结果(n=3)Tab 3 MIC results of ethyl acetate fraction of 95%%ethanol extract from P.runcinatum to 6 kinds of bacteria(n=3)

表4 赤胫散95%%乙醇提取物的正丁醇部位对6种菌株的MIC测定结果(n=3)Tab 4 MIC results of n-butyl alcohol fraction of 95%%ethanol extract from P.runcinatum to 6 kinds of bacteria(n=3)
由表2、表3、表4可知,赤胫散95%乙醇提取物对伤寒杆菌、枯草芽孢杆菌、金黄色葡萄球菌、大肠埃希菌的MIC为12.5 mg/mL,对绿脓杆菌、福氏志贺氏菌的MIC均为6.25 mg/mL;其乙酸乙酯部位对伤寒杆菌、绿脓杆菌、福氏志贺氏菌的MIC均为3.13 mg/mL,对枯草芽孢杆菌、金黄色葡萄球菌、大肠埃希菌的MIC均为6.25 mg/mL;其正丁醇部位对伤寒杆菌、枯草芽孢杆菌、绿脓杆菌、福氏志贺氏菌的MIC为6.25 mg/mL,对金黄色葡萄球菌的MIC为25 mg/mL,对大肠埃希菌的MIC为12.5 mg/mL。
2.3.2 MBC 采用琼脂培养基平板法[10]进行测定。分别从“2.3.1”项下未见细菌生长的孔中吸取100 μL培养液,分别接种至M-H琼脂培养基平皿中,用无菌棉签均匀涂布,置于37℃恒温培养箱中培养18~24 h。用活菌计数法检查平板上菌落,以平均菌落数<5个对应的最小稀释度的提取物质量浓度记为MBC[9-10]。每种菌株平行操作3次,结果详见表5。
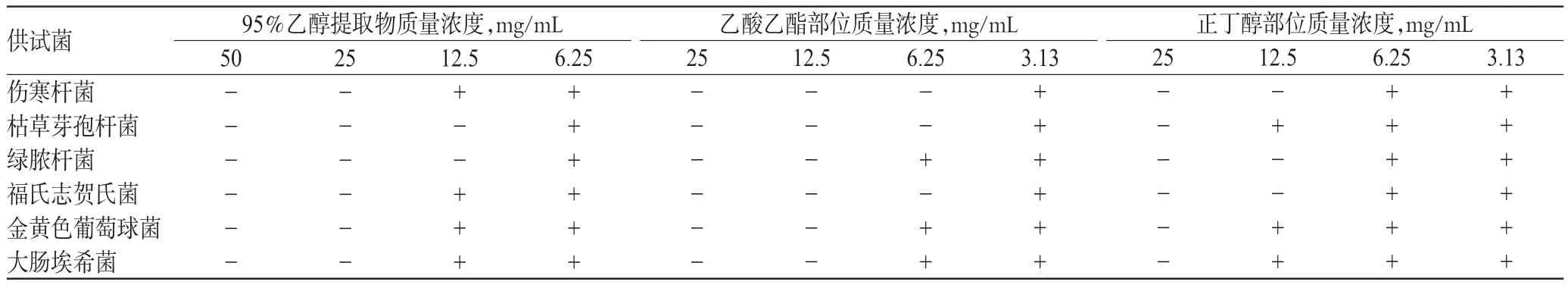
表5 赤胫散95%%乙醇提取物及其乙酸乙酯、正丁醇部位的MBC测定结果(n=3)Tab 5 MBC results of 95%%ethanol extract,its ethyl acetate and n-butanol fractions from P.runcinatum(n=3)
由表5可知,赤胫散95%乙醇提取物对枯草芽孢杆菌、绿脓杆菌的MBC为12.5 mg/mL,对其余4种细菌的MBC均为25 mg/mL;其乙酸乙酯部位对伤寒杆菌、枯草芽孢杆菌、福氏志贺氏菌的MBC为6.25 mg/mL,对其余3种细菌的MBC为12.5 mg/mL;其正丁醇部位对伤寒杆菌、绿脓杆菌、福氏志贺氏菌的MBC均为12.5 mg/mL,对枯草芽孢杆菌、金黄色葡萄球菌、大肠埃希菌的MBC均为25 mg/mL。
3 讨论
本研究选择氯霉素和氟康唑作为阳性对照药物。其中,氯霉素为广谱抗生素,对革兰氏阳性菌和革兰氏阴性菌均有良好的抑菌效果;氟康唑为抗真菌药物,对真菌的抑制作用良好。试验中所有药物的质量浓度均由本课题组根据文献[14-15]及前期预试验结果设定。
体外抑菌作用测定结果显示,赤胫散水提物几乎未见抑菌作用;95%乙醇提取物对各菌株的抑菌作用显著强于水提物,且对6种细菌的抑制效果优于对2种真菌及乙型溶血性链球菌,在6种细菌中又以对福氏志贺氏菌的抑制效果最强;95%乙醇提取物的乙酸乙酯及正丁醇部位均表现出良好抑菌效果,但对真菌均无抑制作用。以上结果提示,赤胫散95%乙醇提取物及其乙酸乙酯、正丁醇萃取部位为抑菌有效部位,均对细菌有较好的抑制效果,但对真菌抑制效果不佳。
进一步对6种细菌的MIC考察结果显示,赤胫散95%乙醇提取物的乙酸乙酯部位抑菌作用最强,其次为正丁醇部位,95%乙醇提取物的抑菌效果最弱;MBC的测定结果进一步证明乙酸乙酯部位抑菌效果最强。以上结果提示,赤胫散95%乙醇提取物的乙酸乙酯部位可作为抑菌活性部位应用,从中寻找赤胫散的有效抑菌活性成分是今后研究的方向。
综上所述,赤胫散95%乙醇提取物及其乙酸乙酯、正丁醇萃取部位具有明显的体外抑菌作用,尤其以乙酸乙酯部位最优。该结论为赤胫散这一民间常用药的开发利用提供了一定的实验依据,但其中具有抑菌作用的具体有效活性成分及其抑菌机制仍有待进一步研究。
[1] 南京中医药大学编写组.中药大词典:上册[M].2版.上海:上海科学技术出版社,2006:1448-1449.
[2] 周贤霞,李莉,刘兰,等.贵州产赤胫散药材的质量分析[J].贵州医科大学学报,2017,42(4):431-434.
[3] 许超飞,黄家宇,郝阳,等.HPLC测定赤胫散中的3,3′-二甲基鞣花酸和3,3′,4′-三甲基鞣花酸[J].华西药学杂志,2015,30(2):230-231.
[4] 周贤霞,黄家宇,刘兰,等.赤胫散中总鞣质含量测定及提取工艺优化[J].贵州医科大学学报,2017,42(6):688-690.
[5] 向红,王绪英,孙爱群.蓼属植物赤胫散乙醇提取物水溶液的抑菌作用[J].毕节师范高等专科学校学报,2003,21(2):65-68.
[6] 蔡泽贵,梁光义,周欣,等.贵州赤胫散挥发油化学成分及其抗菌活性研究[J].贵州大学学报(自然科学版),2004,21(4):377-379.
[7] 杜连祥,路福平.微生物学实验技术[M].北京:中国轻工业出版社,2006:7-12.
[8] 梁硕,杨志萍,费振鸿,等.罗汉果抑菌性能的研究[J].食品工业,2016(7):207-209.
[9] 徐叔云,卞如濂,陈修.药理实验方法学[M].2版.北京:人民卫生出版社,1989:1340-1360.`
[10] 徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2001:1647-1662.
[11] 林海,龚又明,邓广海,等.黄柏及其炮制品水提物体内、外抑菌作用研究[J].中国药房,2012,23(31):2900-2902.
[12] 华亚南,陈辉,张其中.100种中草药水提物体外抑杀无乳链球菌的药效研究[J].生态科学,2015,34(3):26-30.
[13] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:160-164.
[14] 陶翠.油樟叶提取物的抑菌、镇痛和抗炎活性及其作用机制研究[D].雅安:四川农业大学,2011.
[15] 胡志明.3种药用植物抗菌活性研究[D].兰州:兰州理工大学,2012.

