ZD制剂对RAW264.7细胞分泌TNF-α水平及TNF-α诱导L929细胞死亡的影响
蒋瑞东,高 鑫,李云章
(内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018)
炎症反应是机体由各种炎症因子或外界有害刺激和损伤所引起的防御反应,是灭活和消除这些炎症因子,为组织修复创伤环境的一个非常普遍而重要的基本病理过程[1]。局部组织的恶化、渗出和增生的变化是炎症反应的主要表现[2]。它伴随着许多疾病的发生和发展,同时也会促进疾病的发展。ZD制剂[3]是治疗马属动物肢蹄软组织损伤的经典处方,临床使用效果良好。该方由川椒、茵陈、白芨等12味中草药组成。前期试验表明ZD制剂对IL-1β、IL-6有良好的抑制作用[4],但ZD制剂对肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)的具体作用尚不明确。
该试验通过脂多糖(LPS)刺激小鼠腹腔巨噬细胞RAW264.7细胞系建立细胞炎症模型,并检测ZD制剂干预前后TNF-α浓度的变化;通过TNF-α刺激小鼠成纤维细胞L929建立细胞毒性模型,并检测ZD制剂干预前后细胞活力的变化,对其在炎症中对TNF-α的作用进行初步的研究。
1 材料与方法
1.1 材料
DMEM培养液、RPM1640培养液、0.25%胰蛋白 酶 (Biologic), 胎 牛 血 清 (Gibco),LPS、MTT、DMSO(Sigma),TNF-α[爱必信(上海)生物科技有限公司],小鼠TNF-α ELISA试剂盒(南京建成生物工程研究所)。小鼠腹腔巨噬细胞RAW264.7细胞系、小鼠成纤维细胞L929购自中国科学院典型培养物保藏委员会细胞库。12味中草药均购自内蒙古国大药房。
1.2 ZD制剂的制备
12味中药按药方混合,粉碎成粗粉,冷水浸泡过夜,加蒸馏水浸没药材,通过中医煎药机采用包煎法进行煎煮,文火加热,逐渐加大火力煮沸,保持微沸状态计时,持续煮沸40 min,重复3次。汤剂煎完后进行榨渣取汁,收集压榨得到的药液并过滤,将过滤液与煎液合并,冷却,用旋转蒸发仪对药液进行浓缩。最后浓缩成1 g/mL生药的中药提取原药药液,消毒除菌备用。然后用培养液将ZD 制剂稀释成 5 种浓度,即 100、10、1、0.1、0.01 μg/mL用于后续试验。
1.3 细胞分组
1.3.1 小鼠腹腔巨噬细胞RAW264.7分组:将小鼠腹腔巨噬细胞RAW264.7按1×107cell/mL浓度接种于12孔板中。37℃、5%CO2条件下贴壁培养24 h,待细胞贴壁后,弃去培养基,用D-Hanks生理缓冲液冲洗3次,洗弃未贴壁细胞,在每孔加入含有5%NCS的DMEM培养基后按以下分组进行处理:正常组,不加LPS和ZD制剂;LPS组,在细胞培养液中加入LPS溶液,使其终浓度为1 μg/mL,但不加入ZD制剂药液;试验组,分为5组(分别为 ZD 1 组、ZD 2 组、ZD 3 组、ZD 4 组、ZD 5组),先添加ZD制剂,使ZD制剂终浓度分别为100、10、1、0.1、0.01 μg/mL,在药物作用 1 h 后添加LPS,使LPS终浓度为1 μg/mL。每组重复5个复孔,将上述接种于12孔板的细胞与不同浓度药物或溶剂在37℃、5%CO2条件下孵育1 h。
1.3.2 小鼠成纤维细胞L929分组:具体操作同1.3.1。组别分为:正常组,不加TNF-α和ZD制剂;TNF-α组,在细胞培养液中加入TNF-α溶液,使其终浓度为4 ng/mL,但不加入ZD制剂;试验组,分为5组(分别为ZD 1组、ZD 2组、ZD 3组、ZD 4组、ZD 5组),添加ZD制剂,使ZD制剂终浓度分别为 100、10、1、0.1、0.01 μg/mL, 在药物作用 1 h后添加TNF-α,使TNF-α终浓度为4 ng/mL。培养液采用含5%NCS的RPM1640培养液。
1.4 细胞毒性的检测
采用MTT法分别检测RAW264.7细胞和L929细胞在490 nm处吸光光度值。
1.5 TNF-α含量的测定
在使用LPS干预小鼠腹腔巨噬细胞RAW264.7 24 h后收集上清液。用TNF-α放免试剂盒测定细胞培养上清液中TNF-α含量,具体实验操作步骤按照ELISA试剂盒说明书进行。
1.6 ZD制剂对TNF-α诱导L929细胞的生长抑制作用
操作方法同1.4。
2 结果与分析
2.1 ZD制剂对小鼠腹腔巨噬细胞RAW264.7毒性的影响
采用MTT法检测细胞活性,浓度为100、10、1、0.1、0.01 μg/mL 的 ZD 制剂处理小鼠腹腔巨噬细胞RAW264.7后,与正常组和LPS组相比,细胞活力没有显著差异(见图1),说明ZD制剂在该试验条件下不会出现明显的细胞毒性反应。
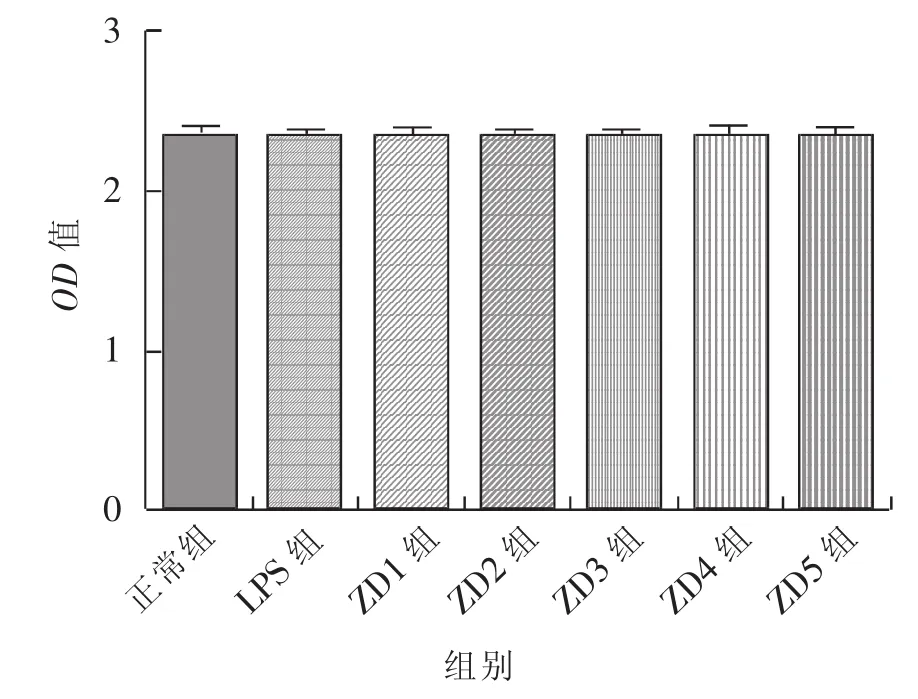
图1 ZD制剂对小鼠腹腔巨噬细胞RAW264.7的毒性分析
2.2 ZD制剂对小鼠成纤维细胞L929毒性的影响
采用的MTT法检测细胞活性,浓度为100、10、1、0.1、0.01 μg/mL 的 ZD 制剂处理的小鼠成纤维细胞L929后,与正常组相比,细胞活力没有显著差异(见图2),说明ZD制剂在该试验条件下无明显的细胞毒性反应。
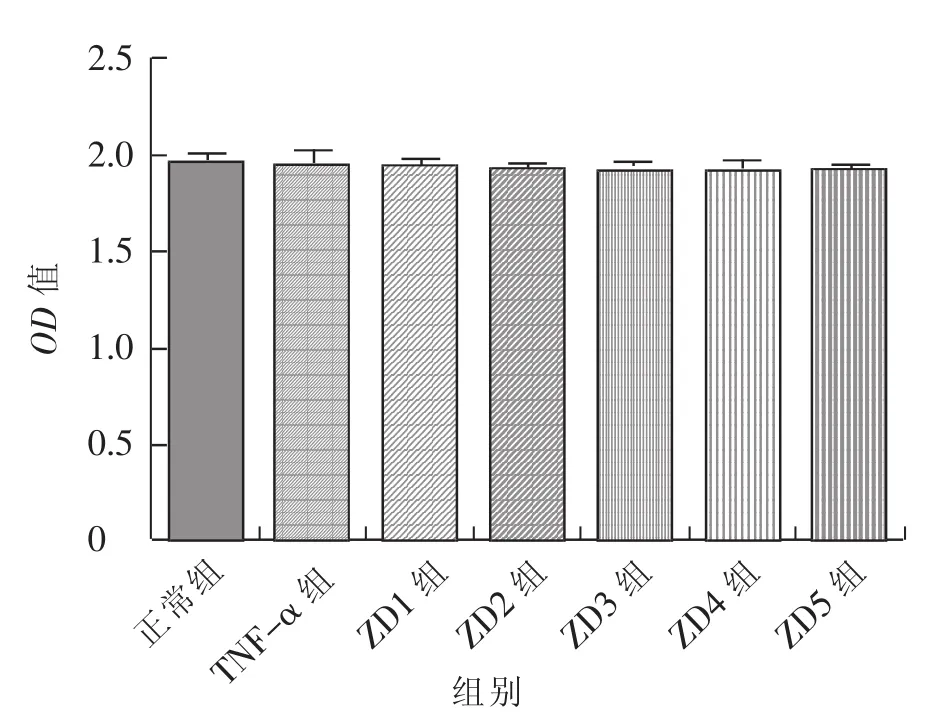
图2 ZD制剂对小鼠成纤维细胞L929的毒性分析
2.3 ZD制剂对TNF-α水平的影响
由表1可以看出,由ZD制剂干预后的巨噬细胞分泌的TNF-α水平与LPS模型组相比降低明显,且有明显剂量依赖性。ZD制剂浓度为100、10、1、0.1 μg/mL 时,TNF-α 浓度与 LPS 模型组相比,差异极显著 (P<0.01),ZD 制剂浓度为 0.01 μg/mL时,TNF-α浓度与LPS模型组相比,差异显著(P<0.05)。

表1 不同试验组上清液中TNF-α的水平
2.4 ZD制剂对TNF-α诱导L929细胞死亡的影响
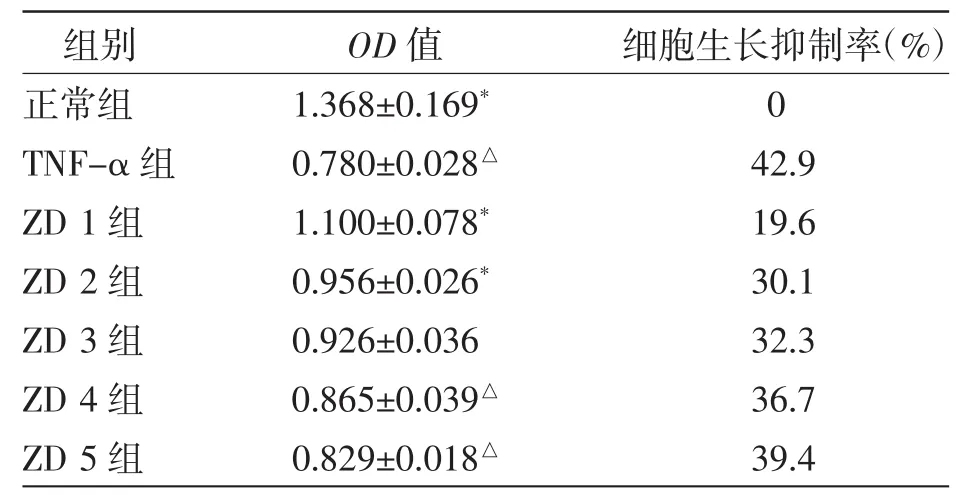
表2 ZD制剂抑制TNF-α对L929细胞的毒性分析
采用MTT法检测细胞活性,由表2可以看出,由ZD制剂干预后的小鼠成纤维细胞L929细胞活力与TNF-α组相比显著提高,且有明显剂量依赖性。说明ZD制剂在该试验条件下可以抑制TNF-α诱导L929成纤维细胞的死亡。
3 讨论
巨噬细胞是免疫效应细胞,具有多种免疫功能,包括免疫防御、免疫监视、免疫调剂等,它们在机体的先天性免疫系统中起着重要的作用[5]。在炎性反应进程中,巨噬细胞通过分泌不同种类的细胞炎症介质直接或间接地参加到各种炎症疾病反应进程[6-7]。 近年来多运用脂多糖(LPS)刺激动物来构建用于评估药物、食品、营养的全身炎症模型[8]。LPS参与构成革兰阴性菌的细胞壁,是内毒素的主要成分,当LPS或其他病原微生物进入巨噬细胞时其会表达不同类型的促炎症因子,如表达 TNF-α、IL-6 等来诱导和加强局部炎症反应[9]。TNF-α是一种重要的炎症因子,参与炎症反应、细胞免疫等多种生理和病理过程,它有很多生物学活性[10]。它既可以诱导白细胞介素类炎症因子的表达,也可以诱导干扰素类等炎症细胞因子的表达[11]。所以该试验通过使用LPS诱导小鼠腹腔巨噬细胞RAW264.7分泌TNF-α体外模型应用于试验研究,该模型可以较好地用于非特异性抗炎药物的筛选以及抗炎药物作用机制的研究[12]。
肿瘤坏死因子 (tumor necrosis factor-α,TNF-α)是一个含有157个氨基酸的非糖基化蛋白,是单核细胞、巨噬细胞或淋巴细胞分泌的多功能细胞因子,在细胞生长、细胞分化、炎症、免疫调节和抗肿瘤等方面发挥重要作用,也是重要的促炎细胞因子和抗肿瘤因子[13]。TNF-α是参与炎症反应的“一线”细胞因子,炎症发生时其含量最快升高且起核心作用,并能刺激IL-1、IL-6、IL-8等细胞因子的释放,起到所谓瀑布效应,进而导致全面的炎症反应[14]。
因此,该试验通过ELISA法检测在使用不同浓度的ZD制剂干预后,经过LPS刺激小鼠腹腔巨噬细胞RAW264.7导致TNF-α的含量变化。结果表明,LPS刺激细胞24 h后,细胞因子TNF-α含量极显著高于正常细胞,表明体外炎症模型已成功构建。给予不同浓度的ZD制剂后,在100 μg/mL和10 μg/mL的浓度下,ZD制剂可以显著减少TNF-α的分泌量,从而起到抗炎作用。
TNF-α对某些肿瘤细胞的杀伤作用是它最主要的生物学活性之一。根据这一特点,可以测定TNF-α敏感靶细胞的活性,并根据细胞死亡情况获得TNF-α的相对活性。在众多细胞株中,只有小鼠成纤维细胞L929对TNF-α的敏感性最强,所以,至今在TNF-α的研究过程中,很多学者还一直选用小鼠成纤维细胞L929作为TNF-α的活力测定对象[15]。因此,该试验选取小鼠成纤维细胞L929作为TNF-α的活力测定对象,通过MTT法测定TNF-α对小鼠成纤维细胞L929的毒性作用,结果显示,在TNF-α浓度为4 ng/mL时,小鼠成纤维细胞L929活力明显下降,细胞生长抑制率为42.9%,与正常组有显著差异,说明成功构建了TNF-α对小鼠成纤维细胞L929的毒性试验模型。给予不同浓度的ZD制剂后,在100 μg/mL及10 μg/mL浓度下,ZD制剂可以显著抑制TNF-α的生物学活性,细胞活力与TNF-α模型组差异显著,细胞生长抑制率为19.6%,说明ZD制剂可以通过降低毒性模型中TNF-α的生物学活性来提高小鼠成纤维细胞L929的存活率。在炎症反应中,TNF-α是一种重要的促炎症因子,TNF-α含量及活性的提升会促进炎症的发展。该试验结果提示ZD制剂在炎症反应过程中也能通过抑制TNF-α的活性来达到抗炎的目的。
综上所述,ZD制剂在炎症反应发生时可以显著降低促炎症因子TNF-α的含量,在炎症反应发生后可以显著降低TNF-α活性,从而在两方面抑制炎症反应,达到抗炎效果。传统消炎药物还可以通过抑制COX-2等因子来达到抗炎的作用,由于该试验只检测了单一的因子,ZD制剂对COX-2等相关因子的作用有待进一步的试验研究。
[1]倪志宇.CCK-8对炎症反应中促炎及抗炎性细胞因子表达的调控机制研究 [D].石家庄:河北医科大学,2005:168-196.
[2]程瑶,郭泽,王平,等.蒲公英甾醇对LPS诱导的RAW264.7细胞iNOS和COX-2表达的影响及其机制研究[J].免疫学杂志,2015,31(10):860-863.
[3]柏合.自制外用中药软膏对实验小鼠急性软组织损伤的初步研究 [D].呼和浩特:内蒙古农业大学,2012.
[4]高鑫.ZD制剂对小鼠软组织损伤修复及对RAW264.7炎症因子的影响[D].呼和浩特:内蒙古农业大学,2016.
[5]ZHANG S S,NIE S P,XIE M Y,et al.Effect of polysaccharide of Ganpderma atrum on the function of mouse peritoneal macrophages in vitro [J].Chin Pharmacol Bull,2010,26(9):1139-1142.
[6]王彩云,邰春格,刘明强.牛磺胆酸对小鼠免疫功能的调节 [J].内蒙古农业大学学报 (自然科学版),2011,32(4):19-24.
[7]王建楠,阮洪生,崔玉东,等.身痛逐瘀汤通过调控P38MAPK信号通路抑制LPS诱导的RAW264.7巨噬细胞一氧化氮的分泌[J].黑龙江八一农垦大学学报,2015,27(3):75-78.
[8]OBERBECK R,SCHMITZ D,WILSENACK K,et al.Prolactin modulates survival and cellular immune functions in septic mice [J].Journal of Surgical Research,2003,113(2):248-256.
[9]陈秋玲,高幼衡,张丽媛.Nodosin对脂多糖刺激RAW264.7细胞分泌NO及细胞因子的影响[J].广州中医药大学学报,2013,30(22):211-213.
[10]丘创华,侯敢,黄迪南.TNF-α信号传导通路的分子机理 [J].中国生物化学与分子生物学报,2007,23(6):430-435.
[11]伏爽,钱玉昆.肿瘤坏死因子的研究进展[J].国际免疫学杂志,1993(5):252-257.
[12]毕文岩.人参皂苷Rh2衍生物的体外抗炎作用及分子机制研究[D].长春:吉林大学,2009.
[13]周林,杨慧,艾有生,等.中药单体抗TNF-α介导的炎症反应机制研究进展 [J].南昌大学学报 (医学版),2013,53(3):72-75.
[14]王娜娜, 刘庆民.TNFα、IL-6、NF-κB 及其抑制剂与急性胰腺炎研究进展 [J].中国消化病与影像杂志(电子版),2015,5(5):253-255.
[15]叶元超.肿瘤坏死因子TNFα及冬凌草甲素诱导小鼠成纤维肉瘤L929细胞死亡的机制研究[D].沈阳:沈阳药科大学,2012.

