飞行时间质谱系统微生物样本处理试剂与Bruker样本处理基质预处理对病原菌鉴定效能的影响研究
马庆伟,周凤丽,战晓微,王莉莉,刘昕超,曲芬,曹峰林
基质辅助激光解吸电离飞行时间质谱(Matrix-assisted Laser Desorption-ionization Time-of-flight Mass Spectrometry,MS)技术是近年来发展起来的鉴定病原微生物的新技术,可通过对供试病原微生物蛋白指纹图谱进行同源分析而快速鉴定菌种,对疾病诊断具有重要意义[1-4]。与传统病原微生物鉴定方法相比,MS技术具有灵敏度较高、准确率较高、耗能较低、高通量等优点。目前,临床微生物实验室使用的MS系统多为德国布鲁克基质辅助激光解吸电离飞行时间质谱(Bruker Microflex MS)系统和法国梅里埃公司的Vitek质谱系统,但进口质谱仪价格昂贵,一次性投入成本较高。国产Clin-TOF-Ⅱ型MS系统及其配套的飞行时间质谱系统微生物样本处理试剂(Clin-TOF试剂)在价格和临床鉴定准确率方面均具有优势。本研究旨在比较Clin-TOF试剂与Bruker样本处理基质液(Bruker基质液)预处理对病原菌鉴定效能的影响。
1 材料与方法
1.1 菌株来源 选取2017年1—5月中国人民解放军第302医院临床常规分离的菌株103株,其中革兰阴性菌36株、革兰阳性菌33株、真菌34株,均置于-80 ℃冰箱中保存待测。
1.2 试剂与仪器 Clin-TOF-Ⅱ型MS系统及其配套Clin-TOF试剂购自北京毅新博创生物科技有限公司,Bruker Microflex MS系统购自德国布鲁克•道尔顿公司,Bruker基质液根据Bruker配方配制。
1.3 方法
1.3.1 菌株传代 将常规分离的103株菌株置于固体培养基上进行三区划线,用接种环挑取单菌落。
1.3.2 仪器校正 检测前使用大肠杆菌ATCC8739单菌落(购自中国工业微生物菌种保藏管理中心)为标准品进行仪器校正,严格按照仪器使用说明书进行操作。
1.3.3 Clin-TOF试剂预处理供试菌株 每个离心管(200 μl)中加入30 μl组分Ⅰ,采用无菌接种环或枪头挑取单菌落放于离心管中,震荡混匀5 min,加1 μl样品到靶板上,自然干燥后加1 μl组分Ⅱ,覆盖在样品点上,自然干燥后分别使用Clin-TOF-Ⅱ型MS系统和Bruker Microflex MS系统采集图谱并进行鉴定,每个菌株平行检测3次。
1.3.4 Bruker基质液预处理供试菌株 无菌牙签挑取样品单菌落均匀抹在Macro 96孔靶板上,自然干燥后在样品点上覆盖1 μl Bruker基质液,自然干燥后分别使用Clin-TOF-Ⅱ型MS系统和Bruker Microflex MS系统采集图谱并进行鉴定,每个菌株平行检测3次。
1.4 结果判定 Clin-TOF-Ⅱ型MS系统:置信度≥25.0分为鉴定结果可信;置信度为20.0~24.9分需通过其他实验进行验证,选出最终鉴定结果;置信度<20.0分为鉴定结果不可靠,建议重新处理菌株或重新采集样品点测试。Bruker Microflex MS系统鉴定分值2.300~3.000为鉴定在种水平完全可靠;分值2.000~2.299为鉴定在属水平可信;分值1.700~1.999为鉴定在属水平有可能。所有菌株经16S rRNA扩增测序进行验证。
1.5 统计学方法 应用SPSS 10.0统计软件进行数据处理,计量资料以(±s)表示,采用两独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 菌株情况 革兰阴性菌36株,其中产酸克雷伯菌5株、肺炎克雷伯菌3株、摩氏摩根菌3株、黏质沙雷菌3株、阴沟肠杆菌3株、鲍曼不动杆菌2株、铜绿假单胞菌2株、液化沙雷菌2株、嗜麦芽窄食单胞菌2株、副溶血弧菌2株、流感嗜血杆菌2株、皮特不动杆菌1株、弗劳地柠檬酸杆菌1株、大肠埃希菌1株、产气肠杆菌1株、奇异变形菌1株、施氏假单胞菌1株、腐败希瓦菌1株。革兰阳性菌33株,其中纹带棒杆菌2株、鸟肠球菌1株、铅黄肠球菌1株、小肠肠球菌1株、粪肠球菌2株、屎肠球菌1株、单核增生李斯特菌2株、藤黄微球菌2株、空间罗菌1株、无乳链球菌2株、表皮葡萄球菌2株、溶血葡萄球菌2株、人葡萄球菌1株、金黄色葡萄球菌2株、停乳链球菌2株、路邓葡萄球菌2株、腐生葡萄球菌1株、沃氏葡萄球菌2株、解没食子酸链球菌1株、口腔链球菌2株、唾液链球菌1株。真菌34株,其中白色假丝酵母菌2株、链状假丝酵母菌3株、光滑假丝酵母菌2株、希木龙假丝酵母菌3株、平常假丝酵母菌3株、葡萄牙假丝酵母菌3株、Candida nivariensis 3株、近平滑假丝酵母菌3株、热带假丝酵母菌1株、罗伦隐球菌3株、新型隐球菌1株、东方伊萨酵母1株、奥默柯达菌1株、异常毕赤酵母1株、费比恩毕赤酵母1株、季也蒙毕赤酵母1株、胶红酵母菌1株、阿萨希丝孢酵母菌1株。
2.2 质谱图 在Clin-TOF-Ⅱ型MS系统上,采用Clin-TOF试剂预处理供试菌株后所得质谱图基线平滑,特征信号较多,信噪比较高,重现性较好;对较难鉴定的新型隐球菌也能检测出特征信号。使用Bruker基质液预处理供试菌株后,所得质谱图特征信号较少,信噪比较低,多次点样后质谱图重现性较差,见图1。
但哥们儿朝洛蒙想错了。搬家那天就被冰箱砸着了脚趾头,肿得像个白萝卜。到诊所点了药水,缠了些绷带,耽误了半天工,上班时一只脚上还穿着塑料拖鞋,走路一瘸一拐的像装着假肢。
2.3 菌株鉴定结果 在Clin-TOF-Ⅱ型MS系统上,Clin-TOF试剂预处理和Bruker基质液预处理后革兰阴性菌单次鉴定准确率、3次平行鉴定准确率及真菌3次平行鉴定准确率比较,差异无统计学意义(P>0.05);Clin-TOF试剂预处理后革兰阳性菌单次鉴定准确率、3次平行鉴定准确率及真菌单次鉴定准确率高于Bruker基质液预处理,差异有统计学意义(P<0.05,见表1)。在Bruker Microflex MS系统上,Clin-TOF试剂预处理和Bruker基质液预处理后革兰阴性菌单次鉴定准确率、3次平行鉴定准确率,革兰阳性菌单次鉴定准确率、3次平行鉴定准确率,真菌单次鉴定准确率比较,差异无统计学意义(P>0.05);Clin-TOF试剂预处理后真菌3次平行鉴定准确率高于Bruker基质液预处理,差异有统计学意义(P<0.05,见表2)。

3 讨论
质谱图的稳定性和重现性是微生物获得准确鉴定结果的重要影响因素。微生物蛋白指纹图谱的峰型分布受多种因素影响,如培养基、培养时间、处理方法、基质配方等[5-6]。既往研究结果显示,不同基质配方会影响质谱仪出峰情况[7],分析其原因可能与细菌和真菌细胞壁的主要成分及不同菌种细胞壁厚度不同有关。细菌细胞壁的主要成分为肽聚糖,革兰阳性菌的细胞壁厚度为20~80 nm,革兰阴性菌的细胞壁厚度为10~15 nm;真菌细胞壁的主要成分为几丁质和葡聚糖,厚度为100~250 nm[8]。因此,选择合适的基质配方是成功使用MS技术的关键。基质的主要作用是吸收能量传递给样品分子,并保护样品分子不被强烈的激光破坏,减弱样品分子间的相互作用。目前,MS常用的基质配方包括α-氰基-4-羟基肉桂酸(CHCA)、2,5-二羟基苯甲酸(DHB)、蒽三酚(DI)、阿魏酸(FA)、3-吲哚丙烯酸(IAA)、维A酸(RA)、2,4,6- 三羟基苯乙酮(THAP)等[9]。Clin-TOF试剂是根据细菌和真菌细胞壁的特点对预处理基质配方进行优化,利于细胞破壁,降低了人为配置预处理试剂导致的误差,提高了质谱图的稳定性及微生物鉴定准确率。本研究使用的Clin-TOF试剂包括组分Ⅰ和组分Ⅱ,经Clin-TOF试剂预处理后微生物蛋白指纹图谱特征峰更多,基线平滑,信噪比较高,有助于获得更稳定的鉴定结果。
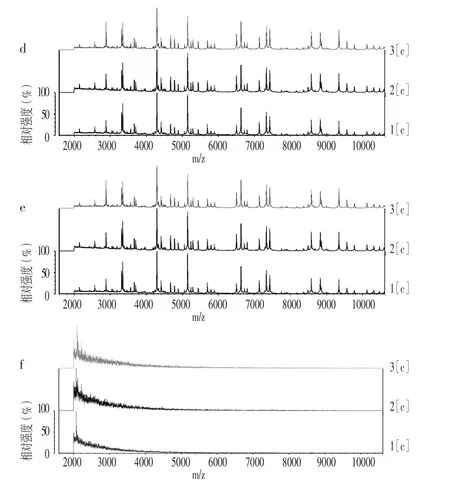
图1 Clin-TOF试剂和Bruker基质液预处理供试菌株后Clin-TOF-Ⅱ型MS系统质谱图Figure 1 Mass spectrogram of Clin-TOF-Ⅱ type MS after pre-processing of Clin-TOF Reagent and Bruker Matrix
表1 不同预处理试剂预处理供试菌株后Clin-TOF-Ⅱ型MS系统鉴定结果比较(±s,%)Table 1 Comparison of identification results on Clin-TOF- Ⅱ type MS between pre-processing of Clin-TOF Reagent and pre-processing of Bruker Matrix

表1 不同预处理试剂预处理供试菌株后Clin-TOF-Ⅱ型MS系统鉴定结果比较(±s,%)Table 1 Comparison of identification results on Clin-TOF- Ⅱ type MS between pre-processing of Clin-TOF Reagent and pre-processing of Bruker Matrix
预处理试剂 革兰阴性菌 革兰阳性菌 真菌单次鉴定准确率 3次平行鉴定准确率 单次鉴定准确率 3次平行鉴定准确率 单次鉴定准确率 3次平行鉴定准确率Clin-TOF 试剂 100.00±0.00 92.59±3.00 100.00±0.00 97.98±2.02 100.00±0.00 98.04±1.96 Bruker基质液 100.00±0.00 96.30±2.21 87.88±5.31 82.83±5.55 64.71±8.32 58.82±8.09 t值 0.000 -1.021 2.101 2.392 4.243 4.710 P值 1.000 0.311 0.044 0.022 <0.001 3.468
表2 不同预处理试剂处理供试菌株后Bruker Microflex MS系统鉴定结果比较(±s,%)Table 2 Comparison of identification results on Bruker Microflex MS between pre-processing of Clin-TOF Reagent and pre-processing of Bruker Matrix
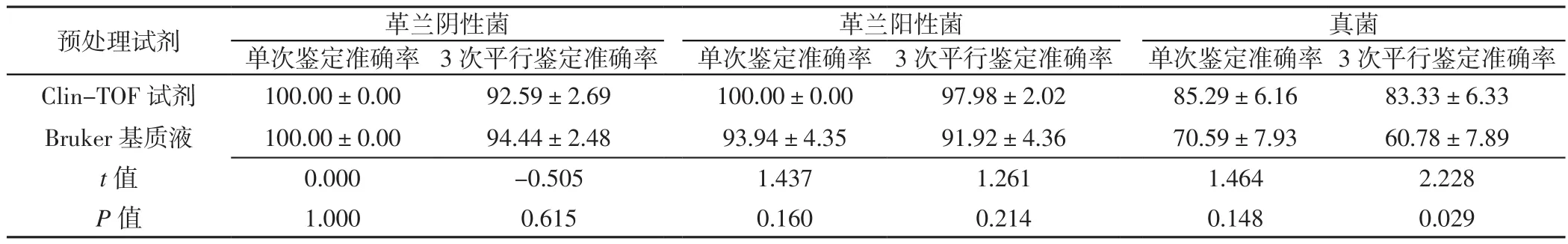
表2 不同预处理试剂处理供试菌株后Bruker Microflex MS系统鉴定结果比较(±s,%)Table 2 Comparison of identification results on Bruker Microflex MS between pre-processing of Clin-TOF Reagent and pre-processing of Bruker Matrix
预处理试剂 革兰阴性菌 革兰阳性菌 真菌单次鉴定准确率 3次平行鉴定准确率 单次鉴定准确率 3次平行鉴定准确率 单次鉴定准确率 3次平行鉴定准确率Clin-TOF 试剂 100.00±0.00 92.59±2.69 100.00±0.00 97.98±2.02 85.29±6.16 83.33±6.33 Bruker基质液 100.00±0.00 94.44±2.48 93.94±4.35 91.92±4.36 70.59±7.93 60.78±7.89 t值 0.000 -0.505 1.437 1.261 1.464 2.228 P值 1.000 0.615 0.160 0.214 0.148 0.029
本研究比较了Clin-TOF试剂与Bruker基质预处理对病原菌鉴定效能的影响,结果显示,在Clin-TOF-Ⅱ型MS系统上,Clin-TOF试剂预处理后革兰阳性菌单次鉴定准确率、3次平行鉴定准确率及真菌单次鉴定准确率高于Bruker基质液预处理;在Bruker Microflex MS系统上,Clin-TOF试剂预处理后真菌3次平行鉴定准确率高于Bruker基质液预处理;提示与Bruker基质液相比,采用Clin-TOF试剂预处理供试菌株后Clin-TOF-Ⅱ型MS系统对革兰阳性菌及真菌鉴定准确率较高,Bruker Microflex MS系统对真菌鉴定准确率较高,分析其原因可能与Clin-TOF试剂有助于菌体蛋白成分释放有关。
综上所述,与Bruker基质液相比,采用Clin-TOF试剂预处理供试菌株后Clin-TOF-Ⅱ型MS系统对革兰阳性菌及真菌鉴定准确率较高,Bruker Microflex MS系统对真菌鉴定准确率较高。此外,采用Clin-TOF-Ⅱ型MS系统及其配套Clin-TOF试剂具有准确、灵敏、快速、高通量等优点,解决了临床微生物鉴定工作成本高、周期长、重复性差等问题,对微生物鉴定工作具有重要意义。

