磷酸铁锂优缺点及改性研究进展*
张克杰,陈 鹏,谢旺旺,蔡 婧,周志萍
(1.江苏省先进结构材料与应用技术重点实验室,江苏南京211167;2.南京工程学院材料工程学院;3.南京理工大学化工学院4.南京大学化学化工学院)
随着人类社会不断发展,人类对能源的需求量越来越大,而煤、石油、天然气等不可再生能源的储量却越来越少。为保证人类社会可持续发展,寻找和开发清洁、高效、可再生能源成为当务之急。锂离子电池作为一种二次电池(可充电电池),在各个行业得到迅速而广泛的应用。其中,具有橄榄石型结构的磷酸铁锂(LiFePO4),由于具有工作电压平稳(3.4V)、比容量较高(170mA·h/g)、放电功率大、可快速充电且循环寿命长、无记忆效应、在高温与高热环境下稳定性好等优点,而成为未来锂离子电池发展方向之一[1-4]。LiFePO4的发展已经给人类社会的发展带来巨大的进步和机遇,尤其是在动力电池领域的发展正悄然改变着人们的出行和生活,可以大大降低人类对化石能源的依赖。虽然LiFePO4优点非常明显,但同时也有严重的缺点,如:电子导电率和锂离子扩散速率较低、振实密度较低、耐低温性能较差等,这严重影响了LiFePO4市场化应用[5-6]。因此,对LiFePO4改性一直是研究的热点。
1 LiFePO4晶体结构与性能之间的关系
结构决定性能,要克服LiFePO4的缺点需要从结构入手深入了解LiFePO4晶体结构与性能之间的关系。LiFePO4在自然界中是以磷酸铁锂矿的状态存在,具有正交橄榄石型结构,晶胞参数a=1.032 9 nm、b=0.600 72 nm、c=0.469 05 nm[7]。 图1 是橄榄石型LiFePO4晶格结构示意图。由图1看出,在FeO6层之间,相邻LiO6八面体利用b方向两个氧原子连接在一起,形成了与c轴平行的锂离子直线链,这使得锂离子可能拥有二维可移动性,在充放电过程中能够脱出和嵌入[8]。在橄榄石LiFePO4晶体结构中P—O共价键具有很强的键能,可以形成离域的三维立体共价键,这使得LiFePO4具有很强的热稳定性[9],在锂电池发生短路时不会因为短路而爆炸。其次,在LiFePO4晶体中Li—O共价键之间也具有很强的键能,这使得LiFePO4在高温下很难释放出氧气,从而大大提高了LiFePO4的高温稳定性。从LiFePO4晶体结构上看,PO4四面体处于FeO6八面体层之间,这妨碍了锂离子自由扩散。此外,相邻FeO6八面体电导率较低,因此LiFePO4晶体结构决定了其只适合在小倍率下充放电,在大电流充放电时容量衰减很快,这严重制约了LiFePO4的应用[10]。
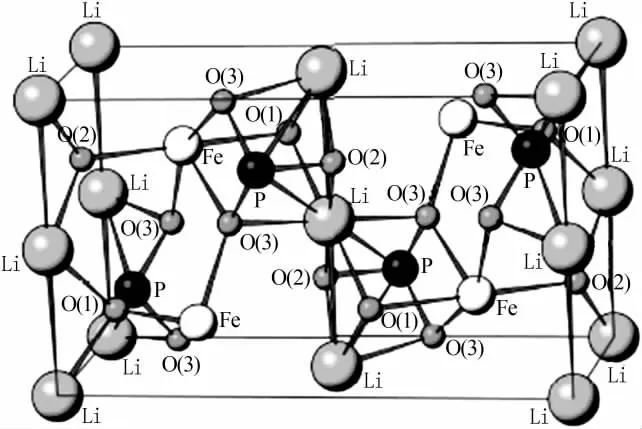
图1 橄榄石型LiFePO4晶格结构示意图[8]
2 LiFePO4充放电机理
LiFePO4充放电反应是FePO4和LiFePO4在正极相互转化反应。LiFePO4脱锂成为FePO4,LiFePO4与FePO4结构非常相似,体积也相近[11]。由于充放电过程中结构和体积变化量很小,由结构和体积变化产生的应力不至于影响原子的堆积方式,所以LiFePO4具有良好的充放电循环性能[12]。LiFePO4电池充放电过程是LiFePO4与FePO4相互转化的可逆反应,电极反应如下[13]:
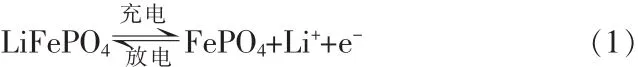
LiFePO4充放电过程要经过液相传质、电极表层吸附、电极表层放电、电极表面转变、新相形成5个步骤[8]。对于LiFePO4电池放电过程,具体步骤(此时正极材料是FePO4):1)锂离子在电化学势驱动下从电解液中迁移到正极表面;2)锂离子冲破双电荷层电势束缚被吸附到正极表面;3)正极材料放电,Fe3+变成Fe2+,达到电中和条件,从外电路得到1个电子,对外做功;4)锂离子通过电化学势进入FePO4晶格;5)锂离子不断向内部扩散,形成新相(LiFePO4)。
3 LiFePO4存在的问题及改性方法
3.1 LiFePO4存在的问题
虽然LiFePO4热稳定性能优异、循环性能好、在使用过程中安全性高,但是其特殊的橄榄石型结构使其电子导电率(10-10~10-9S/cm)[5]低和锂离子扩散速率(1.8×10-14cm2/s)[6]慢,这导致 LiFePO4在高倍率下电化学性能和耐低温性能较差;LiFePO4振实密度较低,导致材料体积能量密度较低,不适合在手机、充电宝等便携电器上使用。目前对LiFePO4改性方法主要有纳米化和球形化、导电碳材料包覆(无定形碳/石墨烯/碳纳米管)、掺杂导电金属离子等方法,笔者还介绍了另外两种最新的改性方法。
3.2 LiFePO4改性方法
3.2.1 纳米化和球形化
制备纳米级颗粒,减小锂离子扩散距离,是提高锂离子扩散速率最好方法。目前减小LiFePO4粒径方法主要有机械球磨[14]、控制煅烧温度[15]、用高比表面积超细导电粒子作为成核促进剂[16]、合成时采用均相前躯体[17]、碳包覆限制晶体生长[18]等。
通过将颗粒纳米化和球形化可以有效提高空间利用率,这是由于规则球形颗粒间没有团聚和粒子架桥现象,可以有效提高LiFePO4振实密度。研究表明,球形颗粒具有良好的分散性和流动性,颗粒表面比较容易包覆均匀、完整、牢固的碳包覆层,有利于通过表面修饰来提高其综合性能。因此,制备球形颗粒是提高LiFePO4材料振实密度的重要思路之一。
雷敏等[19]运用控制结晶法合成了高密度球形前躯体FePO4,再与Li2CO3和葡萄糖混合,采用碳热还原法合成了球形LiFePO4。该球形LiFePO4振实密度高达1.8 g/cm3,且具有优良电化学性能。Wang等[20]将共沉淀法与原位聚合法结合生成了纳米级LiFePO4/C正极材料,得到LiFePO4颗粒尺寸主要分布在 40~50 nm,有一小部分在 100~110 nm,每个颗粒都呈球形且表面都均匀包覆厚度为3~5 nm的无定形碳层,在1C倍率下LiFePO4初始放电比容量为150 mA·h/g,具有优良电化学综合性能。 Liu 等[21]用共沉淀法辅助高温烧结法合成了一维纳米棒结构LiFePO4正极材料。LiFePO4纳米棒直径约为50 nm,由于电子传输距离很短,而且Li+运动被限制在纳米棒尺寸范围内,所以LiFePO4纳米棒具有优良放电比容量,经多次充放电循环电池稳定性依然很好。
3.2.2 包覆导电碳材料
在LiFePO4合成过程中加入导电碳材料,不但可以提高LiFePO4导电性能,还可以控制晶粒尺寸,提高材料充放电循环性能[11]。在LiFePO4表面包覆碳材料有很多作用:提高粒子间电子导电率,减少电池极化;抑制LiFePO4晶粒长大,增大比表面积;充当成核剂,减小产物粒径;发挥还原剂作用,抑制Fe3+生成,提高产品纯度;使得材料和电解质接触充分,保持Li+脱出和嵌入过程中电荷平衡,从而提高LiFePO4电化学性能[22]。
碳包覆方法有两种:一种是原位碳包覆,即在前驱体中加入碳源,在高温焙烧过程中LiFePO4颗粒和在颗粒表面的碳包覆层同步生成;另一种是非原位碳包覆,即在合成出LiFePO4完整晶体后再对其进行碳包覆。原位碳包覆法在高温热解碳化过程中会产生气体,具有一定的造孔作用,可以提高材料的比表面积;同时原位生成的碳可以控制颗粒尺寸,抑制颗粒团聚,提高颗粒之间电子导电率。原位碳包覆法是目前效果最好的碳包覆方法。非原位碳包覆也有一定的优点,在碳包覆前可以合成高纯LiFePO4,但不均匀碳包覆是该方法最大问题。
为实现碳包覆需要添加碳源,这里的碳源通常是指在高温下可以裂解为单质碳的有机物。常用的碳源有葡萄糖[23]、蔗糖[24]、酚醛树脂[25]、聚乙烯醇[26]、淀粉[27]、纤维素[28]、乙二胺四乙酸(EDTA)[29]等。这些物质都是含有碳链的有机物,在隔绝氧气条件下煅烧,发生不完全碳化反应,生成二氧化碳、一氧化碳、水蒸气等气体,同时残留一部分碳包覆在LiFePO4晶体表面,改善材料导电性。
Hsieh等[30]在650℃条件下,运用高温热解法合成了LiFePO4/C,通过控制葡萄糖用量来控制LiFePO4/C样品中含碳量,并研究碳比例对磷酸铁锂电化学性能的影响。分析结果表明:适量碳包覆层可以提高LiFePO4/C电化学性能,但如果葡萄糖添加量过多则会导致LiFePO4颗粒团聚,从而减小Li+扩散速率,使得电荷传递阻抗升高。经过测定,质量分数为2.55%是碳的最佳含量。
黄远提等[31]利用改进碳热还原法,通过两步碳包覆合成了双层碳包覆LiFePO4。结果表明,对前驱体磷酸铁进行碳包覆可以很好地控制双层碳包覆磷酸铁锂颗粒尺寸,双层碳包覆层不会改变磷酸铁锂结构,在0.1C下首次放电比容量为150 mA·h/g,循环50次后样品容量保持率仍有96.1%。这表明双层碳包覆LiFePO4具有良好的电循环稳定性。
3.2.3 掺杂金属离子
掺杂高价态导电金属离子可以显著改善锂离子电池正极材料电化学性能。对于LiFePO4掺杂主要是Fe位和Li位掺杂,常用来掺杂的金属阳离子有Mg2+[32]、Al3+[33]、Ti4+[34]、Zr4+[33]、Nb5+[35]。 当等价金属阳离子取代时,会使晶体键长、键角和键能都发生改变,从而提高材料电化学性能;当异价取代时,会产生离子空缺,在循环过程中可以扩大锂离子扩散路径,加快相变动力学行为,掺杂后可以形成缺陷化合物,从而提高 LiFePO4材料电化学性能[36]。 Li位掺杂可以提高LiFePO4电化学稳定性,但不会提高材料充放电容量;而Fe位掺杂可以使材料产生晶格缺陷,所以Fe位掺杂效果要明显优于Li位掺杂。
谷和云等[37]通过水热反应制备 LiFePO4前驱体,再经过高温焙烧制得了Mg2+掺杂的LiFePO4/C正极材料。分析结果表明,Mg2+均匀掺杂在LiFePO4基体中,使得LiFePO4/C具有较高的放电比容量(0.1C下放电比容量为160.1 mA·h/g)和优越的倍率性能(20C下放电比容量为77.2 mA·h/g);循环伏安特性和交流阻抗结果显示,Mg2+掺杂减小了电荷迁移电阻和极化现象。张培新[38]用化学沉淀法制备了Mg2+、Al3+、Ti4+、V5+和 Ni2+掺杂的 LiFePO4。测试结果表明,少量金属离子掺杂能显著提高LiFePO4高倍率性能,在 2C 倍率下 Li1-xNixFePO4、Li1-xTixFePO4、Li1-xVxFePO4放电比容量都在120 mA·h/g以上,循环20次后容量保持率都在80%以上。主要原因是:掺杂金属离子以固溶体状态存在,并占据了Li位置,改变了晶体中原子间距离和位置,导致Li—O间距离增加,形成了有利于Li+脱嵌的结构。
3.2.4 制备片层LiFePO4
LiFePO4由于独特的橄榄石型结构,其中Li+迁移通道是一维的,沿着(001)晶面移动,这限制了Li+迁移速率。制备片层LiFePO4,使得(001)晶面暴露出来,可以极大地提高Li+迁移速率。
Rui等[39]先以固相反应合成块状 NH4FePO4·H2O,然后运用液相剥离法制备片层状NH4FePO4·H2O,再在高温高压条件下锂化,最终合成片层状碳包覆LiFePO4。制备的样品片层厚度小于5 nm,通过公式t=L2/D计算Li+扩散时间将小于25 μs,相较于块状LiFePO4其Li+扩散时间将小5个数量级,这也导致片层状LiFePO4有很高的容量(0.2C下164 mA·h/g)、库伦效率(98%)、倍率性能(80C 下 90 mA·h/g)和循环性能(循环50次后容量保持率为91.1%),达到了一个很好的电化学综合性能。
3.2.5 改进LiFePO4电极的涂敷工艺
电极材料涂覆工艺对于电池性能有很大影响。涂覆层均匀度、厚度、紧实程度可以在很大程度上影响Li+扩散系数、电极片与电解液接触情况等,从而影响电池电化学性能。目前实验室主要采用手工涂覆,对操作人员熟练度和经验提出很高要求,同时也无法保证产品一致性。所以,找到一种高效、简便的涂覆工艺对提高LiFePO4电池的电化学性能有重要意义。
Hu[40]运用液相共热辅助高温热解法制备了碳包覆 LiMn1-xFexPO4@C(LMFP),以 N-甲基吡咯烷酮为溶剂,将活性材料和XC-72炭黑、聚偏氟乙烯按一定质量比制成浆料,运用3D打印技术将正极浆料涂覆在铝箔上,再将正极片组装成扣式电池进行测试。浆料厚度为18μm,每列宽度为450μm,相较于传统涂覆方法,3D打印得到的涂覆层分布更加均匀,涂覆量易于控制,且工艺相对简单,易于工业化、标准化生产。而且3D打印制备的电极的电化学性能也优于传统涂覆方法得到的电池。
除了3D打印技术以外,旋涂法也可以做到均匀涂敷,而且工艺过程也易于控制。旋涂法工艺过程包括配料、高速旋转、挥发成膜3个步骤,通过控制匀料时间、转速、滴液量以及所用溶液浓度、黏度来控制涂敷层厚度,涂敷层均匀并且不会破坏样品结构。现在也有很多学者运用旋涂法来制备LiFePO4电极,并取得了很好效果[41-45]。
展飞等[41]采用溶胶-凝胶技术与聚苯乙烯(PS)微球模板相结合,在铝基板上成功制备了亚微米连续蜂窝网状LiFePO4薄膜。研究了成膜工艺、涂膜方法及模板球直径等因素对薄膜形貌的影响。研究发现,对于200 nm的PS球模板,采用二次成膜技术工艺获得完好LiFePO4薄膜的最佳方法为旋涂法,可以得到最佳的蜂窝网状的多孔膜结构。
Li[43]以不锈钢为衬底,通过化学溶液沉积法结合旋转涂布工艺制备了高度取向LiFePO4薄膜电极。经检测电池容量为4.9 μA·h/cm2,表观活化能为59.2 kJ/mol。这种方法制备的电池也有很好的成本效益。
4 LiFePO4的前景及应用
针对LiFePO4缺点,诸如表观密度较低、低温下性能较差、高倍率性能较差等问题,近年来已经得到逐步解决。全球已经涌现出众多生产锂离子电池正极材料LiFePO4的企业,仅在中国就有不低于200家企业,其中不乏有像比亚迪、天津力神这样年产能在千吨以上的大型企业。LiFePO4电池材料大幅扩展到了锂离子电池应用领域,由于其较高的热稳定性和安全性,现已成为动力电池主流正极材料之一[46]。这也带动了锂电池与混合动力汽车产业发展。
目前,随着LiFePO4行业的发展,LiFePO4改性技术也在不断发展,而且改性方法不是单一的,针对LiFePO4各种性能和结构缺陷,采用多种改性方法相结合,可以达到一个综合的电化学性能。
在实验室研究方面,已经可以达到LiFePO4理论容量,而工业化生产却面临性能下降、产品性能一致化差等问题,所以采用更合适的涂覆技术和生产方法尤为重要,3D打印和旋涂法是很好的选择。
中国是LiFePO4电池生产大国,但却不是生产强国,高端锂电池技术和生产仍被国外所垄断,再加上目前LiFePO4电池性能并不是十分完美,所以对于LiFePO4改性、优化工艺过程和扩大工业化生产仍是发展锂离子电池产业的努力方向。

