细胞膜合成途径模块化调控与形态改造提高大肠杆菌β-胡萝卜素的积累与产量
武陶,张柏林,毕昌昊
1 北京林业大学 生物科学与技术学院,北京 100083
2 中国科学院系统微生物工程重点实验室,天津 300308
β-胡萝卜素 (β-carotene) 是类胡萝卜素家族中的典型代表,也是生物体内合成维生素 A 的前体物质,具有极强的淬灭单线态氧和清除自由基的作用,广泛应用于化工、食品、保健品以及医药等行业[1-2]。目前,β-胡萝卜素的合成方式主要有化学合成以及天然提取,化学合成具有潜在危险性,而天然提取的β-胡萝卜素产量比较低,因此,近年来微生物细胞工厂合成天然产物越来越受到人们的重视[3]。大肠杆菌遗传背景清楚、操作简单,以大肠杆菌作为出发菌株,运用代谢工程手段构建生产类胡萝卜素的基因工程菌,已成为包括β-胡萝卜素在内的多种类胡萝卜素产品生产的新模式[4-5]。针对生产β-胡萝卜素的底盘细胞的改造,主要包括激活其自身的2-甲基-D-赤藻糖醇-4-磷酸途径 (MEP途径)[6-8],引入外源MVA途径[9-11],提高大肠杆菌合成IPP和DMAPP能力,另外,Alper等[12]通过转座子文库筛选出改造靶点,通过对所选靶点的单基因敲除、双基因敲除以及三基因敲除,达到提高前体物质供给的目的。其中,三基因敲除的菌株,其番茄红素产量与出发菌株相比提高了40%。Kang等[13]通过shot-gun文库筛选出dxs、appY、crI、rpoS等可以增加番茄红素产量的靶点。通过dxs与appY的共表达,番茄红素的产量与对照相比提高了7倍。此外,Zhao等[14]通过调控中央代谢途径,增强 ATP与还原力 NADPH的供给,β-胡萝卜素产量比出发菌株高64%。
虽然改造大肠杆菌生产萜类化合物有20多年的研究,但是以前的研究主要集中在途径改造方面,关于萜类化合物在大肠杆菌细胞中的积累机制的报道很少。萜类化合物属于一类疏水性较强的化合物,绝大部分不能分泌到胞外。其疏水性按照玉米黄素 (Zeaxanthin)、角黄素 (Canthaxanthin)、β-胡萝卜素、番茄红素的顺序依次增加。之前有研究显示疏水萜类化合物有可能和细胞膜结合,积累在膜附近区域,但是未见对疏水萜类化合物在细胞内积累机制的深入研究和明确结论[15]。细胞膜主要由磷脂 (Phospholipid) 和蛋白质 (Protein)组成。细胞膜的磷脂中,70%–80%组分为磷脂酰乙醇胺 (Phosphatidylethanolamines),15%–20%组分为磷脂酰甘油 (Phosphatidylglycerols),剩余5%或更少的部分由心磷脂 (Cardiolipin) 构成[16]。如果通过改造细胞膜形态或细胞形态使细胞膜含量变多,占细胞膜比例较大的磷脂酰乙醇胺的含量可能是细胞膜量的一个限制因素。
前期研究表明,改变细胞膜形态以及增加3-磷酸甘油二酯的供给,均可使细胞膜的量增加,容纳更多的β-胡萝卜素,并提高其产量[17]。然而在之前的研究中,没有系统讨论细胞膜的磷脂中主要组分磷脂酰乙醇胺的合成途径对β-胡萝卜素积累的影响。本研究将磷脂酰乙醇胺的合成途径分为上、中、下游3个模块,对它们的多种表达组合策略进行比较 (图 1)。在前期研究的基础上,通过进一步调控磷脂酰乙醇胺的合成,提高底盘菌CAR016发酵生产β-胡萝卜素的产量。
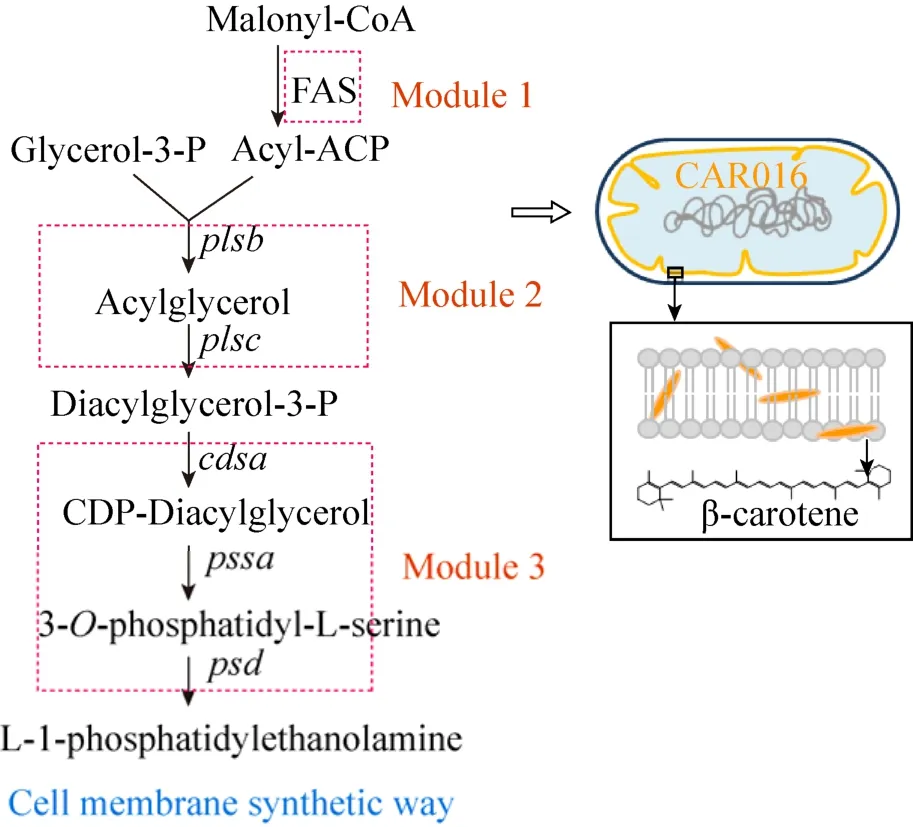
图1 膜工程改造策略 (磷脂酰乙醇胺的合成途径分为上、中、下游 3个模块 (module1-module3),在膜改造细胞中对它们的多种表达组合策略进行比较)Fig. 1 General illustration of our research. The synthesis of phosphatidylethanolamine was divided into three modules and expressed in different combinations to discuss their synergetic effect on CAR016.
1 材料与方法
1.1 材料
1.1.1 试剂
氨苄青霉素、氯霉素,购自生工生物工程 (上海) 股份有限公司;质粒小量快速提取试剂盒购自美国 Axygen 公司;SanPrep柱式PCR产物纯化试剂盒购自生工生物工程 (上海) 股份有限公司;Trans 2K Plus DNA marker、EasyTaqPCR SuperMix DNA 聚合酶购自北京全式金物工程公司;Prime STARTMHS DNA聚合酶购自宝生物工程 (大连) 有限公司;Golden ViewⅠ型核酸染色剂购自北京索莱宝科技有限公司;Phusion TM超保真DNA聚合酶购自NEB公司;β-胡萝卜素标品购自美国Sigma 公司;其他试剂均为分析纯。
1.1.2 仪器与设备
紫外可见分光光度计,Shimadzu UV-2550spectrophotometer (Shimadzu,Kyoto,Japan);PCR扩增仪,Eppendorf Mastercycler gradient;全自动凝胶成像系统,AlphaImager HP;电转仪MicroPulser;台式高速离心机,Eppendorf 5415D;高速冷冻离心机,Thermo Sorvall Evolution RC;高效液相色谱,Agilent Technologies Series1200。
1.1.3 菌株和质粒
本研究所用菌株和质粒见表1。
1.2 方法
1.2.1 培养基及培养方法
LB培养基:1 L培养基包含10 g胰蛋白胨、5 g酵母提取物和10 g氯化钠;氯霉素、硫酸卡那霉素终浓度分别为 34、50 μg/mL。LB固体培养基含1.5%的琼脂。
LB+2%甘油培养基:1 L培养基包含10 g胰蛋白胨、5 g酵母提取物、5 g氯化钠和20 mL甘油。
1.2.2 β-胡萝卜素产量的检测方法
将保存于–80 ℃的菌种在 LB平板上划线活化,挑取单菌落接种到15 mm×100 mm试管 (含4 mL LB培养基) 中,37 ℃、250 r/min培养24 h,后按 1%的接种量转接到 100 mL三角瓶 (含10 mL LB+2%甘油培养基) 中,30 ℃、250 r/min培养48 h。收集菌液用于测定β-胡萝卜素的含量。测定 β-胡萝卜素产量时,先取适量待测菌液,16 200×g离心3 min,无菌水清洗后,用1 mL丙酮悬浮沉淀,在55 ℃黑暗条件下萃取15 min,然后将样品在16 200×g下离心10 min,含有β-胡萝卜素的上清过滤后用于测定β-胡萝卜素的含量。用高效液相色谱测定[8]。
检测条件:VWD检测器,Symmetry C18色谱柱 (250 mm×4.6 mm,5 μm),流动相为甲醇∶乙腈∶二氯甲烷(21∶21∶8),流速1.0 mL/min,时间30 min,柱温30 ℃,检测波长453 nm。每个待测样品分别有3个平行样,实验结果取3个重复的平均值。用购自Sigma公司的β-胡萝卜素标准品构建HPLC标准曲线。
此外,细胞干重(DCW)通过经验公式计算:1OD600= 0.323 g DCW/L。
1.3 磷脂酰乙醇胺含量的测定方法
测定磷脂酰乙醇胺含量时,样品的前处理方法如下:取1 mL待测菌液,与3.75 mL氯仿/甲醇/12 mol/L HCl (2∶4∶0.1,V/V)充分混合后,加入1.25 mL氯仿并涡旋振荡30 s,之后加入1.25 mL纯水并同样振荡30 s。然后将上述样品在5 000×g下离心10 min,将下层的氯仿层取出,并转移至新的Ep管中,后将溶剂吹干,得到样品干粉,用于后续HPLC测定[18]。
检测条件:ELSD检测器,Si-60色谱柱,流动相为正己烷∶异丙醇∶1%乙酸(49.5∶49.5∶1)。柱温30 ℃,流速1.0 mL/min,时间20 min,每个待测样品分别有3个平行样,实验结果取3个重复的平均值。用购自Sigma公司的磷脂酰乙醇胺标品构建HPLC标准曲线。

表1 本研究所用菌株与质粒Table 1 Strains and plasmids used in this work
1.4 Golden Gate法构建质粒
本研究主要以Golden Gate DNA酶切连接方法[19]来构建质粒。首先,采用PCR的方法扩增目的基因片段或载体片段,通过引物将Golden Gate酶切位点埋入片段两端,然后切胶回收得到目的片段,而后在体系加入内切酶BsaⅠ或BsmBⅠ,以及T4 DNA连接酶、T4 DNA连接酶缓冲液等,进行酶切连接;后将得到的Golden Gate反应液转化至工程菌感受态,涂于含有相应的抗生素的平板上,过夜培养得到转化子;最后,设计合适的引物进行菌落PCR验证,并可进一步通过测序证明质粒构建成功。
1.5 数据分析
采用R软件,通过t-test与one-way ANOVA进行数据的显著性分析,*代表试验组与对照组之间的差异 (***P<0.001;**P<0.01;*P<0.05)。
2 结果与分析
2.1 上游合成模块 (Module 1) 对于β-胡萝卜素产量的影响
为了系统讨论细胞膜的磷脂中主要组分磷脂酰乙醇胺的合成途径对 β-胡萝卜素积累的影响,本研究将磷脂酰乙醇胺的合成途径分为上、中、下游3个模块,并对它们的多种表达组合策略进行比较 (图1)。为了保证Acyl-ACP的充足供给,在β-胡萝卜素底盘菌CAR016中过表达上游模块1,即来源于谷氨酸棒状杆菌的脂肪酸合酶 (FAS) 基因。从图 2的发酵结果可看出,模块1在β-胡萝卜素底盘菌CAR016中过表达后,单位细胞的 β-胡萝卜素产量以及 β-胡萝卜素的产量显著提高 (P<0.01),分别达到 13.7 mg/g DCW和44 mg/L。与对照组相比,分别提高35.6%和30.5%。
上述结果表明,上游模块1的过表达可以充分形成Acyl-ACP,从而可以保证有足量的Acyl-ACP被用于下游产物磷脂酰乙醇胺的合成,为储存β-胡萝卜素提供更多的空间,达到提高β-胡萝卜素产量的目的。

图2 上游合成模块1对CAR016发酵产β-胡萝卜素的影响Fig. 2 Effect of module 1 on β-carotene production of CAR016. ***P<0.001.
2.2 中游以及下游膜合成模块 (Module 2,Module 3) 过表达对于β-胡萝卜素产量的影响
将磷脂酰乙醇胺合成途径的中游与下游模块,具体包括两种3-磷酸-甘油-酰基转移酶 (plsb与 plsc) (Module 2)、CDP-甘油二酯合成酶(cdsa)、磷脂酰丝氨酸合成酶 (pssa) 以及磷脂酰丝氨酸脱羧酶 (psd) (Module 3) 过表达。从图3的发酵结果可看出,过表达模块2 (Module 2),β-胡萝卜素产量与单位细胞的β-胡萝卜素产量均有提高,分别为103.5 mg/L和19.8 mg/g DCW[17]。与对照菌株CAR016 (pACYC184-M) 相比,分别提高1.4倍和94.1%。单独过表达模块3 (Module 3),β-胡萝卜素产量与单位细胞的 β-胡萝卜素产量与对照菌株相比,无显著差异,这可能是由于单独强化下游模块时,有可能由于其上游前体3-磷酸-甘油二酯 (Diacylglycerol-3-P) 的供给不足,导致β-胡萝卜素以及单位细胞的 β-胡萝卜素产量没有进一步提高。
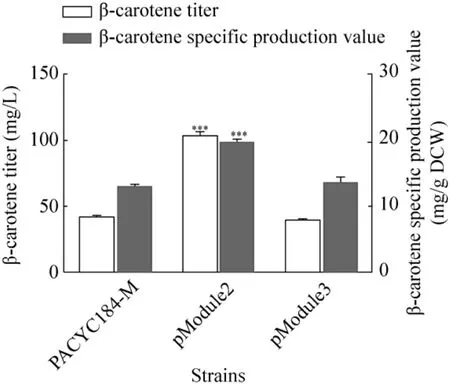
图3 中游以及下游膜合成模块 (Module 2,Module 3)对于CAR016发酵产β-胡萝卜素产量的影响Fig. 3 Effect of module 2 and module 3 on β-carotene production of strain CAR016. ***P<0.001.
上述发酵结果表明,磷脂酰乙醇胺合成途径的中游与下游模块 (Module 2,Module 3) 对于提高β-胡萝卜素的产量有不同的影响。过表达中游模块 2,可以保证细胞内有充足的 3-磷酸甘油二酯,形成适量的磷脂酰乙醇胺,从而形成充足的细胞膜[17],为细胞储存β-胡萝卜素提供了充足的空间,并且提高了β-胡萝卜素的产量。过表达下游模块3时,由于上游前体可能供应不足,导致β-胡萝卜素产量没有明显的提高。
2.3 上、中、下3个模块随机组合对CAR016发酵产β-胡萝卜素的影响
为了进一步强化磷脂酰乙醇胺的合成途径,在单独过表达模块1、模块2、模块3的基础上,将上述3个模块进行随机组合,考察磷脂酰乙醇胺合成途径的上、中、下游3个模块的组合对于CAR016发酵产β-胡萝卜素的影响。
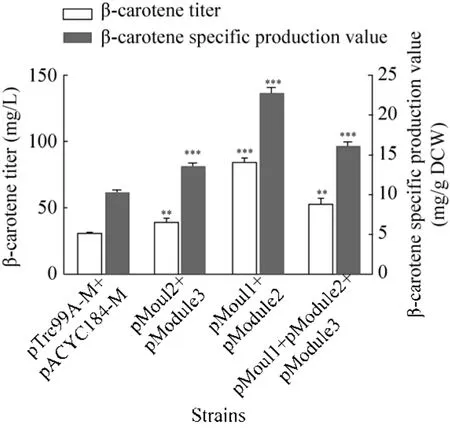
图4 上中下3个模块随机组合对CAR016发酵产β-胡萝卜素的影响Fig. 4 The random combination effect of moudule 1,module 2 and module 3 on β-carotene production of CAR016. ***P<0.001; **P<0.01.
上、中、下游3个模块的3种组合,均可以使β-胡萝卜素的产量以及单位细胞的 β-胡萝卜素产量显著提高 (P<0.001) (图4),但是,模块3与其余模块的组合,菌株的β-胡萝卜素的产量与单位细胞 β-胡萝卜素的产量均低于菌株 CAR016(pModule2) 的产量 (图 3,图 4),并且细胞的生长也会受到一定的抑制。根据上述结果推测,膜折叠蛋白Almgs与模块3之间没有良好的协同作用,在菌株 CAR016中,通过引入膜折叠蛋白Almgs使细胞形态发生了改变[17],而CDP-甘油二酯 (CDP-diacylglycerol) 是合成磷脂酰乙醇胺和心磷脂 (Cardiolipin) 的共同前体[20]。所以,在CAR016中同时过表达模块2和模块3,可能造成磷脂酰乙醇胺过多,磷脂酰乙醇胺与心磷脂等细胞膜各组成磷脂间的比例被破坏,不能很好地形成细胞膜,导致细胞膜的数量下降,β-胡萝卜素的储存空间不足,未能提高其产量。此外,模块3中的3个蛋白可能会影响膜折叠蛋白Almgs的正确定位及其正常功能的发挥,最终影响β-胡萝卜素的产量。而在 CAR016中同时过表达模块 1和模块2后,菌株CAR016 (pModule1,pModule2)的单位细胞β-胡萝卜素的产量为22.3 mg/g DCW(图 4)。与对照菌株 CAR016 (pTrc99A-M,pACYC184-M) 相比,β-胡萝卜素的产量以及单位细胞 β-胡萝卜素的产量分别提高 1.8倍和 1.2倍(P<0.001)。
这一现象表明,磷脂合成的中游途径(Module 2) 与上游脂肪酸合酶途径 (Module 1)的组合,可以进一步加强磷脂酰乙醇胺的合成途径,使细胞膜的数量增加,在膜改造的细胞工厂中为储存β-胡萝卜素提供更多的空间,从而进一步提高β-胡萝卜素的产量。然而模块3与其他模块并不存在有利的加成作用。
2.4 不同改造方式对细胞磷脂酰乙醇胺 (PE)含量的影响
为了进一步研究磷脂酰乙醇胺含量与β-胡萝卜素产量之间的关系,针对前述试验中得到的β-胡萝卜素产量较高的3个菌株,测定其细胞中磷脂酰乙醇胺的含量,具体结果如表2所示。
从表2的测定结果可以看出,磷脂酰乙醇胺合成的上游模块1与模块2同时过表达,与单独表达模块2相比,磷脂酰乙醇胺的含量有提高。模块1、2、3同时共表达,细胞中磷脂酰乙醇胺的含量与模块1、2共表达时没有显著差异。
该结果表明,磷脂酰乙醇胺的含量对β-胡萝卜素的产量有影响,但两者之间并不是严格的正相关关系。
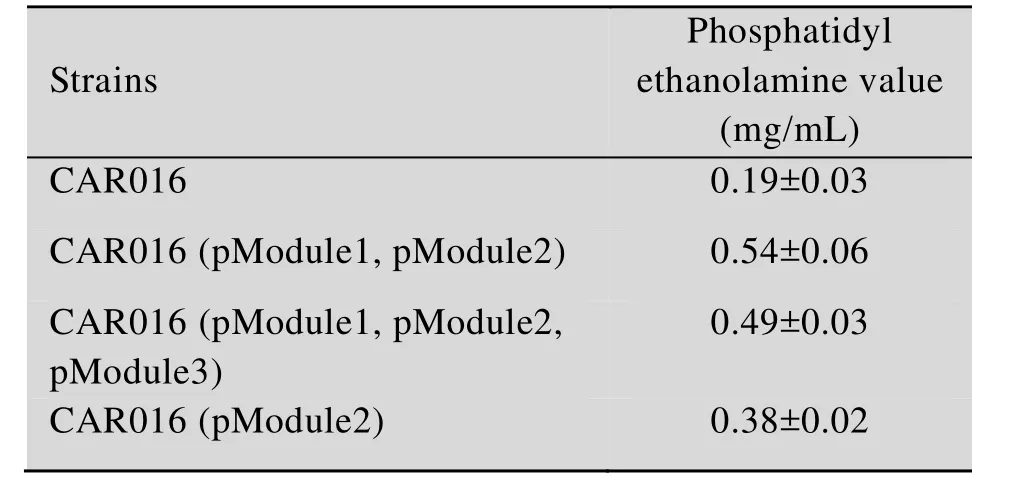
表2 不同模块改造后磷脂酰乙醇胺的含量Table 2 The content of phosphatidyl ethanolamine in different modulation
2.5 上、中两个模块组合对CAR025-37Almgs发酵产β-胡萝卜素的影响
为了进一步证明上游与中游两个模块在增加细胞膜的数量方面有协同作用,将上述两个模块同时导入之前构建的 β-胡萝卜素菌株 CAR025-37Almgs中,考察上、中两个模块对其发酵产β-胡萝卜素的影响。
图5的发酵结果表明,在高产菌株CAR025-37Almgs中同时表达模块 1与模块 2,单位细胞的β-胡萝卜素产量为47.5 mg/g DCW,与对照菌株相比,提高了49.5%。
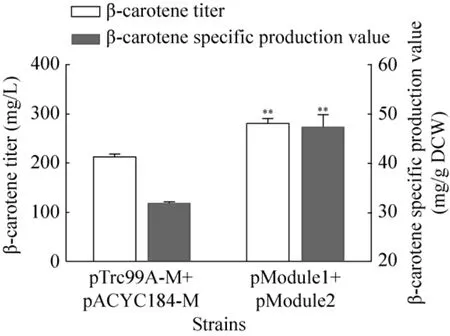
图5 上、中两个模块组合对 CAR025-37Almgs发酵产β-胡萝卜素的影响Fig. 5 The combination effect of Module1 and Module 2 on β-carotene production of CAR025-37Almgs.**P<0.01.
3 结论
本研究在前期研究得到的 β-胡萝卜素高产菌CAR016的基础上,通过引入脂肪酸合酶体系以及磷酯酰乙醇胺中游、下游合成模块,达到强化其合成途径并且保证其上游前体物质供应充足的目的。研究表明,在CAR016中同时过表达模块1和模块 2,单位细胞 β-胡萝卜素的产量为 22.3 mg/g DCW,是本研究中的最高产量菌株 (图 6),通过模块化优化,改造菌株比出发菌株产量提高了118.6%。强化磷酯酰乙醇胺的上游 (Module1) 及中游 (Module 2) 合成模块,可以产生更大量的细胞膜,为储存 β-胡萝卜素提供更多的空间,同时进一步提高 β-胡萝卜素的产量。针对细胞膜的形态以及合成途径进行模块化改造,可以作为今后提高类胡萝卜素和其他疏水化合物产量的新方向。
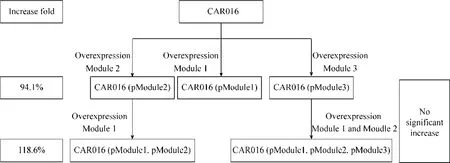
图6 细胞膜合成途径模块化调控对膜改造细胞工厂β-胡萝卜素单位细胞产量的影响Fig. 6 Diagram summarizing the increase of β-carotene specific production obtained through modularized engineering of membrane synthesis.
[1]Giovannucci E, Ascherio A, Rimm EB, et al. Intake of carotenoids and retinol in relation to risk of prostate cancer. JNCI, 1995, 87(23): 1767–1776.
[2]Malvy DJM, Burtschy B, Arnaud J, et al. Serum beta-carotene and antioxidant micronutrients in children with cancer. Int J Epidemiol, 1993, 22(5): 761–771.
[3]Lee P, Schmidt-Dannert C. Metabolic engineering towards biotechnological production of carotenoids in microorganisms. Appl Microbiol Biotechnol, 2002,60(1/2): 1–11.
[4]Lemuth K, Steuer K, Albermann C. Engineering of a plasmid-freeEscherichia colistrain for improvedin vivobiosynthesis of astaxanthin. Microb Cell Factor, 2011,10(1): 1–12.
[5]Albermann C, Trachtmann N, Sprenger GA. A simple and reliable method to conduct and monitor expression cassette integration into theEscherichia colichromosome. Biotechnol J, 2010, 5(1): 32–38.
[6]Choi HS, Lee SY, Kim TY, et al.In silicoidentification of gene amplification targets for improvement of lycopene production. Appl Environ Microbiol, 2010,76(10): 3097–3105.
[7]Jin YS, Stephanopoulos G. Multi-dimensional gene target search for improving lycopene biosynthesis inEscherichia coli. Metab Eng, 2007, 9(4): 337–347.
[8]Yuan LZ, Rouviere PE, LaRossa RA, et al.Chromosomal promoter replacement of the isoprenoid pathway for enhancing carotenoid production inE. coli.Metab Eng, 2006, 8(1): 79–90.
[9]Yoon SH, Lee SH, Das A, et al. Combinatorial expression of bacterial whole mevalonate pathway for the production of beta-carotene inE. coli. J Biotechnol,2009, 140(3/4): 218–226.
[10]Martin VJJ, Pitera DJ, Withers ST, et al. Engineering a mevalonate pathway inEscherichia colifor production of terpenoids. Nat Biotechnol, 2003, 21(7): 796–802.
[11]Yoon SH, Park HM, Kim JE, et al. Increased β-carotene production in recombinantEscherichia coliharboring an engineered isoprenoid precursor pathway with mevalonate addition. Biotechnol Prog, 2007, 23(3):599–605.
[12]Alper H, Jin YS, Moxley JF, et al. Identifying gene targets for the metabolic engineering of lycopene biosynthesis inEscherichia coli. Metabol Eng, 2005,7(3): 155–164.
[13]Kang MJ, Lee YM, Yoon SH, et al. Identification of genes affecting lycopene accumulation inEscherichia coliusing a shot-gun method. Biotechnol Bioeng, 2005,91(5): 636–642.
[14]Zhao J, Li QY, Sun T, et al. Engineering central metabolic modules ofEscherichia colifor improving beta-carotene production. Metab Eng, 2013, 17: 42–50.
[15]Doshi R, Nguyen T, Chang G. Transporter-mediated biofuel secretion. Proc Natl Acad Sci USA, 2013,110(19): 7642–7647.
[16]Cronan JE Jr, Rock CO. Biosynthesis of membrane lipids.EcoSal Plus, 2008, 3(1). DOI: 10. 1128/ecosalplus. 3.6.4.
[17]Wu T, Ye LJ, Zhao DD, et al. Membrane engineering—a novel strategy to enhance the production and accumulation of β-carotene inEscherichia coli. Metabol Eng, 2017, 43: 85–91.
[18]Tan ZG, Khakbaz P, Chen YX, et al. EngineeringEscherichia colimembrane phospholipid head distribution improves tolerance and production of biorenewables. Metabol Eng, 2017, 44: 1–12.
[19]Hillson NJ, Rosengarten RD, Keasling JD. j5 DNA assembly design automation software. ACS Synth Biol,2012, 1(1): 14–21.
[20]Raetz CR, Dowhan W. Biosynthesis and function of phospholipids inEscherichia coli. J Biolog Chem, 1990,265(3): 1235–1238.

