门静脉主干内径与肝硬化并发急性肾损伤的关系研究
王 旭,张 炜,吴永贵
急性肾损伤(acute kidney injury, AKI)是肝硬化患者常见的并发症,并对患者的预后产生重要的影响[1]。肝硬化的重要特征之一是门静脉高压,肝静脉压力梯度(hepatic venous pressure gradient, HVPG)是目前公认的诊断门静脉高压症的金标准。鉴于其为有创检查,不仅存在穿刺风险,且对操作者有较高的技术要求,目前多应用于临床科研工作。超声检查具有操作简单、安全、经济等特点,超声下所见门静脉系统的形态和血流动力学变化是诊断门静脉高压症的直接证据。门静脉扩张(≥13 mm)、门静脉内血液反流和侧支循环开放诊断门静脉高压症的特异度可达100%[2]。该研究通过超声检测肝硬化患者的门静脉主干内径(portal vein diameter,PVD),探讨门静脉高压在肝硬化患者并发急性肾损伤中的作用。
1 材料与方法
1.1病例资料选取2016年1月~2017年6月安徽医科大学附属安庆医院消化内科住院的84例肝硬化并发AKI的患者作为AKI组(男 ∶女=49 ∶35),年龄41~88(66.43±10.97)岁,根据Child-Pugh评分A级3例,B级45例,C级36例;AKI 1级62例,AKI 2~3级共22例。选取60例同期住院的肝硬化无AKI发生的患者为对照组(男 ∶女=38 ∶22),年龄35~82(58.22±12.85)岁,根据Child-Pugh评分A级5例,B级46例,C级9例。将AKI组分为门静脉高压组(PH组,PVD≥13 mm)53例和非门静脉高压组(非PH组,PVD<13 mm)31例,其中PH组男30例,女23例,年龄41~84(63.04±10.54)岁;非PH组男19例,女12例,年龄54~88(72.53±9.14)岁。 本研究经安徽医科大学附属安庆医院伦理委员会批准,受试对象均签署知情同意书。
纳入标准:① 肝硬化:由消化内科主治及以上级别医师依据肝活检,或综合生化检查、影像学检查及内镜检查结果作出诊断(无肝活检结果时);② AKI:依据2015年国际腹水协会(ICA)与急性透析质量倡议工作组(ADQI)提出的针对肝硬化患者的AKI诊断标准[3]:① AKI定义为48 h内血肌酐值(serum creatinine,SCr)升高≥26.5 μmol/L或基线肌酐值上升≥50%(基线肌酐的定义:3个月内稳定的血肌酐值;若缺失,则选用最近一次的稳定的血肌酐值;若仍缺失,则选用入院时的血肌酐值);② AKI进展定义为进展到更高的AKI等级或需要肾脏替代治疗。
排除标准:① 明确诊断为布加氏综合征的患者;② 恶性肿瘤晚期转移的患者;③ 已行TIPS手术的患者;④ 既往诊断为慢性肾脏病3~5期慢性肾脏病及已经行肾脏替代治疗的患者;⑤ 有实体脏器移植史的患者;⑥ 人免疫缺陷病毒感染患者。
1.2方法
1.2.1PVD检测接受检测患者至少禁食8 h,多普勒超声(Mindray DC-7)检查仪探头频率为3.5~5 MHz,取样容积为2~6 mm,采用腹部血流模式。
1.2.2一般情况及生化检查所有患者入院后空腹采集静脉血,行全血细胞分析(日本 XE-2100 型全自动血液分析仪)、肝肾功能、电解质及C反应蛋白(瑞士Modular DPP型全自动生化分析仪)、凝血象常规(ACL TOP-700全自动血凝分析仪)等实验室检查,同时详细询问高血压、糖尿病、慢性肾脏病等病史,记录生命体征等数据,并根据病情安排CT或胃镜检查。
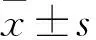
2 结果
2.1AKI组和对照组一般资料及PVD比较AKI组PVD水平和糖尿病、感染、肝性脑病及中、重度腹水发生率均高于对照组,差异有统计学意义(P<0.05),见表1。
2.2肝硬化并发AKI危险因素的多因素二元Logistic回归分析将PVD、糖尿病、感染、腹水(中、重度)、肝性脑病等作为自变量, 是否发生AKI作为因变量进行多因素二元Logistic 回归分析。结果显示,在控制各项因素后,PVD增宽、糖尿病、感染、腹水(中、重度)仍是肝硬化并发AKI的危险因素(表2)。
2.3PH组与非PH组各项生理生化指标的比较PH组年龄、平均动脉压、血小板总数(the total number of platelets,PLT)、纤维蛋白原(fibrinogen,Fib)、白蛋白(albumin,ALB)、胆碱酯酶、血钠均低于非PH组,差异有统计学意义(P<0.05);Child-Pugh评分、血浆凝血酶原时间(prothrombin time,PT)、血浆凝血酶原国际标准化比率(international normalized ratio,INR)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)均高于非PH组,差异有统计学意义(P<0.05)。见表3。
2.4PVD水平和AKI组平均动脉压、ALB、血钠、胆碱酯酶的相关性分析Pearson相关性分析结果显示,PVD 与AKI组的平均动脉压、ALB、胆碱酯酶、血钠水平呈负相关性(P<0.05),见表4。

表1 AKI组和对照组一般资料及PVD的比较

表2 肝硬化并发AKI危险因素的多因素二元Logistic回归分析

表3 PH组与非PH组各项生理生化指标的比较

表4 AKI组PVD与平均动脉压、ALB、血钠、胆碱酯酶

表5 PH组与非PH组AKI进展及三月死亡率对比[n(%)]
3 讨论
随着肝硬化发病率的增加,肝硬化并发AKI越来越受到关注。 据估计AKI在住院肝硬化患者中的发病率约为20%[4]。关于肝硬化并发AKI的发病机制在过去十余年被广泛讨论,Wong[5]认为大多数肝硬化并发AKI本质上以功能性损害为主,不伴或伴有轻度结构性损害。Rognant[6]提出肝硬化并发AKI的始动因素与门静脉高压密切相关,本研究显示PVD增宽可能是肝硬化并发AKI的独立危险因素。肝脏血供大约3/4由门静脉提供,约1/4由肝动脉提供,二者都流经肝窦,最终汇入下腔静脉,故增加肝窦阻力会产生门静脉高压。并且当肝窦阻力增加时,肝动脉的血流会经周围血管丛流向门静脉,促进门静脉压进一步升高[7]。肝硬化时,病毒、药物、免疫等多种因素会促进肝星状细胞激活并释放大量胶原沉积在Disse腔,使其变宽而肝窦变窄,造成门静脉高压。门静脉阻力增加及血流增加是门静脉高压的主要病理生理变化[8]。同时,由于一氧化氮的生成增加导致内脏血管扩张,其与门静脉高压共同促进了腹水的形成[9]。在肝硬化初期,心输出量代偿性增加,机体有效循环血容量尚能维持稳定;随着肝硬化进展,内脏动脉继续扩张,而心输出量无法进一步增加,有效循环血量则明显下降,继而交感神经系统兴奋、肾素-血管紧张素-醛固酮系统激活及精氨酸加压素(AVP)释放,造成肾血管的收缩及钠水潴留,严重时引起AKI[7]。
本研究显示,与非PH组相比,PH组血钠水平更低。且在所有发生AKI的患者中,血钠水平与PVD呈负相关性。肝硬化患者易出现低钠血症,其主要是由于AVP释放增加导致[10],AVP使集合管主细胞内水通道蛋白AQP2与细胞管腔膜融合,从而增加了对水的重吸收导致水潴留,产生稀释性低钠血症。低钠血症会进一步引起有效循环血量不足,最终导致功能性AKI的发生。同时低钠血症是肝硬化腹水患者并发自发性腹膜炎的独立危险因素[11],而自发性腹膜炎会促进AKI的发生。另一个与有效循环血量密切相关的因素是血浆白蛋白水平,血浆白蛋白不仅在维持血浆胶体渗透压上担任重要角色,并且是肝硬化患者易发感染的重要原因之一。还有学者认为,白蛋白具有结合血管扩张剂如一氧化氮的能力[12]。本研究显示,PH组较非PH组ALB水平更低,且血ALB水平与PVD呈负相关性。
门静脉高压而非肝细胞衰竭被认为是肝硬化患者发生各种并发症及死亡的根本原因[13],这与本研究PH组患者AKI进展率及三月死亡率显著高于非PH组的结果一致。食管静脉曲张、腹水及肝性脑病的形成均与门静脉高压相关,而消化道出血、大量放腹水、利尿剂、感染则是临床上常见的肝硬化患者发生急性肾损伤的诱因,故对肝硬化门静脉高压患者加强监测十分必要,尤其是合并有肾功能不全的患者。
综上所述,PVD增宽可能是肝硬化并发AKI的独立危险因素,并与住院期间AKI进展及患者预后密切相关。但鉴于本研究为单中心研究,且研究对象只含住院患者,故仍需进一步扩大研究范围以确定其临床价值。
参考文献

