关于中学化学中竞争反应先后顺序的讨论
范书宁 吴星 吕琳
摘要: 中学化学教学中对竞争反应先后顺序的讨论存在认识误区。从化学热力学、动力学视角对中学化学中竞争反应先后顺序问题进行理论分析,指出在中学化学教学中应谨慎讨论竞争反应先后顺序问题,建议将竞争反应置于有应用意义的真实情境问题解决中学习,有利于提高学生的核心素养。
关键词: 竞争反应; 热力学分析; 动力学分析; 教学策略
文章编号: 1005-6629(2018)4-0091-04 中图分类号: G633.8 文献标识码: B
1 问题的提出
在中学化学教学中,经常听到老师们讲“反应的先后顺序”,如溶液中一种氧化剂与多种还原剂的反应,溶液中一种酸(碱)性物质与多种碱(或酸)性物质反应等。许多老师告诉学生: 这是多种反应同时存在的竞争反应,遵循“谁强谁先”的原则。笔者查阅了相关文献资料[1~2],发现多数研究者认为,竞争反应存在先后顺序并遵循“谁强谁先”的原则,也有文献从生成物的性质视角提出“遵循生成物谁弱谁先”的原则。
由于中学化学中所讨论的物质性质的强弱主要有酸碱性的强弱、氧化性和还原性的强弱,因而,在中学化学教学中存在的反应先后顺序问题的讨论主要集中在氧化还原竞争反应、酸碱竞争反应和上述两种反应类型混合的竞争反应中。例如: (1)氯气与含有Fe2+、 Br-、 I-溶液的反应;(2)盐酸与NaHCO3、 CH3COONa溶液的反应;(3)少量NaOH与NH4HCO3溶液的反应;(4)盐酸与CuO、铁粉的混合物反应等。教师普遍认为上述反应也是遵循强者优先反应的原则。
应该说,在中学化学课程中讨论竞争反应的先后顺序是比较困难的,存在着动力学因素和热力学因素的影响。为了对中学化学中竞争反应的先后顺序有一个比较清晰的认识,本文对竞争反应的先后顺序问题进行理论分析,以期对中学化学教学中相关问题的教学和讨论有所帮助。
2 竞争反应先后顺序的理论分析
竞争反应又称为平行反应。根据化学竞争反应是否存在后续反应,在中学化学中可将竞争反应分为两类: (1)不存在后续反应的竞争反应,即一种反应物平行地与其他反应物反应,反应得到的生成物不能发生进一步反应。例如: 稀硫酸与镁粉和铁粉的反应;(2)存在后续反应的竞争反应,即一种反应物平行地与其他反应物反应的同时,反应得到的生成物又可与某一种反应物进一步反应。例如: 氯气与FeBr2溶液的反应,氯气与Br-发生反应生成Br2,生成的Br2又可以与Fe2+进一步发生反应;NaOH与NH4HCO3溶液反应,NH+4与OH-反应生成NH3·H2O, NH3·H2O又可以与HCO-3进一步发生反应。
竞争反应的先后顺序问题严格意义上属于化学反应动力学讨论的范畴,需要通过动力学实验测定,以确定竞争反应中谁快谁慢,这样得到的反应“先后顺序”可称为反应的动力学顺序。但任何一个化学反应都存在反应限度,反應限度可用化学平衡常数来度量,反应的平衡常数大说明反应进行的完全程度大。因而就产生了竞争反应的先后顺序问题两种讨论的视角: 热力学分析和动力学分析。
2.1 化学竞争反应的热力学分析
竞争反应的先后顺序遵循“谁强谁先”的原则,是来自于反应的热力学分析结果。
在相同条件下,无论是竞争反应中的平行反应还是后续反应,其任何一个反应进行的完全程度都可用ΔG判断。由于中学化学中讨论的竞争反应绝大多数是在溶液中进行的,可粗略地用反应的ΔGθ来度量反应进行的程度,由于ΔGθ=-RTlnK,同样可以用反应平衡常数来度量反应进行的程度。
一般氧化还原反应可表示为:
氧化剂1+还原剂2还原剂1+氧化剂2
在298K、所有物质的浓度为1.0mol/L、所有气体的压强为1.1×105Pa时,其平衡常数可通过公式(1)、(2)计算。根据表1的电极电位的数据,计算出的常见氧化还原反应的平衡常数见表2。
Eθ=φθ氧化剂1/还原剂1-φθ氧化剂2/还原剂2(1)
ΔGθ=-nFEθ=-RTlnK(2)
表1 常见电极反应的标准电极电位
表2 常见氧化还原反应的平衡常数
由计算公式(1)、(2)可知,氧化还原反应的平衡常数与氧化剂和还原剂的标准电极电位有关,而标准电极电位可作为对氧化态氧化性强弱或还原态还原性强弱的标度。因此对氧化还原反应,氧化剂的氧化性越强(标准电极电位正值越大)、还原剂的还原性越强(标准电极电位负值越大),反应的平衡常数越大,反应进行的程度越大,或者说反应进行得越完全。
根据酸碱质子理论,一般酸碱反应可表示为:
酸1+碱2碱1+酸2
反应进行的程度同样可由反应的平衡常数来度量。由于反应的平衡常数与作为反应物的酸和碱的电离常数有关,酸和碱的电离常数越大(酸的酸性和碱的碱性越强),酸碱反应的平衡常数越大,反应进行得越完全。表3给出了常见酸、碱的电离常数及其酸碱反应的平衡常数。
表3 常见酸、碱的电离常数及反应的平衡常数(20℃)
由此可得到结论,对氧化还原反应类和酸碱反应类竞争反应,其基本规律是“谁强谁反应越完全”,并非是“谁强谁先反应”。有时“谁强谁反应越完全”也可能会产生“谁强谁先反应”的结果,这只能说明某些反应的动力学顺序与热力学顺序是一致的,决不能理解成“谁强谁反应越完全”必然导致“谁强谁先反应”的结果。
2.2 化学竞争反应的动力学分析
化学反应的先后顺序问题,从本质上说是反应速率快慢的问题。若反应体系中存在两个竞争反应,且一个反应的速率很大,另一个反应的速率很小,在宏观上将会表现为反应速率大的反应“先”反应,反应速率小的“后”反应。
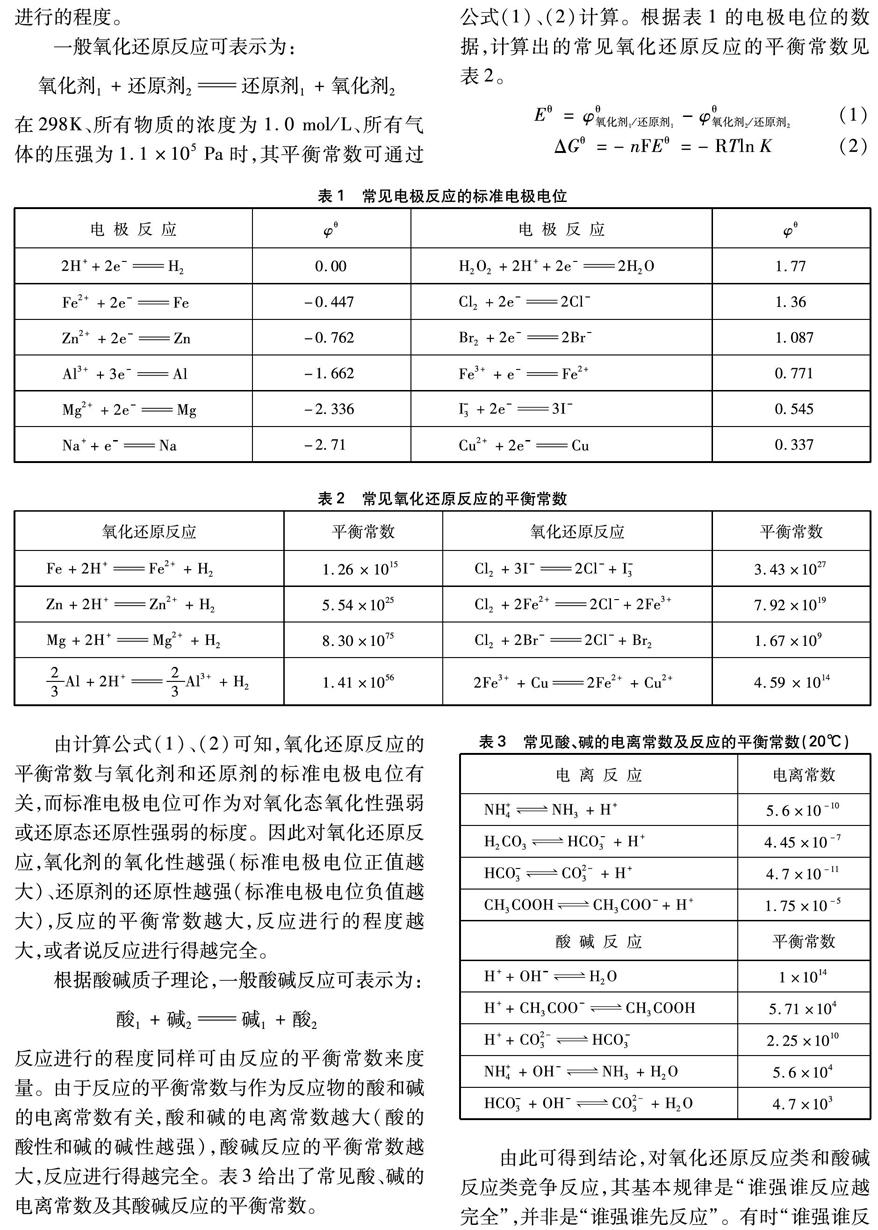
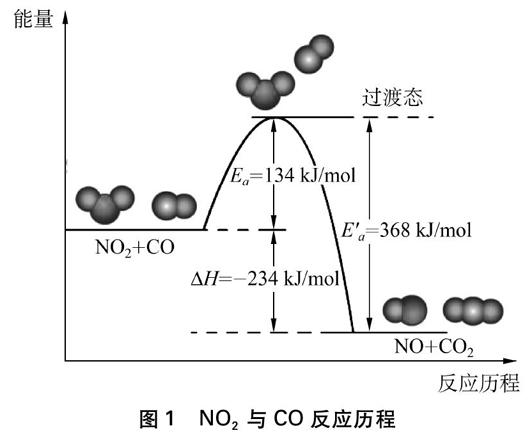
根据反应速度的碰撞理论和过渡状态理论,化学反应发生的先决条件是能量高的反应物分子(活化分子)在合适的方位上发生有效碰撞,生成高能的、由反应物分子以一定构型构成的过渡态(也称活化络合物),过渡态转化为反应物并释放出能量(NO2与CO反应的历程如图1)。
在1889年,阿伦尼乌斯在总结了大量实验结果的基础上,创立了化学反应速率常数随温度变化关系的经验公式: k=Ae-EaRT。说明在其他条件(温度、浓度、压强)相同的情况下,反应速率的快慢是由反应活化能大小决定的,而反应的活化能与反应物的性质、反应机理有关。
图1 NO2与CO反应历程
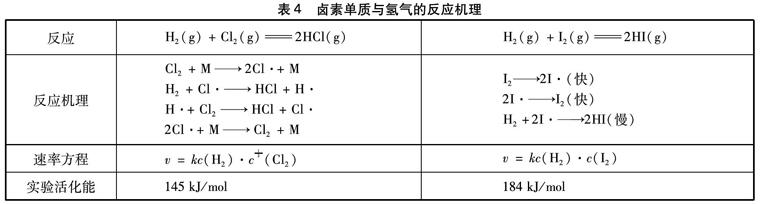
讨论反应的活化能与反应物性质的关系是非常复杂的。因为仅基元反应活化能才有明确的物理意义。而多数反应都不是基元反应,反应机理比较复杂,需要通过实验测定。例如,氢气分别与氯气、碘单质的气相反应,看似类似的反应,实验测得其反应机理却不相同(见表4)。虽然氢气与氯气比氢气与碘单质的反应的活化能小、反应速率快,其反应速率大小与氯气、碘分子的氧化性强弱顺序相一致,但从反应机理看,这与氯、碘分子的氧化性强弱、键能大小没有必然的联系。
表4 卤素单质与氢气的反应机理
根据实验中观察到的宏观现象推论竞争反应的先后顺序是不严密的。许多溶液中进行的反应,反应速率都很快,能快速达到平衡状态。例如,氯水与I-、 Br-的反应和溴水与I-的反应都是快速的,将氯水滴加到KI、 KBr混合溶液中,宏观上观察到的现象是有碘单质生成,但理论和实验的结果都得不到“氯水没有与Br-反应”的结论。一种可能的解释是: 将氯水滴加到KI、 KBr混合溶液中,氯水与I-、 Br-均发生了反应,但生成的Br2又迅速与I-反应生成Br-和I2,因而实验中宏观上观察不到Br2的生成。
综合上述分析,可以得到下列结论: 化学反应速率的快慢与反应机理和反应物的性质有关,一些反应的速率快慢顺序与反应物的性质强弱顺序虽然可能是一致的,但反应物的性质强弱并非一定是决定反应速率快慢的本质原因。
3 结论和启迪
(1) 物质的化学性质是物质在化学变化中表现的性质,物质的性质与物质的结构存在着必然的联系。虽然物质的结构、性质与化学反应速率的快慢、反应進行的程度等存在必然的联系,但不一定都可以归纳概括得到反应先后顺序的一般规律。
(2) 竞争反应的先后顺序是比较复杂的问题,属于化学动力学的范畴,需要通过定量动力学实验研究确定反应机理。对于许多快速、存在后续反应的竞争反应,实验中观察到的现象已经是平衡态表现出来的现象,并不能用于判别反应的先后顺序,因此,中学化学教学中应谨慎讨论存在后续反应的竞争反应的先后顺序。
(3) 在中学化学教学中,我们经常根据同类反应物反应的剧烈程度来探讨反应物的性质强弱,如根据Na、 Mg、 Al与水反应剧烈程度说明Na、 Mg、 Al的金属性的强弱,根据Mg、 Fe与酸反应剧烈程度说明Mg、 Fe的金属活动性的强弱。这说明某些反应的热力学顺序与动力学顺序是一致的。通过“反应的剧烈程度”这一宏观现象,帮助学生认识物质的某一特定性质是可取的,但不能将此类比迁移到竞争反应的先后顺序上。
(4) 在化学实际应用中的确存在对竞争反应的讨论,通常通过选择反应物的种类、控制反应物的量、选择适量的反应条件(温度、催化剂、溶剂等),使竞争反应中的某一反应的速率加快或减慢,如镀锌铁皮厚度测定时,加入适量的六次甲基四胺以减慢铁与盐酸反应的速率。因此,中学化学教学应将竞争反应置于有应用意义的真实情境问题解决中学习,让学生形成“控制反应条件可使反应朝着人们期望的方向发展”的观念。
参考文献:
[1]王书斌.高考热点——离子反应先后次序的探究[J].化学教学, 2008,(7):59~61.
[2]刘晓愚,丁伟,宗华.铁粉和氧化铜与足量稀硫酸反应的实验探究[J].化学教学, 2017,(6):76~78.
[3]徐益宏.小切口、大挖掘二轮复习小课题研究——以“非氧化还原反应先后顺序的判断”为例[J].中学化学教学参考, 2016,(24):67~68.
[4]肖中荣.铵根、碳酸氢根和氢氧根反应的先后顺序究竟如何[J].化学教育, 2014,(11):67~69.
[5]傅献彩等.物理化学[M].北京: 高等教育出版社, 2005.

