基于思维导图的问题解决思维模型的建构
岳庆先
摘要: 以电解质溶液问题为例,介绍电解质溶液的知识体系图像,建构常见相关问题的思维导图和解题的思维模型,并给出基于思维导图的问题解决思维模型示例,具有一定实效性。
关键词: 思维导图; 思维模型; 电解质溶液; 化学教学探讨
文章编号: 1005-6629(2018)4-0081-06 中图分类号: G633.8 文献标识码: B
电解质溶液基本原理是高中化学最基础、最核心的教学内容之一[1],其中水溶液中的离子平衡在高考选择题中属于必考内容,试题主要考查弱电解质的电离平衡,溶液pH的含义与计算,溶液pH及微粒浓度的大小比较,溶液中微粒浓度的关系,难溶电解质的溶解平衡,Ksp的含义与计算等。这类试题大多以图像为载体,要求考生从图像中获取信息、整合信息、应用信息分析问题和解决问题,综合性强,难度较大。表1是近五年对某省考生关于全国理科综合能力测试中电解质溶液图像问题的答题抽样调查情况[2~5]。
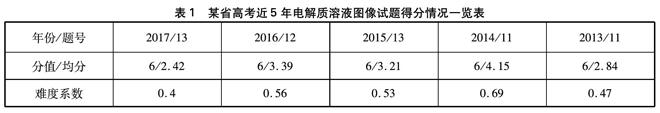
表1 某省高考近5年电解质溶液图像试题得分情况一览表
表中显示,考生涉及这部分知识的答题情况很不理想, 2017年的13题难度系数低至0.4!调研显示很多考生并不是对电解质知识不理解,而是对考查知识出现的形式感到陌生,找不到解决问题的切入点,解题不知如何下手。
思维导图又叫心智图[6],是由英国“记忆之父”东尼·博赞在上世纪60年代发明的思维工具,它运用图文并重的技巧,将各级主题的关系用相互隶属与相关的层级图表现出来,把主题关键词与图像、颜色等建立关联,是一种表达发散性思维的有效图形工具。将这种思维工具应用于高三复习备考,可以帮助考生快速理顺知识之间的逻辑关系,快速判断解决问题的思考角度和方向,快速调用解决问题所需知识,提高复习备考效率。
1 电解质溶液知识体系的建构
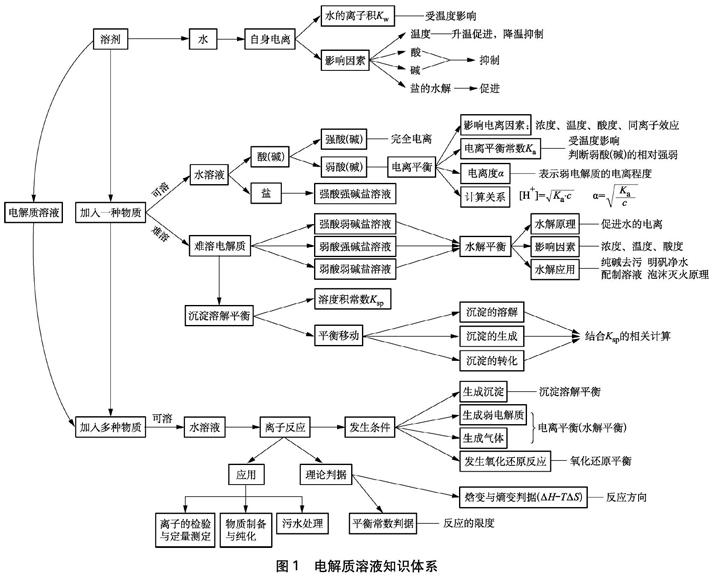
中学研究的大都是电解质的水溶液。水作为一种溶剂,本身发生自身电离,但自身电离的程度很小,温度一定时其电离的[H+]与[OH-]的乘积是一个常数。在溶剂水中加入电解质可以形成电解质溶液。如果是弱电解质,则存在弱电解质的电离平衡,其电离程度的大小可以用电离平衡常数Ka或电离度α表示;如果是可以水解的盐,则盐电离的某些离子会与水电离的H+或OH-结合生成弱电解质而使溶液呈酸性或碱性;如果是难溶电解质,则在溶液中存在沉淀溶解平衡;如果是两种或两种以上的电解质,则电解质溶液之间可能会发生离子反应。电解质在水溶液中的这些行为,构成了电解质一章的知识体系,如图1所示[7]。
图1 电解质溶液知识体系
2 电解质溶液图像题解题思维模型的建构
2.1 电解质溶液中的三大守恒关系
守恒观是学习电解质溶液需要形成的基本观念[8],分析、判断电解质溶液中各种微粒之间的关系时,灵活掌握三大守恒关系对快速分析解决问题非常重要。三大守恒的思维模型如表2所示。
表2 三大守恒的思维模型
续 表
2.2 电解质图像的读图思维模型
2.2.1 酸(碱)稀释曲线
这类题目通常绘出的是溶液pH随加入水的体积变化的关系曲线,考查知识与解决问题的思维模型如表3所示。
表3 酸(碱)稀释图像的解题思维模型
2.2.2 酸碱滴定曲线
这类题目往往以滴定过程中pH随酸(碱)的体积变化绘制曲线,考查滴定过程中不同阶段离子浓度的关系及相关理论知识,以室温时等浓度的NaOH溶液滴定HA溶液为例,这种图像的思维模型如表4所示。
表4 酸碱滴定图像的解题思维模型
2.2.3 分布系数-pH图像
这类题目以各組分的物质的量分数随pH的变化绘制图像,考查不同阶段离子浓度的关系及电离常数的计算等知识,以某二元弱酸H2A
与NaOH溶液的滴定为例,这类图像的思维模型如表5所示。
表5 分布系数-pH图像解题思维模型
3 解题思维模型示例
例1 (17新课标全国卷Ⅰ13)常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图2所示。下列叙述错误的是( )。
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lgc(HX-)c(H2X)
的变化关系
C.NaHX溶液中c(H+)>c(OH-),
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
解析: 题目以一元强碱和二元弱酸的滴定图像为载体,考查考生的识图、判断平衡常数、定点时离子浓度大小的比较等综合能力,其创意是绘
图2 例1题图
出了溶液pH随离子浓度比值对数的变化曲线,情境陌生度高,题目综合性强,难度大。该题的思维模型如图3。
图3 例1解题思维导图
答案: D
例2 (17新课标全国卷 Ⅱ 12)改变 0.1mol·L-1
二元弱酸H2A
溶液的pH,溶液中的H2A、
HA-、 A2-
的物质的量分数δ(X)
随pH的变化如图4所示[已知δ(X)=c(X)c(H2A)+c(HA-)+c(A2-)]。
下列叙述错误的是( )。
A.pH=1.2时, c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时, c(HA-)>c(H2A)=c(A2-)
D. pH=4.2时, c(HA-)=c(A2-)=c(H+)
解析: 题目以二元弱酸H2A溶液中各组成成分的分布系数随pH变化的图像为载体,考查读图、定点时微粒浓度的关系、平衡常数的判断等综合应用能力,立意新颖,构思巧妙,其解题思维模型如图5。
答案: D
图4 例2题图
图5 例2解题思维导图
例3 (16新课标全国Ⅰ卷12)298K时,在20.0mL 0.10mol·L-1
氨水中滴入0.10mol·L-1
的盐酸,溶液的pH与所加盐酸的体积关系如图6所示。已知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )。
图6 例3题图
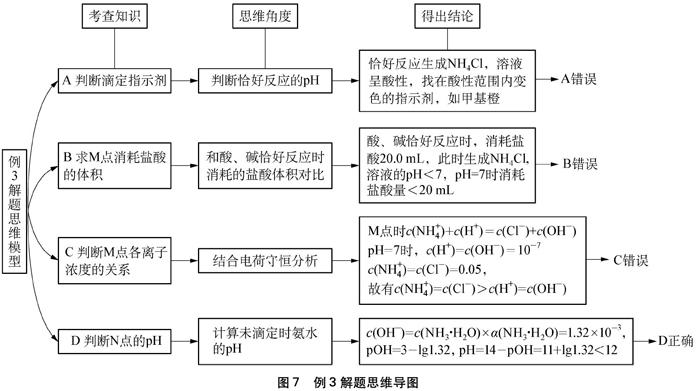
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中c(NH+4)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
解析: 题目以盐酸滴定氨水为题材,围绕电解质溶液中的离子反应以及中和滴定曲线,涉及中和滴定中指示剂的选择和方程式的简单计算、弱电解质的电离平衡和电离度的相关计算、电解质溶液中的守恒问题及pH的计算等综合知识,考查考生的知识迁移水平、从图中提取信息及分析问题、解决问题的能力。其解题思维模型如图7。
答案: D
图7 例3解题思维导图
高三化学复习备考中,在练习中要多思考,多总结,多反思。考生如果能建构起每个章节的知识体系,总结归纳常见考点的问题解决思维模型,理顺解决问题的思考角度和方法,就可以跳出题海战术的魔咒,使复习备考事半功倍,更有实效性。
参考文献:
[1][8]王云生.關于电解质溶液教学若干问题的探讨[J].化学教学, 2017,(10): 40~42.
[2]河南省招生办公室.2016河南省普通高考试卷评析[M].郑州: 河南科学技术出版社, 2017: 156.
[3]河南省招生办公室.2015河南省普通高考试卷评析[M].郑州: 河南科学技术出版社, 2016: 154.
[4]河南省招生办公室.2014河南省普通高考试卷评析[M].郑州: 河南科学技术出版社, 2015: 154.
[5]河南省招生办公室.2013河南省普通高考试卷评析[M].郑州: 河南科学技术出版社, 2014: 154.
[6]李猛.思维导图大全集[M].北京: 中国华侨出版社, 2010: 1.
[7]王明召主编.普通高中课程标准实验教科书·化学反应原理[M].济南: 山东科学技术出版社, 2010: 73~106.

