LPA受体和胞内信号传导相关分子拮抗骨肉瘤细胞黏附和迁移能力
王清富,朱立新,秦爱萍,陈铁峰,李金盘,吴北太,余 晓,赖忠安,谢维雄
(1.茂名市电白区人民医院 外一科,广东 茂名 525000;2.南方医科大学南方医院 血液科,广东 广州 510000)
骨肉瘤是儿童、青少年最常见的恶性骨肿瘤,目前对骨肉瘤的疗效已经有了显著提高,但仍有30%以上的患者呈现局部的侵袭性生长与转移情况[1]。近二十年来虽然新辅助化疗和综合治疗不断发展,但该病的病死率仍然居高不下。因此研究骨肉瘤转移以及侵袭的分子机制对治疗疾病和改善预后具有重要作用[2]。溶血磷脂酸(lyso-phosphotidic acid,LPA)是目前已知体内结构最简单的水溶性甘油磷脂,具有调节细胞黏附和迁移能力,可促细胞骨架变化[3]。基于LPA的受体具有调控肿瘤细胞黏附和迁移能力及LPA受体的基本功能,我们推断LPA受体亦可能与骨肉瘤细胞的治疗具有相关性,可能产生相关生物学效应[3]。有哪些胞内信号传导趋化因子在介导肉瘤细胞向骨折部位定向黏附和迁移归巢过程中起关键作用,目前尚不清楚[4]。而已有研究表明:基质细胞衍生因子-1(SDF-1)、单核细胞趋化蛋白1(MCP-1)在一定范围内影响黏附和迁移Mg-63的数量,即随其浓度增加而增加[5]。随着研究的不断深入,胞内信号传导趋化因子及受体可能会成为肿瘤细胞黏附和迁移的重要靶标因子,本项目选择骨髓源性细胞Mg-63,探讨应用LPA受体和胞内信号传导相关分子对Mg-63黏附和迁移的影响,从而为治疗骨肉瘤提供新思路和理论依据。
1 材料和方法
1.1 细胞和主要材料 细胞:骨肉瘤细胞Mg-63、正常成骨细胞(中国科学院细胞库)。材料:胞内信号传导趋化因子SDF-1α、MCP-1(PeProtech,美国);SB203580、AMD3100(Sigma,美国);TaqMix(东盛生物公司,广州,中国);Transwell 24孔培养板(美国 Corning 公司,美国),MTT试剂盒(北京中杉金桥生物技术有限公司,北京,中国);LPA受体(PeProtech 公司,美国)。
1.2 实验方法
1.2.1 细胞培养 含10%胎牛血清及双抗培养Mg-63骨肉瘤细胞于DMEM培养基中,37℃ 5%CO2传代培养。细胞密度70%以上进行传代,细胞消化后加入完全培养基,1000 r/min离心5 min,弃上清,计数接种。当细胞传至P3代进行细胞实验。
1.2.2 实验分组 实验分为3组,治疗组:运用LPA受体干预的Mg-63细胞;模型组:未经干预的Mg-63;对照组:正常成骨细胞。
1.2.3 Transwell体外检测黏附和迁移实验
1.2.3.1 骨肉瘤细胞Mg-63体外黏附和迁移情况 取P3代Mg-63于细胞铺板前1天,无血清培养12 h,培养液混悬成密度为5×105/mL细胞悬液。培养池Transwell置入24孔板中,加入500 μL含10% FBS的DMEM培养液于下室内,上室内加入100 μL细胞悬液(约5×104细胞)。置于5% CO2,37℃孵箱培养24 h后,用棉球小心擦去上室内细胞,PBS洗2次,4%多聚甲醛固定20~30 min,0.1%结晶紫染色30 min,去掉多余染料,显微镜下观察拍照。500 μL 十二烷基硫酸钠(SDS)溶解细胞。取细胞裂解液100 μL,加入培养板中,酶标仪检测吸光度。
1.2.3.2 LPA受体对骨肉瘤细胞Mg-63黏附和迁移能力的影响 100 mg/L LPA培养基100 μL进行培养,加入500 μL含10% FBS的DMEM培养液于下室内,100 μL细胞悬液加入上室内。结晶紫染色拍照,570 nm测定吸光值。
1.2.3.3 SDF-1α、MCP-1对骨肉瘤细胞Mg-63黏附和迁移能力的影响 按照上述分组方法,收集3组P3代细胞,上室加入100 μL细胞悬液,下室加入不同浓度的SDF-1α、MCP-1(0、1、10、100 μg/L)[6],置于5% CO2,37℃培养箱中孵育24 h。结晶紫染色拍照,570 nm测定吸光值。
1.2.3.4 AMD3100、SB203580对骨肉瘤细胞Mg-63黏附和迁移能力的影响 取3组P3代细胞在含特异性阻断剂AMD3100、SB203580(5 mg/L)的培养基中置于5% CO2,37℃培养箱中孵育30 min,再按上述1.2.3.1方法,收集细胞,上室加入100 μL细胞悬液,下室加入最佳浓度(100 μg/L)的SDF-1α、MCP-1,对照组不作任何处理,置于5% CO2,37℃培养箱中孵育24 h。结晶紫染色拍照,570 nm测定吸光值。
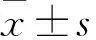
2 结果
2.1 LPA受体对骨肉细胞体外迁移的影响 Transwell结果显示,经前期预实验按照(0.000、0.001、0.010、0.050、0.100 g/L)的浓度梯度,应用LPA受体干预后不同作用时间与对照组相比较骨肉瘤细胞体外迁移能力加强,差异有统计学意义,见表1。
2.2 SDF-1α、MCP-1对骨肉瘤细胞Mg-63黏附和迁移能力的影响 Transwell体外黏附和迁移实验结果显示,3组Mg-63在胞内信号传导趋化因子SDF-1α、MCP-1诱导下,细胞黏附和迁移增多,且呈浓度依赖性,最佳浓度为100 μg/L(F=15.265,P<0.05)(图1)。治疗后第7天,治疗组Mg-63在SDF-1α、MCP-1诱导下与模型组、对照组相比,表现出较强的黏附和迁移能力(F=13.658,P<0.05)。各组治疗后第14天,Mg-63黏附和迁移能力均有所下降,但在SDF-1α、MCP-1诱导下,治疗组与模型组、对照组相比,差异仍有统计学意义(F=11.765,P<0.05),模型组与对照组相比,在MCP-1诱导下两组差异无统计学意义(χ2=0.053,P>0.05)。各组治疗后第21天Mg-63细胞的黏附和迁移能力下降,但在最佳浓度SDF-1α、MCP-1诱导下,治疗组与模型组、对照组相比,差异有统计学意义(F=9.382,P<0.05)。模型组在SDF-1α诱导下,与对照组相比,差异无统计学意义(χ2=0.085,P>0.05)。
表1 LPA受体对骨肉细胞体外迁移的影响

给药浓度/(g/L)迁徙率/%0 h2 h4 h6 h8 hFP0.0005.45±2.175.64±2.496.35±2.386.65±3.115.42±2.540.0500.8280.00117.56±5.64*36.63±8.93*45.56±9.92*55.47±7.85*65.66±11.49*9.4510.0150.01034.34±10.29*45.63±11.67*58.63±10.83*68.57±10.55*74.63±10.52*14.9300.0050.05059.63±17.52*63.66±15.26*70.56±12.42*83.53±9.62*89.83±7.84*11.7950.0090.10077.64±19.21*81.43±16.59*86.93±10.49*92.46±5.47*97.83±1.23*11.5950.009F9.00910.39111.44012.31112.942P0.0170.0120.0100.0080.007
注:与对照组相比较,*P<0.05。
1.对照组;2.模型组;3.治疗组。
图1 胞内信号传导趋化因子SDF-1α、MCP-1对Mg-63黏附和迁移能力的影响
2.3 AMD3100、SB203580对骨肉瘤细胞Mg-63黏附和迁移能力的影响 Transwell体外黏附和迁移实验结果显示,不同时相Mg-63经SDF-1α特异性受体阻断剂AMD3100处理后,Mg-63黏附和迁移数量下降,与SDF-1α组相比差异有统计学意义(F=10.163,P<0.05)(图2)。同样,不同时相Mg-63经MCP-1特异性阻断剂SB203580处理后,Mg-63黏附和迁移数量下降,与MCP-1组相比差异有统计学意义(F=12.016,P<0.05)。

1.对照组;2.模型组;3.治疗组。
图2 AMD3100、SB203580对Mg-63骨肉瘤细胞黏附和迁移能力的影响
3 讨论
有研究表明,骨肉瘤患者中有30%以上出现复发和转移现象,肺转移为其死亡的主要原因之一[7]。探讨骨肉瘤的转移以及侵袭的分子机制对改善骨肉瘤患者的预后具有重要价值和帮助,为治疗骨肉瘤尤其是防治其转移提供新的分子靶点,通过相关机制的研究为本病的治疗提供依据。LPA受体被称为细胞间“多功能磷脂信使”,在多种组织和细胞中具有广泛的生物学功能[8]。LPA受体具有调节细胞黏附和迁移能力,促细胞骨架变化[9]。研究发现LPA受体在人类一些肿瘤中呈现异常表达,在恶性渗出液中显著升高,表明LPA受体在恶性肿瘤发生进展可能与肿瘤的侵袭和转移密切相关[10]。LPA受体对肿瘤发生发展受到多层次多方面影响,其主要通过相关受体、自身分泌、胞内相关因子等环节作用,从而影响肿瘤细胞的迁移和黏附以及凋亡和分化能力,进而促进肿瘤的发生发展、侵袭、转移。但具体信号传导、调控机制尚不明确。
本研究应用LPA受体和胞内信号传导相关分子拮抗骨肉瘤细胞黏附和迁移能力,Transwell结果显示第7、14天,Mg-63细胞与模型组、对照组相比,体外黏附和迁移能力加强。骨肉瘤细胞Mg-63治疗后第21天,体外黏附和迁移能力与模型组相比减弱。胞内信号传导趋化因子SDF-1α、MCP-1在不同时间段均能促进骨肉瘤细胞Mg-63的黏附和迁移,经LPA受体干预及特异性阻断剂AMD3100、SB203580处理不同时间段后,黏附和迁移能力下降。
研究发现LPA受体抑制SaOS-2骨肉瘤细胞和兔成骨细胞的凋亡,并且该效应能够被百日咳毒素、Wortmannin以及LY294002所抑制,进一步说明LPA受体介导的抗凋亡作用有Gi蛋白和PI-3激酶的参与[11]。这些研究也初步表明骨肉瘤细胞表面存在LPA受体,并且LPA受体能够通过受体的介导对细胞的生物学行为如细胞凋亡产生影响。但是LPA受体对骨肉瘤细胞黏附和迁移能力影响的如何,未见相关报道[12]。基于LPA受体的某些肿瘤细胞具有调控黏附和迁移能力、LPA受体的基本功能研究,我们推断LPA受体能够通过其受体调控,很可能对骨肉瘤细胞具备同样的生物学效应,影响骨肉瘤的侵袭和转移[13]。不同的骨肉瘤细胞株具有不同的转移和侵袭能力,因此研究骨肉瘤细胞侵袭和转移的分子机制,尤其是LPA受体对骨肉瘤细胞的黏附和迁移能力的影响机制[14],并进一步探讨LPA受体介导的细胞信号传导通路,寻找发挥关键作用的特异受体或可能的细胞内信号传导分子如VASF,然后借助相应的受体抑制剂或者小干扰RNA阻断该信号传导通路,以此为抗肿瘤治疗靶点,为临床治疗骨肉瘤及骨肉瘤的转移治疗提供依据。
【参考文献】
[1] FU J,ZHANG L,HE T,etal.TWIST represses estrogen receptor-alpha expression by recruiting the NuRD protein complex in breast cancer cells[J].Int J Biol Sci,2012,8(4):522-532.
[2] GAO Y,XUAN XY,ZHANG HY,etal.Relationship between TWIST expressions and epithelial-mesenchymal transition of esophageal squamous cell carcinoma[J].Cell Biol Int,2012,23(6):488-496.
[3] YANG J,ECKERT MA.Targeting invadopodia to block breast cancer metastasis [J].Oncotarget,2011,2(7):562-568.
[4] PINHOAV,ROOMAN I,REAL FX.p53-dependent regulation of growth,epithelial mesenchymal transition and stemness in normal pancreatic epithelial cells[J].Cell Cycle,2011,10(8):1312-1321.
[5] WALLERAND H,ROBERT G,PASTICIER G,etal.The epithelial-mesenchymal transition inducing factor TWIST is an attractive target in advanced and/or metastatic bladder and prostate cancers[J].Urol Oncol,2010,28(5):473-479.
[6] 尚慧锋.MCP-1对人脐静脉内皮细胞CRL-1730凋亡的影响及机制初探[D].遵义:遵义医学院,2008.
[7] CHANG LH,CHEN CH,HUANG DY,etal.Thrombin induces expression of twist and cell motility via the hypoxia-inducible factor-1αtranslational pathwayin colorectal cancer cells[J].J Cell Physiol,2011,226(4):1060-1068.
[8] 徐万鹏,冯传汉.骨科肿瘤学[M].2版.北京:人民军医出版社,2008:211.
[9] FRANCO HL,CASASNOVASJ,RODRIGUEZ-MEDINA JR,etal.Redundant or separate entities roles of Twist1 and Twist2 as molecular switches during gene trans-cription[J].Nucleic Acids Res,2011,39(4):1177-1186.
[10] NOWAK SJ,AIHARA H,GONZALEZ K,etal.Akirin links twist-regulated transcription with the brahma chromatin remodeling complex during embryogenesis[J].PLoS Genetics,2012,8(3):1-16.
[11] JERONIMO C,ESTELLERM.DNA methylation markers for prostate cancer with a stem cell twist[J].Cancer Prev Res(Phila),2010,3(9):1053-1055.
[12] YIN G,ALVERO AB,CRAVERIO V,etal.Constitutive proteasomal degradation of TWIST-1 in epithelial-ovarian cancer stem cells impacts differentiation and metastatic potential[J].Oncogene,2012,20:10-30.
[13] DE MARCO P,RASO A,BERI S,etal.A de novo balanced translocation t(7;12)(p21.2;p12.3)in a patient with Saethre-Chotzen-like phenotype down regulatesTWIST and an osteoclastic protein-tyrosine phosphatase,PTP-oc[J].Eur J Med Genet,2011,54(5):478-483.
[14] WARREN C,WALLACE W,CAMPBELL WJ.Splenic laceration with a twist:a lesson learnt from gastric volvulus[J].Ann R Coll Surg Engl,2012,94(2):88-89.

