三阴性乳腺癌TCL诱导THP-1细胞活化及分化的研究
董博翰,丁园园,戴广丽,王贝茹,张思远
(1.皖南医学院 a.生物化学教研室;b.活性生物大分子研究安徽省重点实验室;c.药学院,安徽 芜湖 241002;2.芜湖市中医医院 妇产科,安徽 芜湖 241000)
三阴性乳腺癌(triple negative breast cancer,TNBC)是乳腺癌中的一种特殊类型。这类疾病因ER、PR、HER-2均呈阴性表达,缺乏针对性的药物作用靶点,所以临床治疗效果不佳、复发率较高[1-3]。
抗肿瘤免疫治疗是近年来新兴的一种肿瘤治疗方法。其中,基于肿瘤细胞裂解物(tumor cell lysate,TCL)的抗肿瘤疗法,有着较好的应用前景[4]。这种物质中含有肿瘤细胞内绝大多数的抗原及蛋白质,因此,其可以被作为一种抗肿瘤的免疫物质去诱导机体免疫细胞参与抗肿瘤免疫作用[5-6]。
目前,人们已经发现TCL可诱导多种免疫细胞的活化,如单核细胞、树突状细胞、T淋巴细胞、NK细胞等[7-8]。不过,TCL活化免疫细胞并进一步促进细胞分化的具体机理,还不甚清楚。本研究中,我们选取人单核细胞系THP-1作为研究模型,利用三阴性乳腺癌细胞HCC1937制备的TCL诱导其活化及分化,并探讨分化的潜在机制,为基于TCL的三阴性乳腺癌免疫治疗方法提供实验依据。
1 材料与方法
1.1 实验材料与仪器 HCC1937细胞系购于中国科学院典型培养物保藏委员会细胞库;人白血病单核细胞株THP-1购于无锡菩禾生物技术有限公司;THP-1RPMI 1640培养基购于hyclone公司;胎牛血清(FBS)购于天津四季青公司;TNF-α、IL-12检测试剂盒购于武汉华美生物技术有限公司;LPS购于碧云天生物技术有限公司;PE 偶联的抗人 CD68 单克隆抗体购于美国biolegend公司,6 孔培养板 ( 美国 Corning公司;RNAprep Pure培养细胞/细菌总RNA提取试剂盒、FastQuant RT 试剂盒及SuperReal 荧光定量预混试剂购于北京天根生物技术有限公司;其他试剂为国产市售分析纯。CO2培养箱购于美国Thermo Forma 公司;酶标检测仪购于美国 Bio-Rad 公司;相差显微镜购于日本佳能公司;流式细胞仪购于美国 BD 公司;实时荧光定量PCR仪购于美国A&B公司。
1.2 三阴性乳腺癌细胞HCC1937细胞裂解物的制备 将培养好的对数生长期的HCC1937细胞用0.25%胰酶消化,于15 mL离心管中制成单细胞悬液,用1×PBS洗涤细胞3次,离心,弃去上清后再用PBS重悬细胞,接着,于-80℃冻存15 min,37℃温育5 min,震荡1 min,反复操作5次,然后离心将上清转移到1.5 mL EP管中,即得到HCC1937 细胞裂解物。
1.3 HCC1937细胞裂解物作用后的THP-1分泌TNF-α、IL-12检测 将生长状态良好的THP-1细胞接种于6孔细胞培养板中,1.6×106THP-1细胞/孔(2 mL) RPMI 1640培养液。将5×105、1×106、2×106的三阴性乳腺癌HCC1937细胞所制备的裂解物,分别同THP-1细胞共孵育48 h。与此同时,将只用1×PBS作用的THP-1细胞作为阴性对照组。然后,收集THP-1细胞培养上清液,ELISA检测TNF-α、IL-12的分泌情况并绘制剂量-效应曲线,以筛选出HCC1937细胞裂解物的最佳浓度。用1×106的HCC1937制备细胞裂解物,同THP-1细胞共孵育6、12、24、48 h。同时设立PBS阴性对照组。各时间点分别收集细胞培养上清液,ELISA检测TNF-α、IL-12的分泌情况并绘制时间-效应曲线,以筛选出裂解物作用的最佳时间点。
1.4 流式检测HCC1937细胞裂解物作用后的THP-1细胞形态及CD68表达 用1×106的HCC1937制备细胞裂解物,同THP-1细胞共孵育48 h,并在培养液中加入LPS,终浓度为0.05 μg/L。同时设立低剂量LPS对照组,LPS终浓度0.05 μg/L;高剂量LPS对照组,LPS终浓度0.25 μg/L;1×PBS阴性对照组。流式细胞术检测各组THP-1细胞表面共刺激分子CD68的表达:首先,制备各组THP-1单细胞悬液。接下来,每个细胞样品中加入200 μL 4%多聚甲醛室温避光20 min,12 000 r/min离心5 min,0.1% trition X-100 1 mL 室温避光10 min,离心后用荧光标记的抗CD68抗体室温染色细胞30 min;PBS洗涤液洗涤两次染色后的 THP-1细胞,接着,12 000 r/min,离心5 min,弃去上清液保留沉淀;最后用1×PBS重悬THP-1细胞后上机检测。
1.5 Q-PCR分析THP-1中C/EBPα和PU.1表达情况 1×106的HCC1937细胞裂解物作用于THP-1细胞,于6、12、24、48 h收集作用后的THP-1细胞及相应的1×PBS对照组细胞。提取各细胞样品的总RNA,反转录获得cDNA分子。以cDNA为模板配置PCR反应体系,在Q-PCR仪中两步法进行PCR反应,根据输出的Ct值分析实验结果,计算ΔCt值及各样品相对表达量。
1.6 统计学分析 所有结果至少完成3次代表性实验。利用SPSS 18.0软件处理全部数据,对于方差齐的两样本均数,采用t检验;对于方差不齐的两样本均数,采用秩和检验来进行比较。百分比的比较,采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 HCC1937细胞裂解物诱导THP-1活化分泌细胞因子TNF-α、IL-12 通过将不同剂量的HCC1937细胞裂解物同THP-1细胞共同作用48 h后,我们发现,同PBS对照组相比5×105、1×106和2×106HCC1937细胞制备的裂解物都能够促进THP-1分泌TNF-α(P<0.05,其中5×105剂量组t值为24.62,1×106剂量组t值为67.98,2×106剂量组t值为247.42)、IL-12(P<0.05,其中5×105剂量组t值为18.30,1×106剂量组t值为29.07,2×106剂量组t值为52.40),并且细胞因子的分泌量存在剂量依赖性,随着作用时间的增加细胞因子的浓度也逐渐增加(图1A)。不过,实验中我们发现2×106裂解物作用48 h后,细胞亮度变暗,细胞边缘变得毛糙,这提示THP-1的细胞状态较差,但其他两个剂量作用后的THP-1细胞状态未发现明显变化。
接下来,我们选择促进THP-1分泌细胞因子能力更强,同时又不影响细胞培养状态的1×106这个裂解物剂量,进行后续的作用时间摸索。我们发现,在将裂解物同THP-1孵育6 h后TNF-α、IL-12的分泌水平就升高(P<0.05,其中TNF-α检测组t值为41.25,IL-12检测组t值为30.23),12 h时TNF-α、IL-12的分泌水平达到最高,分别为272.39 ng/L、647.10 ng/L。这种高分泌水平持续到24、48 h时TNF-α、IL-12的分泌量会出现下降,但同PBS对照组相比仍处于较高水平(P<0.05,TNF-α检测组t值为18.44,IL-12检测组t值为39.23)(图1B)。

A.TNF-α、IL-12分泌剂量依赖曲线;5×105,1×106,2×106代表制备细胞裂解物的细胞数;B.TNF-α、IL-12分泌时间依赖曲线。
图1 HCC1937细胞裂解物促THP-1细胞分泌TNF-α、IL-12
2.2 HCC1937细胞裂解物促进THP-1细胞形态改变 THP-1是一种单核细胞系,具有进一步分化成巨噬细胞等抗原递呈细胞的潜能。THP-1分化后细胞形态会发生改变。通过流式检测细胞裂解物+低剂量LPS作用后的THP-1细胞,我们发现:同对照组相比,THP-1细胞流式检测前向角光散射的检测数值发生了明显的增加,检测值50 K以上的细胞比例达36.8%(χ2=6.21),这和高剂量LPS作用后的细胞检测值基本相似,高剂量LPS作用的THP-1细胞中高检测值比例达28.7%(χ2=1.70)。与之相比,低剂量LPS作用后的THP-1细胞和PBS对照组THP-1细胞,细胞比例都相对较小,分别为21.6%(χ2=0.03)和21.4%(图2A);同前向角光散射类似的,细胞裂解物+低剂量LPS组THP-1细胞中(χ2=16.835),高侧向角光散射检测值细胞比例高于低剂量LPS组(χ2=1.332)和PBS对照组,而与高剂量LPS组类似(χ2=6.438)(图2B)。上述结果提示:细胞裂解物作用组、高剂量LPS作用组的细胞形态同PBS对照组、低剂量LPS组相比差别明显。

A.THP-1细胞前向角光散射的改变;PBS:1×PBS对照组,LPS 1:低剂量LPS 0.05 μg/L作用组,LPS 2:高剂量LPS 0.25 μg/L作用组,LPS1+TCL:LPS 0.05 μg/L、HCC1937细胞裂解物联用组;B.THP-1细胞侧向角散射光的改变。
图2 HCC1937细胞裂解物作用的THP-1细胞形态改变
2.3 HCC1937细胞裂解物上调THP-1细胞CD68表达 CD68是巨噬细胞特异性的细胞表面分子。THP-1向巨噬细胞分化,这一表面分子会出现上调。在流式检测细胞裂解物作用后的THP-1形态变化的同时,我们也检测THP-1细胞CD68的表达情况。LPS+细胞裂解物作用后,THP-1细胞表面CD68的表达出现上调,表达率达93.7%(χ2=91.55),而高剂量LPS作用的THP-1细胞CD68表达也出现上调,表达率为71.6%(χ2=38.72)。不过,PBS对照组、低剂量LPS组CD68的表达相对较低,尤其是PBS对照组的表达率只有28.1%(χ2=18.36)(图3)。这应该是THP-1自发分化后的CD68基础表达率。如将这一基础表达率减除后,则LPS+细胞裂解物组CD68表达率为65.6%,高剂量LPS组为43.5%,低剂量LPS组为30.1%。

PBS:1×PBS对照组,LPS 1:低剂量LPS 0.05 μg/L作用组,LPS 2:高剂量LPS 0.25 μg/L作用组,LPS1+TCL:LPS 0.05 μg/L、HCC1937细胞裂解物联用组。
图3 HCC1937细胞裂解物上调THP-1细胞表面分子CD68的表达
2.4 HCC1937细胞裂解物对单核细胞分化标志物C/EBPα和PU.1表达的影响 C/EBPα和PU.1是控制单核细胞分化的关键因子,它们的变化直接影响单核细胞分化方向。Q-PCR检测结果显示:同PBS对照组相比,细胞裂解物作用的THP-1,其C/EBPα和PU.1表达都会出现明显的增加。但随着作用时间的增加,C/EBPα的表达逐渐增加,而PU.1的表达则逐渐下降。其中,C/EBPα的表达量在6 h时是PBS对照组的1.47倍,而12、24 h分别为对照组的1.59倍和2.25倍,至48 h,C/EBPα表达量则为对照组的2.01倍。其24 h和48 h表达量同PBS对照组相比差异有统计学意义(P<0.05,其中24 h检测组t值为17.06、48 h检测组t值为12.87),6 h和12 h差异无统计学意义(P>0.05,其中6 h检测组t值为4.99、12 h检测组t值为9.57)(图4A);与之不同的是,PU.1的表达在6 h时即达最大值,为对照组的2.29倍,之后开始下降,至48 h下降为对照组的1.57倍。其中6、12 h同PBS对照组相比差异有统计学意义(P<0.05,其中6 h检测组t值39.15、 12 h检测组t值为34.5),24、48 h相比差异无统计学意义(P>0.05,其中24 h检测组t值为3.12,48 h检测组t值为7.48)(图 4B)。这些结果表明,HCC1937细胞裂解物能促进THP-1细胞中分化因子C/EBPα的表达,但却抑制另外一种分化因子PU.1的表达。
3 讨论
肿瘤细胞裂解物的主要抗肿瘤机理是可以活化免疫细胞。免疫细胞的种类很多,不同免疫细胞的活化是一个连续分阶段的过程。肿瘤细胞裂解物中的抗原或蛋白接触免疫系统后,抗原递呈细胞如巨噬细胞、树突状细胞会摄取抗原蛋白,并将其递呈给T淋巴细胞,使其特异性活化以发挥抗肿瘤作用[9]。在这些免疫细胞中,抗原递呈细胞往往又是由单核细胞分化而来[10]。因此,促进单核细胞活化及向抗原递呈细胞分化,将有利于肿瘤细胞裂解物抗肿瘤作用的发挥。
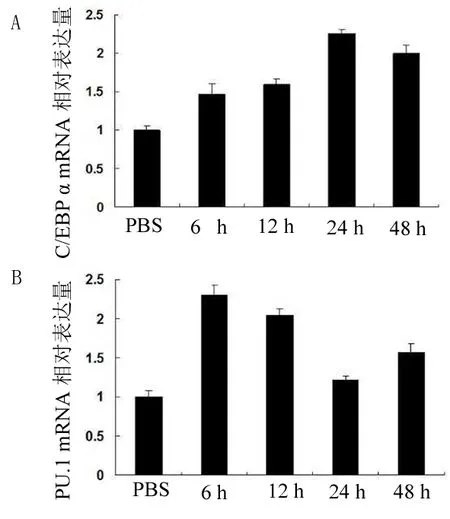
A.各作用时间点,THP-1中C/EBPα mRNA相对于PBS对照组的表达量;B.各作用时间点,THP-1中PU.1 mRNA相对于PBS对照组的表达量;PBS:1×PBS对照组。
图4 HCC1937细胞裂解物作用后的THP-1中C/EBPα、PU.1的表达
为验证肿瘤细胞裂解物对单核细胞活化及分化的影响。我们选取人单核细胞THP-1作为研究对象,在将不同剂量的HCC1937细胞裂解物同THP-1细胞共同作用之后,我们发现虽然2×106的HCC1937细胞制备的细胞裂解物可以显著刺激THP-1细胞分泌TNF-α,但该剂量的细胞裂解物同THP-1细胞共孵育48 h后会影响细胞生长状态。因此,在后续实验中我们选择了1×106的HCC1937细胞制备裂解物。通过将这一剂量的细胞裂解物,同THP-1细胞共同孵育6、12、24、48 h后我们发现:HCC1937细胞裂解物可以显著刺激THP-1分泌TNF-α和IL-12。 TNF-α和IL-12都是活化单核细胞分泌的细胞因子,这两种细胞因子分泌水平的增加说明HCC1937细胞裂解物可以激活单核细胞。
单核细胞是抗原递呈细胞的前体细胞,活化的单核细胞会向不同类型的抗原递呈细胞,如巨噬细胞、树突状细胞分化。在本研究中,流式细胞检测结果显示:同PBS对照组相比,细胞裂解物作用的THP-1前向角光散射(FSC)及侧向角光散射(SSC)明显增大。前向角光散射增大证明细胞体积明显增大,侧向角光散射增大代表细胞颗粒度增大,这些都符合单核细胞向巨噬细胞分化的特征[11-12]。与此同时,LPS和细胞裂解物共同作用的THP-1细胞表面分子CD68出现上调。这说明在HCC1937裂解物作用下,单核细胞THP-1会分化成为巨噬细胞[13]。
为了进一步验证THP-1细胞向巨噬细胞分化。我们利用Q-PCR的方法检测了裂解物作用后的THP-1细胞中分化关键因子C/EBPα(CCAAT enhancer binding protein α)和PU.1的表达情况。PU.1及C/EBPα是调控单核-巨噬细胞系统分化的关键转录因子。研究表明,PU.1的表达可以抑制单核-巨噬细胞的定向分化[14]。与之相反的,分化诱导因子C/EBPα的表达可以诱导单核细胞向巨噬细胞分化[15]。通过Q-PCR检测HCC1937细胞裂解物作用的THP-1细胞C/EBPα及PU.1的表达我们发现:裂解物作用的THP-1细胞,C/EBPα的表达出现增加,而另外一种分化调节因子PU.1,则随细胞裂解物作用时间的增加,表达量逐渐减少。这又进一步证明了HCC1937裂解物可以诱导THP-1向巨噬细胞分化,且分化的机制同细胞中分化调节因子C/EBPα的上调和PU.1的下调有密切联系。
综上所述,本研究发现三阴性乳腺癌细胞HCC1937裂解物可以刺激活化人单核细胞THP-1分泌TNF-α及IL-12,并通过上调THP-1中C/EBPα和下调PU.1的表达,诱导THP-1向巨噬细胞分化。分化后的巨噬细胞,将可以通过分泌细胞因子或递呈抗原给淋巴细胞,发挥更强的抗肿瘤免疫作用。这些发现将为三阴性乳腺癌细胞裂解物疫苗的临床应用提供理论依据。
【参考文献】
[1] GADI VK,DAVIDSON NE.Practical Approach to triple-negative breast cancer [J].J Oncol Pract,2017,13(5):293-300.
[2] JITARIU AA,CIMPEAN AM,RIBATTI D,etal.Triple negative breast cancer:the kiss of death [J].Oncotarget,2017,8(28):46652-46662.
[3] ANAREOPOULOU E,SCHWEBER SJ,SPARANO JA,etal.Therapies for triple negative breast cancer [J].Expert Opin Pharmacother,2015,16(7):983-998.
[4] SUN W,FANG M,CHEN Y,etal.Delivery system of CpG oligodeoxynucleotides through eliciting an effective T cell immune response against melanoma in mice [J].J Cancer,2016,7(3):241-250.
[5] YAN Y,FANG M,XUAN W,etal.The therapeutic potency of HSP65-GTL in GL261 glioma-bearing mice [J].J Immunother,2015,38(9):341-349.
[6] XUAN W,YAN Y,WAN M,etal.Antitumor activity of mHSP65-TTL enhanced by administration of low dose cyclophosphamide in pancreatic cancer-bearing mice[J].Int Immunopharmacol,2015,27(1):95-103.
[7] 朱学军,曹雪涛,雷虹,等.弱酸洗脱提取的肿瘤抗原肽致敏的树突状细胞对CTL的体内外激活 [J].中华微生物学和免疫学杂志,2000,20(2):98.
[8] DONG BH,SUN LG,WU XL,etal.Vaccination with TCL plus MHSP65 induces anti-lung cancer immunity in mice [J].Cancer immunol immun,2010,59(6):899-908.
[9] SMITHGARVIN JE,KORETZKY GA,JORDAN MS.T cell activation[J].Annual Review of Immunology,2015,27 (27):591-619.
[10] JAKUBZICK CV,RANDOLPH GJ,HENSON PM.Monocyte differentiation and antigen-presenting functions.[J].Nat Rev Immunol,2017,17(6):349-362.
[11] 魏然,陈彬,甘田福,等.流式细胞术检测外周血CD14+细胞的活化程度 [J].中华检验医学杂志,2003,26(1):22-24.
[12] 张美英.吞噬细胞和巨噬细胞 [J].生物学通报,1992(10):33.
[13] 崔璐华,王庸晋,王金胜,等.不对称二甲基精氨酸对THP-1源性巨噬细胞表达巨噬细胞移动抑制因子的影响 [J].中国动脉硬化杂志,2010,3:169-172.
[14] ZHU XJ,YANG ZF,CHEN Y,etal.PU.1 is essential for CD11c expression in CD8(+)/CD8(-) lymphoid and monocyte-deriveddendritic cells during GM-CSF or FLT3L-induced differentiation [J].PLoS One,2012,7(12):e52141.
[15] 应霁,王伟铭.转录因子CCAAT增加子结合蛋白α的研究进展[J].上海交通大学学报(医学版),2015,35(2):262-267.

