戊二醛交联的传感器检测布鲁氏菌抗体的研究
杨威,韩小平,张志勇,左月明
(山西农业大学 工学院,山西 太谷 030801)
布鲁氏菌病(简称布病)是由布鲁氏菌感染引起的人畜共患传染病[1,2]。动物感染后临床主要表现为母畜流产、乳腺炎和不育等[3],接触布鲁氏菌感染的病畜或畜产品可使人类患病,病程持续时间较长,严重的可致残,丧失劳动能力[4],给农业生产带来巨大损失,带来严重的公共健康问题[5]。因此,建立一种能够早期简便、快速检测布病的方法很有必要。布病的传统检测方法存在操作繁琐、耗时、检测灵敏度低等缺点[6]。近年来,基于电化学原理的免疫传感器迅速发展,在生物技术、临床诊断及快速检测等领域广泛应用[7],其主要原理是利用抗原-抗体反应的特异性,通过测试与待测物浓度相关的电流信号实现待测物浓度的定量检测。相对于检测布病的传统方法,电化学免疫传感器具有响应快、灵敏度高和检测限低等特点[8]。因此,能够实现快速检测低浓度抗体,对早期诊断布病具有重要意义。
戊二醛是常用的交联剂,其分子末端有两个醛基基团,能和酶或蛋白质的氨基发生反应[9]。陈敏等[10]构建了灵敏的铁氰化钾/壳聚糖/戊二醛信号体系,建立了无标记电化学免疫传感器用于血清中癌胚抗原检测。超声破碎细胞是利用超声波在液体中产生空化效应,使细胞(细菌)破裂[11]。处理后的菌悬液粘度降低,同时促进了菌体分散,操作简单,样品损失少。陈善真等[12]利用克隆表达的蛋白做抗原和超声破碎抗原建立检测副猪嗜血杆菌抗体的 ELISA 方法,同时检测了 78 份血清样品,结果表明后者有更高的检出率。本试验对布鲁氏菌抗原进行超声处理,以改善抗原绑定到电极上的效率和结合抗体的效率。
本文通过戊二醛交联将布鲁氏菌抗原或超声破碎后的布鲁氏菌抗原固定到预处理后的丝网印刷金电极表面,根据抗原抗体的免疫反应原理,检测不同浓度的布鲁氏菌抗体,建立峰电流的变化量与抗体浓度之间的关系,实现低浓度布鲁氏菌抗体的检测。
1 材料与方法
1.1 试剂与仪器
布鲁氏菌标准阳性血清(抗体)和布鲁氏菌病试管凝集试验抗原购自中国兽医药品监察所;巯基乙胺(Cysteamine,CA)和25%戊二醛(Glutaraldehyde,GA)购于西格玛奥德里奇公司;牛血清白蛋白(Bovine Serum Albumin,BSA)购自罗氏公司;磷酸氢二钠(Na2HPO4)、铁氰化钾(K3[Fe(CN)6])、磷酸二氢钠(NaH2PO4)、亚铁氰化钾(K4[Fe(CN)6])、氯化钠(NaCl)、无水乙醇(C2H6O)、氯化钾(KCl)购于上海阿拉丁生化科技股份有限公司;配置溶液使用超纯水(18.2 M·cm)。
超纯水机(NW30VM型,力康生物医疗科技控股有限公司);超声波细胞粉碎机(JY99-ⅡDN型,宁波新芝生物科技有限公司);丝网印刷金电极(SPGE)(X250BT型,西班牙DropSens公司);测试过程在上海辰华公司的电化学工作站(CHI760C型)上完成。
1.2 溶液配制
磷酸盐缓冲液(phosphate-buffered saline,PBS):称量磷酸氢二钠和磷酸二氢钠加入超纯水配成10 mmol·L-1的溶液后,加入0.9 %的氯化钠溶液,然后将溶液的pH值调整至7.4,经高温高压灭菌后,制备成10 mmol·L-1、pH7.4的磷酸盐缓冲液,于4 ℃环境保存备用,保存时间不超过2周。
电解液:称取0.164 6 g的铁氰化钾、0.211 2 g亚铁氰化钾和1.491 0 g氯化钾溶解到10 mmol·L-1的PBS中,定容到200 mL,得到5 mmol·L-1的铁氰化钾/亚铁氰化钾([Fe(CN)6]3-/4-)电解液。
牛血清白蛋白溶液(Bovine Serum Albumin,BSA):1% BSA/PBS溶液,使用时配制。
戊二醛溶液(Glutaraldehyde,GA):2.5%的GA/PBS溶液,使用时配制。
1.3 布鲁氏菌抗原、抗体的准备
布鲁氏菌标准阳性血清(抗体)用PBS梯度稀释成浓度为1×10-5、1×10-3、1×10-1、1×10、1×102IU·mL-1的溶液。布鲁氏菌病试管凝集试验抗原配置成4×109CFU·mL-1的溶液。
1.4 超声破碎抗原的制备
取1 mL布鲁氏菌抗原液,用PBS配置50 mL的菌悬液,将稀释的菌悬液放入100 mL烧杯中,为了避免产生高温,超声破碎在冰浴中进行。超声波细胞粉碎机参数设置:功率480 W,工作2 s,间隔5 s,全程工作15 min。将经过超声波作用的抗原液在4 500 r·min-1的条件下离心15 min,弃掉上层液体,取沉淀,PBS重悬,弃掉上层液体,将抗原溶液4 ℃环境保存[13]。
1.5 电极预处理
将丝网印刷金电极在-0.10~1.50 V的电压范围内,以0.1 V·s-1的扫速在0.5 mol·L-1硫酸中采用循环伏安法扫描8次,预处理后的金电极用超纯水清洗干净。
1.6 测试方法
免疫传感器测试采用3种方法。循环伏安法(Cyclic Voltammetry,CV)测试的基本参数:在-0.30~0.60 V的电压范围内,0.1 V·s-1的速率条件下进行扫描。差分脉冲伏安法(Differential Pulse Voltammetry,DPV)测试的基本参数:电压范围为-0.15~0.35 V,电压增量为0.004 V,振幅0.05 V,脉冲宽度0.06 s,采样宽度0.02 s,脉冲周期0.2 s。方波伏安法(Square Wave Voltammetry,SWV)测试的基本参数:电压范围为-0.10~0.40 V,电位增量为0.004 V,振幅0.025 V,频率15 Hz。免疫传感器上依次结合不同浓度梯度的抗体测试[14],以[Fe(CN)6]3-/4-为支持电解液的室温下完成[15]。数据分析采用origin8.5软件。
1.7 免疫传感器的制备
1.7.1 戊二醛交联法制备免疫传感器
将2.5 %戊二醛溶液滴涂到预处理后的工作电极表面,37 ℃恒温湿盒中孵育1 h取出,用PBS和超纯水分别充分清洗2次,室温晾干,以去除未结合的戊二醛。吸取10 μL浓度为4×109CFU·mL-1的抗原溶液滴涂于修饰后的工作电极,在37 ℃恒温湿盒中静置2 h,取出,用缓冲液和超纯水清洗,以除去没有结合的抗原。电极表面涂覆1 % 的BSA溶液于37 ℃湿盒中反应1 h,以封闭非特异性吸附位点,用缓冲液和超纯水冲洗2次,将未结合的BSA清洗干净,制备好的免疫传感器静置在4 ℃环境中。
1.7.2 绑定超声破碎抗原的免疫传感器制备
免疫传感器A:用50 μL浓度为10 mmol·L-1的CA修饰经过预处理的SPGE,放置于室温密闭环境中反应2 h,然后分别用乙醇和超纯水清洗干净,以去除未结合的CA。在电极表面结合10 μL的2.5 % GA,37 ℃环境中反应1 h,再用缓冲液和超纯水清洗干净,以除去未偶联的GA。取10 μL超声波处理的抗原液,滴于修饰后的工作电极表面,37 ℃湿盒中孵育1 h,取出清洗,晾干。再封闭非特异性位点(同1.7.1封闭过程)。保存制备好的免疫传感器。
免疫传感器B:将2.5 %GA滴涂到预处理后的SPGE上,37 ℃恒温湿盒中反应1 h取出,用PBS和超纯水分别清洗2次,以除去未结合的GA。吸取10 μL超声波处理的抗原液,滴涂于修饰后的工作电极表面,37 ℃恒温湿盒中孵育1 h取出,用PBS和超纯水清洗室温晾干。再封闭非特异性位点(同1.7.1封闭过程)。
免疫传感器C:将预处理后的金电极用超纯水清洗干净。吸取10 μL超声波处理的抗原液,涂于预处理后的SPGE的工作电极上,37 ℃孵育1 h,取出后清洗2次。再封闭非特异性位点(同1.7.1封闭过程)。将制备好的免疫电极保存备用。
2 结果与讨论
2.1 戊二醛交联法制备免疫传感器的伏安特性响应
通过戊二醛交联法将布鲁氏菌抗原直接绑定在预处理后的工作电极表面,蛋白质分子以共价键结合的方式与固相载体连接[16]。之后再绑定布鲁氏菌抗原,每次滴加不同浓度的待测抗体到免疫传感器工作电极表面后孵育30 min。根据免疫反应原理,布鲁氏菌抗原将布鲁氏菌抗体捕获到电极表面,分别采用CV、DPV和SWV三种方法检测。随着待测抗体浓度的增大,测试后的氧化峰电流响应值逐渐减小,表明抗原和抗体形成的免疫复合物阻断了氧化还原探针向电极表面的转移。随着结合抗体浓度的逐渐增大,传导的阻碍也进一步增加,导致峰电流值降低,如图1所示。

图1 免疫传感器的伏安曲线Fig.1 Votammetry behavior of the immunosensor
布鲁氏菌抗体浓度范围在1×10-5~1×10 IU·mL-1内,伏安法测定的电流变化量与抗体浓度对数呈线性关系,如表1所示(n=3)。通过CV法测试后(如图2a所示),拟合曲线能够较好的区分1×10-5、1×10-3、1×10-1、1×10 IU·mL-14个浓度的待测抗体溶液,标准偏差最小,有较好的重现性,但是在3种测试方法中灵敏度最低。DPV方法测试后(如图2b所示),免疫传感器能够较好的区分1×10-5、1×10-3、1×10-1IU·mL-13个浓度梯度的待测抗体溶液,曲线不能很好的区分1×10、1×10-1IU·mL-1浓度的待测抗体溶液。从图2c可以看出,SWV方法测试后,免疫传感器能区分1×10-5、1×10-3IU·mL-1两个浓度梯度的待测抗体溶液,其他3个浓度梯度的抗体溶液数据有重叠,不能区分。在3种测试方法中,SWV方法得到拟合函数的灵敏度最高(6.886 2),检测限为1.206 5×10-9IU·mL-1,但标准偏差比CV、DPV方法得到的数值大。
2.2 免疫传感器固定超声破碎抗原测试抗体的响应
3种类型电极分别绑定超声破碎抗原后的特征参数,如表2所示,采用CV方法测试,其免疫传感器A的峰电流值最大(105.48±10.22 μA),有利于提高免疫传感器的灵敏度,有潜力满足多个浓度梯度的测试要求。免疫传感器C的峰电流值最小(50.37±6.26 μA),作为电流型免疫传感器没有明显优势。
考察A、B和C三种免疫传感器在绑定经超声处理抗原的峰电流值的净增量,如表3所示。免疫传感器A峰电流的净增量最小,为5.97 μA,免疫传感器C峰电流的净增量最大,为61.09 μA,表明电极经过不同步骤处理和修饰后,绑定超声破碎处 理的抗原的量不同。将A、B、C三种类型的免疫传感器分别依次绑定浓度为1×10-5、1×10-3、1×10-1、1×10、1×102IU·mL-1的抗体溶液,免疫传感器A在抗体浓度1×10-5IU·mL-1到1×102IU·mL-1范围内,峰电流值与抗体对数浓度呈正比,能连续测试5个浓度梯度的抗体溶液。免疫传感器B在抗体浓度1×10-5~1×10 IU·mL-1时,峰电流值与抗体对数浓度呈正比关系,能连续测试4个浓度梯度的抗体溶液。免疫传感器C在抗体浓度1×10-5~1×10-1IU·mL-1时,峰电流值与抗体对数浓度呈正比关系,能够连续测试3个浓度梯度的抗体溶液。图3所示,A、B、C 3种类型免疫传感器测试不同浓度抗体溶液后的灵敏度依次降低,能够检测的抗体浓度梯度依次减少。可能由于电极表面结构不同导致绑定抗原的量存在差异,影响抗原抗体免疫复合物的形成。3种类型免疫传感器的标准偏差较大。

表1 不同测试方法免疫传感器的参数比较Table 1 Comparison of parameters of immunosensor with different testing methods

表2 电极的特征参数Table 2 Characteristic parameters for the electrode

表3 电极的特征参数Table 3 Characteristic parameters for the electrode
3 结论
本试验利用预处理后的丝网印刷金电极修饰戊二醛绑定布鲁氏菌抗原制备了免疫传感器,采用CV、DPV和SWV 3种检测方法,分别对检测不同浓度布鲁氏菌抗体的情况进行表征。其中,SWV方法测试后的检测限最低,灵敏度最高。采用戊二醛偶联方法能有效将抗原固定到丝网印刷金电极表面,检测低浓度抗体。在修饰后的金电极上绑定未经超声破碎处理的抗原比绑定经超声破碎处理的抗原测试效果好。2种方式检测低浓度的布鲁氏菌抗体是可行的,但绑定超声破碎抗原的方式需要进一步试验研究减小误差。本试验可以为其他致病菌的检测研究提供参考。
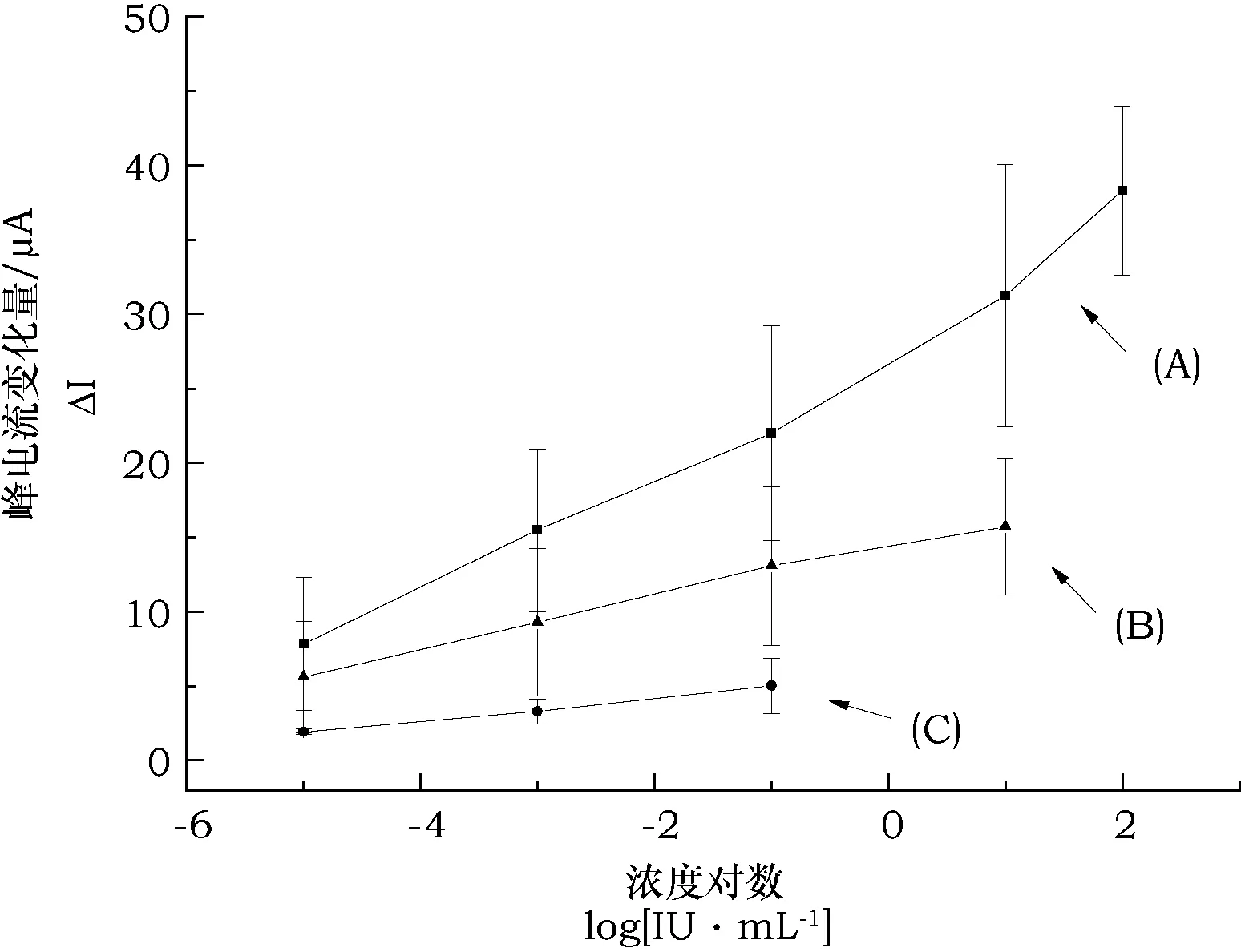
图3 电流变化量与抗体浓度对数的关系Fig.3 The relationship between the variation of current and the logarithm of antibody concentration
参 考 文 献
[1]Al-Griw H H, Kraim E S, Farhat M E, et al. Evidence of ongoing brucellosis in livestock animals in North West Libya[J]. Journal of Epidemiology and Global Health, 2017, 7(4):285-288.
[2]Ahmed M O, Abouzeed Y M, Bennour E M, et al. Brucellosis update in Libya and regional prospective[J]. Pathogens and Global Health, 2015, 109(1):39-40.
[3]Assenga J A, Matemba L E, Muller S K, et al. Epidemiology of Brucella, infection in the human, livestock and wildlife interface in the Katavi-Rukwa ecosystem, Tanzania[J]. BMC Veterinary Research, 2015, 11(1):1-11.
[4]Galińska E M, Zagórski J. Brucellosis in humans-etiology, diagnostics, clinical forms[J]. Annals of Agricultural and Environmental Medicine Aaem, 2013, 20(2):233-238.
[5]杨秀芹,宋旭婷,徐雪,等. 绵羊群体中不同布鲁氏菌病血清学诊断方法比较研究[J]. 东北农业大学学报, 2016, 47(3):11-16.
[6]王秀丽,蒋玉文,毛开荣,等. 布鲁氏菌病实验室诊断方法的研究进展[J]. 中国兽药杂志, 2011, 45(11): 37-42.
[7]杨春光,王宏伟,彭心婷,等. 食品病原微生物快速检测技术研究进展[J]. 食品安全质量检测学报, 2015, 29(1):41-47.
[8]Dorothee G, Robert M K, Janos V, et al. Electrochemical Biosensors - Sensor Principles and Architectures[J]. Sensors, 2008, 8(3):1400.
[9]Mera K, Nagai M, Brock J W C, et al. Glutaraldehyde is an effective cross-linker for production of antibodies against advanced glycation end-products[J]. Journal of Immunological Methods, 2008, 334(1-2):82-90.
[10]陈敏,吴娜梅,陈瑾,等. 构建免标记电流型免疫传感器用于检测血清中癌胚抗原(CEA)[J]. 分析测试学报, 2014, 33(7):786-791.
[11]马艳,吴胜举,吕园丽,等. 超声生物效应的声学及其细胞学机制[J]. 天水师范学院学报, 2009, 29(2): 44-46.
[12]陈善真,李春玲,贾爱卿,等. 副猪嗜血杆菌OMP5基因的克隆、表达及间接ELISA检测方法的建立[J]. 中国农业科学, 2011, 44(14):3036-3044.
[13]苏敬阳,封瑞,吕力婷,等. 超声破碎法联合应用DTT提取纯化Ca_V1.2钙通道CT3蛋白[J]. 解剖科学进展, 2016(6):602-605.
[14]张灯,陈松月,秦利锋,等. 检测大肠杆菌O157:H7的电化学阻抗谱生物传感器的研究[J]. 传感技术学报, 2005, 18(1):5-9.
[15]杨婕,杨涛,侯士峰,等. (类)石墨烯纳米复合材料在DNA电化学传感器及生物小分子中的应用[J]. 分析试验室, 2017(9):1104-1110.
[16]Liebes Y, Amir L, Marks R S, et al. Immobilization strategies of Brucella particles on optical fibers for use in chemiluminescence immunosensors[J]. Talanta, 2009, 80(1):338-345.

