氟对小鼠睾丸间质组织中炎症细胞因子mRNA表达的影响
吕晓倩,裴雪静,吴盼红,孙子龙,王俊东
(山西农业大学 动物科技学院,山西 太谷 030801)
睾丸炎是男性不育的主要病因之一,多达的15%男性生育力失常是由睾丸的感染和炎症造成[1],局部和系统感染以及某些非感染因素均可以破坏睾丸免疫豁免机制引起睾丸炎和附睾-睾丸炎,从而损伤精子发生,导致不育。
氟作为一种微量元素,少量可防止龋齿的发生,而过量则会导致氟斑牙、氟骨病等疾病,近年来研究表明氟对于肝、肾、脑、睾丸等多种软组织也可产生严重损害。流行病学研究发现,相对于正常对照组居民,高氟地区男性不育及低出生率的概率显著升高[2,3]。同时,动物实验研究也显示,发育期氟暴露可引起 NF-κB 依赖的睾丸炎症反应,同时伴随血睾屏障损伤、生殖细胞凋亡和数量减少[4],氟暴露可以引起睾丸中炎症因子表达量的改变,最终损伤精子发生[5]。实验性自身免疫性睾丸炎(EAO)是一种以免疫细胞浸润、血睾屏障破坏、精子抗体产生、生殖细胞凋亡脱落等病理变化为主的免疫性睾丸炎症,是研究睾丸器官特异性自身免疫和慢性睾丸炎症的有效模型。
在以往研究中证明了氟可以引起睾丸炎症,多种变化与自身免疫性睾丸炎具有相似之处,本实验通过建立氟中毒及EAO模型,将二者进行比较,为预防高氟地区男性不育问题的发生提供研究资料。
1 材料
1.1 试验动物
选取8周龄健康ICR雄性小鼠24只,体重20~25 g,由中国辐射防护研究所提供,适应性饲养一周后平均分为3组,分别为对照组、NaF组、EAO组,对照组与EAO组饮用去离子水,NaF组饮用含有100 mg·L-1NaF的去离子水。
1.2 主要试剂
NaF购自天津化学试剂公司;弗氏完全佐剂与Ⅰ型胶原酶购自美国Sigma公司;Trizol、PrimeScriptTM RT Master Mix(Perfect Realtime)试剂盒及SYBR ©qRT-PCR试剂盒购自TAKARA公司。
1.3 主要仪器
生物显微镜购自日本Olympus公司;生物组织包埋机购自浙江金华惠支仪器设备有限公司;生物组织切片机购自德国Leica公司;生物组织摊烤片机购自湖北省孝感市亚光医用电子技术有限公司;组织匀浆仪购自于德国IKA公司;实时荧光定量PCR仪购自美国Life Technologies公司。
2 方法
2.1 试验性自身免疫性睾丸炎(EAO)模型建立
参考王文军等[6]与Doncel等[7]的方法,小鼠断颈处理,迅速移除睾丸,冰上匀浆,至组织块消失,200目尼龙网过滤后400 g 4 ℃离心,弃上清重悬于PBS中,台盼蓝染色,用红细胞计数板对细胞悬液进行计数,调至活细胞数达107个·200 mL-1,之后与弗氏完全佐剂等体积混匀,每只老鼠200 μL皮下注射,每两周一次,共3次。
2.2 小鼠睾丸组织形态学观察
睾丸离体后放入波恩氏液固定24 h,自来水冲洗过夜,常规梯度脱水,之后将组织进行透明,浸蜡,包埋。冷却凝固后切5 μm薄片,提前预热摊片机温度至45 ℃摊片,捞片后放入烤片机55 ℃烤片,完成后进行常规HE染色,封片后置于显微镜下观察睾丸组织形态学变化。
2.3 睾丸间质组织细胞的分离与RNA提取
参考Rival等[8]的方法,用眼科镊轻轻剥去睾丸外层白膜,置于小平皿中,加入0.3 g·L-1Ⅰ型胶原酶,34 ℃孵育15 min,冷PBS灭活,静置4 min,200目纱布过滤,300 g 4 ℃离心10 min,弃上清,PBS清洗沉淀,300 g 4 ℃离心10 min弃上清,采取Trizol法提取睾丸间质组织细胞中的RNA备用。
2.4 实时荧光定量PCR
从NCBI中查找目的基因RNA序列,利用Primer3.0Plus进行引物设计,设18 s为内参基因,引物序列见表1。本试验qRT-PCR分为两步,第一步:使用PrimeScriptTM RT Master Mix(Perfect Realtime)试剂盒将提取的RNA反转为cDNA,反应体系为20 μL,反应条件为37 ℃15 min,85 ℃5 s,4 ℃15 min。第二步:使用SYBR© qRT-PCR试剂盒进行qRT-PCR反应,反应体系为10 μL,其中SYBR©Premix Ex TaqTM Ⅱ(2×)5 μL,上下游引物各0.4 μL,ROX Reference DyeⅡ(50×)0.2 μL,cDNA模板2 μL,灭菌双蒸水3 μL。反应条件为95 ℃30 s,95 ℃5 s,60 ℃30 s,72 ℃30 s,共45个循环。
2.5 数据分析
目的基因mRNA的表达量采用2-△△CT法计算,采用Graphpad Prism5进行数据分析,利用单因素方差(ANOVA)方法分析数据,Dunnett’s多重比较检验。
3 结果与分析
3.1 睾丸HE染色结果
由图1可见,对照组小鼠睾丸中各级生精细胞排列整齐、结构正常,无生精细胞脱落现象,而100 mg·L-1NaF组小鼠睾丸可见生精细胞脱落,部分生精小管管壁不完整,管腔内精子数变少,偶见炎症细胞浸润,EAO组小鼠睾丸管间间隙增宽,生精小管内生精细胞层数减少,可见空泡样变化,有炎细胞浸润。

表1 3实时荧光定量PCR引物序列Table 1 Primer sequences for qRT-PCR

图1 睾丸石蜡切片HE染色(400×)Fig.1 Testis paraffin section with HE staining(400×)
3.2 相关基因的定量分析结果
由图2可见,与对照组相比,EAO组IL-6、IL-1β、TNF-α的表达量均显著升高,而IL-23的表达量显著下降。另外,相比对照组,NaF组IL-6、IL-23的表达显著升高,IL-1β虽有上升趋势但无显著性,TNF-α没有显著性。
4 讨论
睾丸是免疫豁免器官,睾丸间质中血管淋巴管及多种免疫细胞(巨噬细胞、肥大细胞、树突细胞、淋巴细胞)共同作用调节睾丸的免疫稳态,参与免疫监视。间质细胞可分泌雄激素,实验表明睾丸内高浓度睾酮对免疫豁免具有重要的调节作用,二者形成睾丸抵御病原的第一道防线。除此之外,睾丸支持细胞可在基底部形成血睾屏障(BTB),分泌细胞因子对睾丸的免疫、生精起调节作用,通过免疫抑制因子的自分泌和旁分泌作用维持睾丸的免疫豁免状态。当睾丸的免疫豁免功能遭到破坏时,则会导致睾丸炎的产生,甚至是自身免疫性睾丸炎。
氟对于睾丸免疫豁免功能的破坏在本实验室前期的研究中已经证明,通过对氟暴露小鼠血液、股骨、睾丸、附睾和精囊腺中氟含量的测定,发现 NaF组小鼠睾丸氟含量明显高于对照组,说明氟可以突破睾丸血睾屏障进入睾丸,对支持细胞及精子发生造成影响[9]。电镜结果表明高剂量NaF组处理后的小鼠睾丸基本观察不到支持细胞间的紧密连接,相关基因的mRNA表达量与蛋白表达量在NaF组出现显著性降低[10]。
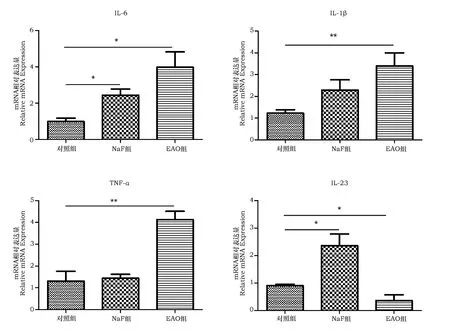
图2 相关细胞因子mRNA表达情况Fig.2 mRNA expression of related cytokines注:与对照组相比,*表示差异显著(P<0.05),** 表示差异极显著(P<0.01)。Note:Compare with the control group, * means significant difference at P<0.05 level; ** means extreme significant difference at P < 0.01 level.
EAO模型是利用自行免疫性睾丸炎的原理,用同种属睾丸组织匀浆免疫小鼠,来诱导自身免疫性睾丸炎的产生,其模型建立可通过病理变化确定。崔红晶等[11]建立了大鼠的EAO模型,与对照组相比模型组睾丸萎缩,色白质软,在光镜下模型组生精上皮细胞坏死脱落。炎性细胞增生浸润,间质水肿,生精细胞排列紊乱,破坏严重。而炎症的发生往往通过细胞因子来产生作用,Binder S等[12]与Guazzone V A等[13]通过qRT-PCR与ELISA对EAO模型小鼠睾丸中相关细胞因子的表达量检测发现,与对照组相比,IL-1α,IL-1β,IL-1Rα, IL-6,TNF-α和IFN-γ的表达量均显著上升。
睾丸间质中存在多种免疫细胞,可表达多种细胞因子,这些细胞因子的存在对于睾丸免疫微环境的维护具有重要作用。IL-1β可调节下丘脑-垂体-性腺轴[14],在发生炎症反应时表达量增加,损伤精子发生。IL-6 可以增强免疫细胞的杀伤活性,还可以通过影响支持细胞的分泌功能来调节精子发生[15]。TNF-α可增加内皮通透性,使淋巴细胞更容易进入睾丸,在正常生理状态下抑制生精细胞凋亡,然而在发生炎症时睾丸中TNF-α水平升高,可诱导生精细胞凋亡[16]。此外,IL-23在睾丸炎的发生过程中起重要作用[17]。
由试验结果可以看出,氟对于小鼠睾丸组织结构造成了一定程度破坏,导致了生精细胞的脱落与管间隙的增宽,而EAO组的情况则更为严重,二者所表现出的病理变化相似,但程度不同。由于分泌炎症因子的细胞主要存在于间质中,所以在本试验中提取了间质组织细胞来检测相关炎症因子的mRNA表达量。结果表明,在氟处理组中,IL-6、IL-23的表达显著升高,IL-1β虽有上升趋势但无显著性,而EAO组中IL-6、IL-1β、TNF-α的表达量均显著升高,存在相同点,但也有不同之处,出现这样的结果可能是由于NaF组攻毒时间较短,仅能说明短时间大剂量氟暴露所产生的睾丸损伤情况与EAO模型存在共同点,对于慢性氟中毒与EAO模型的相似之处及氟中毒产生睾丸炎的具体作用机制仍需进一步研究。
参 考 文 献
[1]Schuppe, H C, Meinhardt A, Allam J P, et al. Chronic orchitis: a neglected cause of male infertility[J]. Andrologia, 2008, 40(2):84-91.
[2]Zhang M, Wang A, He W, et al. Effects of fluoride on the expressin of NCAM, oxidative stress, and apoptosis in primary cultured hippocampal neurons[J]. Toxicology, 2007, 236(3):208.
[3]Azamar Y, Uribe S, Mújica A. F-actin involvement in guinea pig sperm motility.[J]. Molecular Reproduction & Development, 2010, 74(3):312-320.
[4]Zhang S, Jiang C, Liu H, et al. Fluoride-elicited developmental testicular toxicity in rats: roles of endoplasmic reticulum stress and inflammatory response.[J]. Toxicology and Applied Pharmacology, 2013, 271(2):206-215.
[5]Wei R, Luo G, Sun Z, et al. Chronic fluoride exposure-induced testicular toxicity is associated with inflammatory response in mice[J]. Chemosphere, 2016, 153:419.
[6]王文军, 陈系古, 杨冬梓,等. BALB/c鼠自身免疫性睾丸炎动物模型的制作[J]. 中山大学学报(医学科学版), 2006, 27(2):148-152.
[7]Doncel G F, Di P J, Lustig L. Sequential study of the histopathology and cellular and humoral immune response during the development of an autoimmune orchitis in Wistar rats.[J]. American Journal of Reproductive Immunology, 1989, 20(2):44-51.
[8]Rival C, Guazzone V A, Von W W, et al. Expression of co-stimulatory molecules, chemokine receptors and proinflammatory cytokines in dendritic cells from normal and chronically inflamed rat testis[J]. Molecular Human Reproduction, 2007, 13(12):853-861.
[9]孙子龙, 牛瑞燕, 王俊东. 氟对雄性小鼠生长发育及性腺中氟含量的影响[J]. 中国畜牧兽医, 2012, 39(3):227-229.
[10]张连杰. 氟对睾丸支持细胞免疫豁免功能的影响及其机制研究[D太谷:山西农业大学, 2015.
[11]崔红晶, 安长新, 贺晓舟,等. TNF-α在大鼠自身免疫性睾丸炎中的表达与定位[J]. 中国热带医学, 2009, 9(2):251-252.
[12]Binder S, Ganaiem M, Huleihel M, et al. Testicular and splenic cytokines in experimental autoimmune orchitis[J]. Journal of Reproductive Immunology, 2010, 86(2):81-81.
[13]Guazzone V A, Jacobo P, Theas M S, et al. Cytokines and chemokines in testicular inflammation: a brief review[J]. Microscopy research and technique, 2009, 72(8): 620-628.
[14]Rivier C, Vale W. In the rat, interleukin-1 alpha acts at the level of the brain and the gonads to interfere with gonadotropin and sex steroid secretion[J]. Endocrinology, 1989, 124(5):2105-2109.
[15]Rival C, Theas M S, Guazzone V A, et al. Interleukin-6 and IL-6 receptor cell expression in testis of rats with autoimmune orchitis[J]. Journal of Reproductive Immunology, 2006, 70(1-2):43-58.
[16]Theas M S, Rival C, Jarazodietrich S, et al. Tumour necrosis factor-α released by testicular macrophages induces apoptosis of germ cells in autoimmune orchitis[J]. Human Reproduction, 2008, 23(8):1865-1872.
[17]Duan Y G, Yu C F, Novak N, et al. Immunodeviation towards a Th17 immune response associated with testicular damage in azoospermic men[J]. International Journal of Andrology, 2011, 34(6pt2):536-545.

