安徽地区汉族人群肿瘤患者UGT1A1*6基因多态性分布的差异性研究
栾家杰,刘 俊,汪 琳,朱艳虹,周德喜,左 坚,徐振宇
(皖南医学院 1.弋矶山医院药剂科、2.药事管理学教研室,安徽 芜湖 241001)
尿苷二磷酸葡萄糖醛酸转移酶(uridine diphosphate glucuronosyltransferase,UGT)是体内重要第II相生物转化代谢酶,催化葡萄糖醛酸与底物的结合,将内源性和外源性化合物通过胆汁或肾脏排出体外。UGT主要通过UGT基因编码,该基因可分为UGT1A和UGT2两个家族[1]。人类UGT1A基因位于染色体2q37,可编码9种UGT1A酶,其中UGT1A1酶为机体重要的发挥解毒作用的代谢酶之一,其编码基因UGT1A1存在遗传多态性,是个体间葡萄糖醛酸化活性差异的重要原因之一。其中,UGT1A1*6和UGT1A1*28多态性与某些药物疗效与不良反应具有密切临床相关性,如抗肿瘤药伊立替康。
伊立替康于1998年获得美国食品药品监督管理局(food and drug administration,FDA)批准,用于标准化疗方案失败后的转移性或晚期大肠癌的治疗。目前,临床也用于胃癌、胰腺癌、肺癌、宫颈癌、乳腺癌等的治疗,均获得较为满意的临床疗效。即使单克隆抗体等靶向制剂在大肠癌的治疗中发挥重要作用[2],但以伊立替康为基础的联合化疗仍是晚期大肠癌首选治疗方案,但20%~30%患者可发生3~4级迟发性腹泻和中性粒细胞减少,导致患者生活质量下降而延迟治疗,严重者导致死亡[3]。近年来,UGT1A1基因多态性与伊立替康不良反应关联性研究成为焦点,也证实了UGT1A1*6和UGT1A1*28与伊立替康不良反应的相关性[4]。FDA于2005年批准UGT1A1*28基因型用于预测伊立替康不良反应。UGT1A1*28等位基因在非洲人群及西方高加索人群分布频率分别为12%~27%和5%~15%,亚洲人群中分布仅为1.2%~5.0%[5];而UGT1A1*6等位基因在亚洲人群中分布频率可达到13%~23%[6],为亚洲人所特有的突变型。因此,UGT1A1*6基因多态性分布可能对预测亚洲人群使用伊立替康后发生相关不良反应的风险更具有临床实用价值。通过对基因组学等的研究和转化,对肿瘤患者实施个体化的精准医疗[7]。本文通过对来自安徽省多家医疗机构送检的肿瘤患者的血液样本进行UGT1A1*6基因检测,以了解UGT1A1*6基因在安徽地区汉族人群肿瘤患者中多态性分布情况,为临床预测伊立替康毒性风险提供参考,并为临床实施伊立替康个体化治疗提供科学依据。
1 材料与方法
1.1标本来源血液标本主要来源于安徽省第二人民医院、安徽省肿瘤医院、安徽医科大学第一附属医院、合肥市滨湖医院、合肥市第二人民医院、合肥市第三人民医院、解放军第105医院、中铁四局集团中心医院、蚌埠医学院第一附属医院、蚌埠医学院第二附属医院、怀远县人民医院、亳州市人民医院、滁州市第一人民医院、皖南医学院弋矶山医院、芜湖市第二人民医院、宁国市人民医院、宣城市人民医院、马鞍山市人民医院、铜陵市人民医院、阜阳市人民医院、安庆海军116医院等20家医疗机构2014年4月~2016年12月期间送检的222例汉族肿瘤患者。本研究方案经过皖南医学院弋矶山医院医学伦理委员会伦理审查并批准(编号:2014伦审新第25号)。
1.2仪器与试剂L998A型荧光检测仪(西安天隆科技有限公司)。核酸纯化试剂,商品名:耀金保,主要成分为60%聚乙二醇200、20 mmol·L-1氢氧化钾和去离子水,第一类体外诊断试剂产品备案号:京大械备20150010号,北京华夏时代基因科技发展有限公司生产;基因检测通用试剂,商品名:耀金分,主要成分为20 mmol·L-1三羟甲基玩基甲烷-盐酸缓冲液、50 mmol·L-1氯化钾、1.5 mmol·L-1氯化镁、0.1%吐温20、0.01%牛血清白蛋白、5 mmol·L-1磷酸、寡核苷酸、1 U KOD DNA聚合酶、200 mmol·L-1三磷酸碱基脱氧核苷酸,第一类体外诊断试剂产品备案号:京大械备20150009号,北京华夏时代基因科技发展有限公司生产;10×氯化铵溶液(北京华夏时代基因科技发展有限公司)。
1.3UGT1A1*6基因分型选用乙二胺四乙酸二钠抗凝采血真空管采集患者外周静脉血2~3 mL,采用荧光染色原位杂交分析技术对患者血液标本进行基因型检测。具体操作步骤:10×氯化铵溶液与灭菌水按1: 9比例稀释为工作液备用;在灭菌的1.5 mL离心管中加入1 mL工作液,取200 μL混匀的待检全血抗凝标本加入离心管中,颠倒混匀,室温静置5 min后,以3 000 r·min-1离心5 min;弃上清,离心管底部可见白色米粒大小白细胞沉淀;在白细胞沉淀中加入100 μL核酸纯化试剂,吹打混匀后,室温静置30 min,得到白细胞混悬液;吸取1.5 μL白细胞混悬液,加入相应测序反应通用试剂中,盖紧管帽,置入检测设备荧光检测仪中,打开荧光染色原位杂交分析系统,选择待检测的基因类型,运行设备进行检测;采用荧光染色原位杂交分析系统自动判读荧光信号值,获取荧光曲线图,进行UGT1A1*6基因分型,并作阳性质控。
2 结果
2.1患者一般情况特征送检的222例肿瘤患者中,男性154例(占69.37%),女性68例(占30.63%);患者年龄21~89岁,平均(59.41±11.41)岁,其中结直肠癌116例、肺癌59例、胃癌17例、食道癌8例、其他类型肿瘤22例(其中乳腺癌7例、卵巢癌5例、十二指肠癌5例、子宫内膜癌2例、胆囊癌2例、胰腺癌1例)。
2.2UGT1A1*6基因型分布UGT1A1*6依据基因型不同分为野生型*1/*1(或GG)、突变杂合型*1/*6(或GA)及突变纯合型*6/*6(AA),其代表性荧光曲线图见Fig 1。送检的222例肿瘤患者样本中,UGT1A1*6野生型*1/*1(GG)159例次,占总例次71.62%,突变杂合型*1/*6(GA)52例次,占23.42%,及突变纯合型*6/*6(AA)11例次,占4.96%。G等位基因分布频率为83.33%,UGT1A1*6突变率为16.67%,且基因分布符合Hardy-Weinberg遗传平衡(P>0.05),达到遗传平衡,具有群体代表性(Tab 1)。

Tab 1 Distribution of UGT1A1*6 gene polymorphisms and alleles in 222 cancer patients
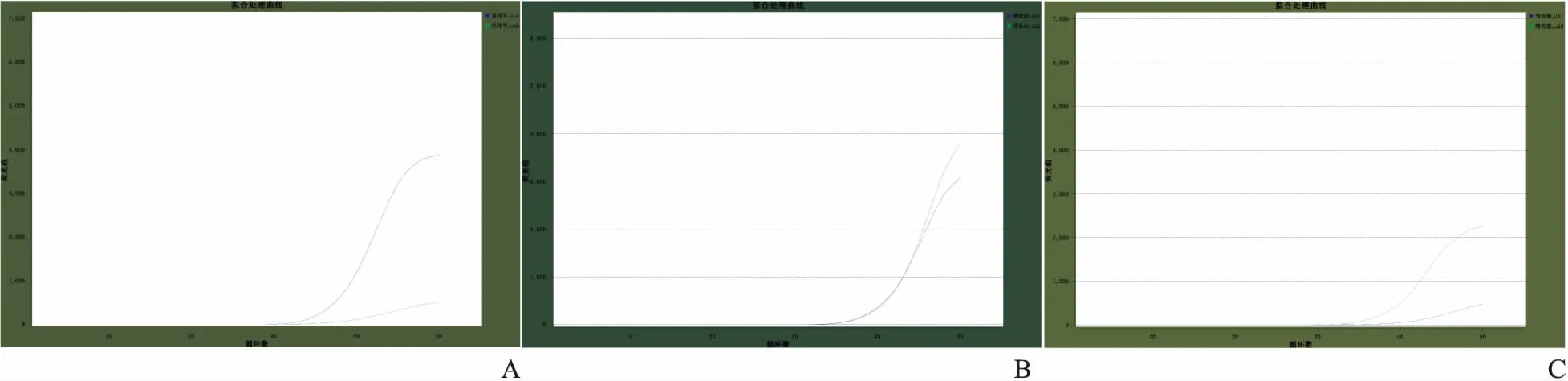
Fig 1 Representative fluorescence graphs of different UGT1A1*6 genotypes
2.3不同临床特征肿瘤患者UGT1A1*6基因型和等位基因分布情况通过比较UGT1A1*6基因型和等位基因在不同性别、年龄、肿瘤发生部位以及地区来源中分布发现,UGT1A1*6基因型分布和等位基因分布频率与患者性别和年龄无相关性,但在肿瘤发生部位及地区来源方面差异有统计学意义(P<0.05),见Tab 2、3。
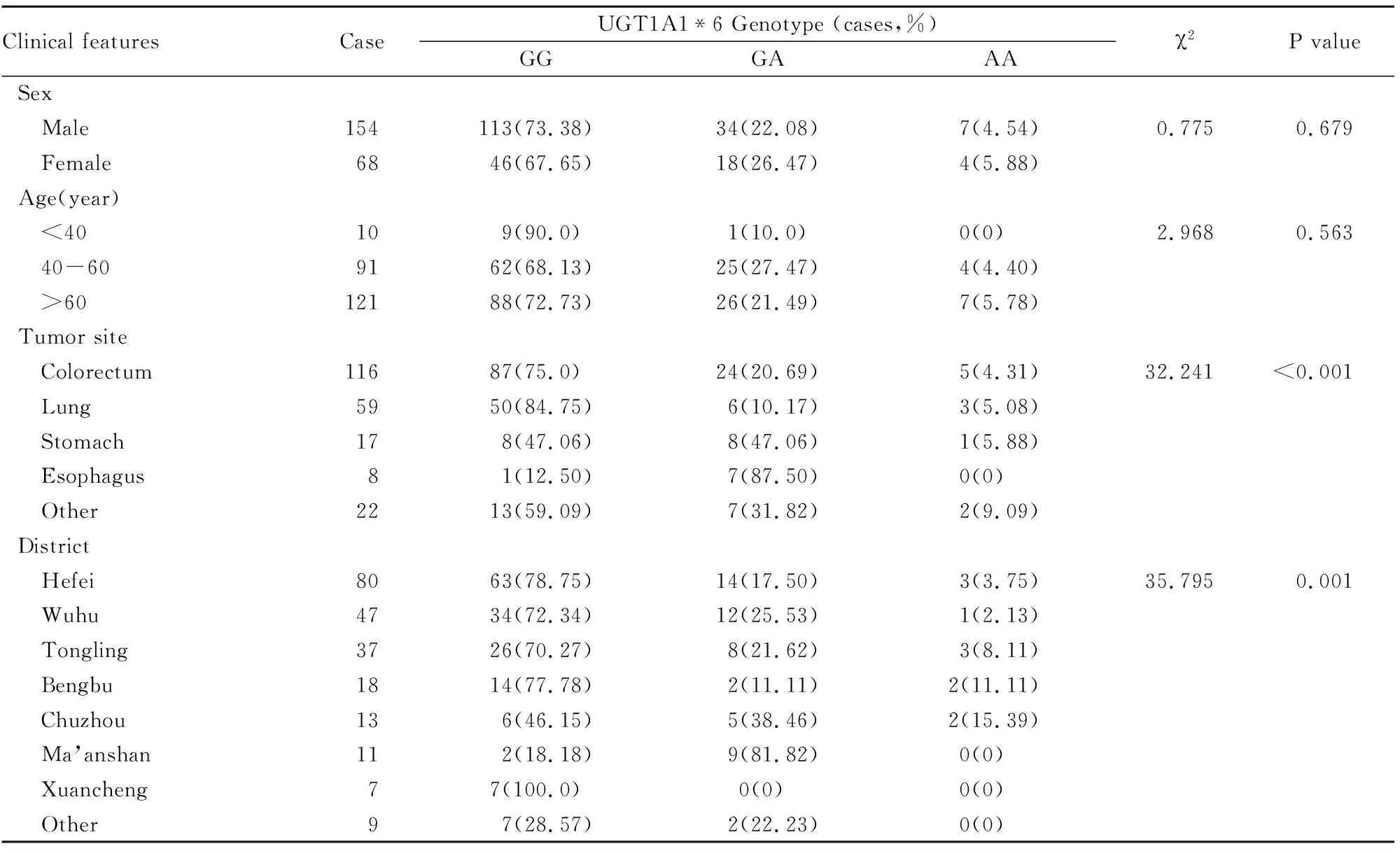
Tab 2 Comparison of distribution of UGT1A1*6 genotype in 222 cancer patients with different clinical features
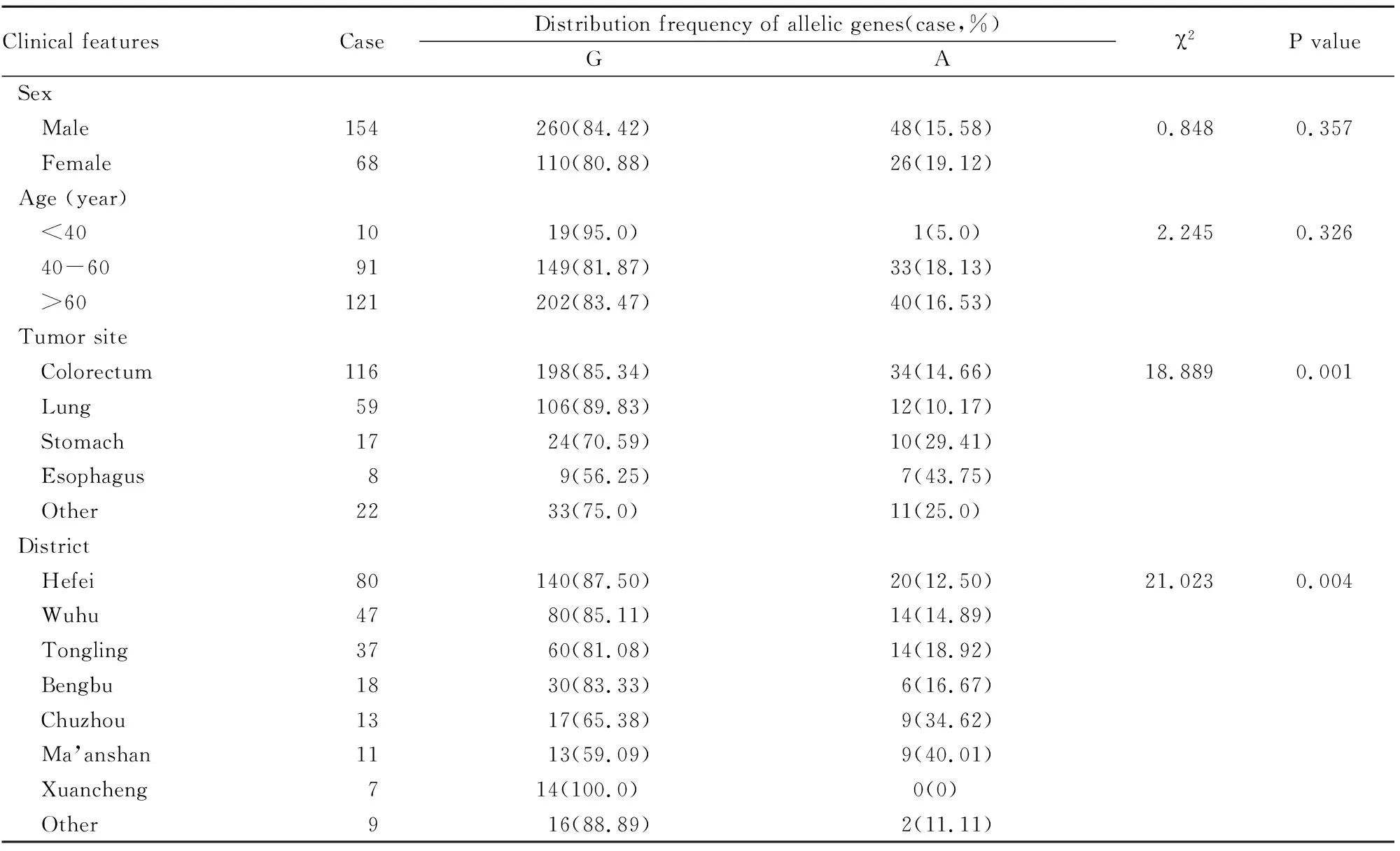
Tab 3 Comparison of distribution frequency of UGT1A1*6 allelic genes in 222 cancer patients with different clinical features
3 讨论
伊立替康是一种无活性前体药,在人体内经羧酸酯酶2(carboxylesterase-2,CES2)的活化,转变为活性代谢产物7-乙基-10羟基-喜树碱(7-ethyl-10-hydroxycamptothecin,SN-38)。SN-38为DNA拓扑异构酶I(topoisomerase 1,Top1)抑制剂,通过抑制人体细胞DNA复制所需的Top1,诱导DNA单链损伤,阻断DNA复制而产生细胞毒性作用。SN-38主要在肝脏内经UGT1A1酶灭活成葡萄糖醛酸化SN-38(SN-38 glucuronide,SN-38G),经胆汁排入肠道,在肠道β-葡萄糖醛酸酶作用下转化为SN-38,引发肠黏膜损伤及迟发性腹泻。伊立替康所致迟发性腹泻为剂量限制性,一般发生在用药后d 5,其发生率约20%。此外,伊立替康在杀伤肿瘤细胞同时,也损伤患者正常细胞,尤其是导致中性粒细胞减少,一般发生在用药后的d 8。法国有研究采用FOLFIRI方案(伊立替康+四氢叶酸钙+氟尿嘧啶)治疗转移性结直肠癌患者,当伊立替康剂量达到260 mg·m-2,3~4级中性粒细胞减少的发生率为61%,腹泻发生率为18%[8]。
目前研究认为,伊立替康相关不良反应的发生与UGT1A1基因多态性密切相关,其中研究较多的为UGT1A1*6和UGT1A1*28单核苷酸多态性,该基因多态性可导致SN-38葡萄糖醛酸化速率最多可产生50倍差异。对于携带突变型等位基因的个体,UGT1A1酶活性下降,使得其对SN-38葡萄糖醛酸化能力减弱,引起SN-38体内蓄积,从而导致严重毒性反应。UGT1A1*28突变纯合型对SN-38的葡萄糖醛酸化的活性仅为野生型的35%[9]。研究表明[10],UGT1A1*28纯合突变型患者中性粒细胞减少发生率分别较野生型和杂合突变型患者增加4倍和3倍,腹泻发生率增加2倍。FDA规定,对于UGT1A1*28突变纯合子个体在使用伊立替康时,应根据患者具体情况降低剂量,以减少药品不良反应的发生。由于亚洲人群UGT1A1*28 分布频率较低,约为1.2%~5.0%,故没有足够证据证明UGT1A1*28亚洲人群使用伊立替康发生毒性之间的关系。日本1项针对宫颈癌或卵巢癌患者研究结果表明[11],携带UGT1A1*6突变等位基因患者发生3~4级中性粒细胞减少、血小板减少和腹泻的比例均明显升高。Gao等[12]在中国食管癌和胃癌患者中研究表明,UGT1A1*6突变型与3~4级中性粒细胞减少存在相关性。Meta分析结果表明,UGT1A1*6突变型患者使用中高剂量伊立替康时发生3~4级中性粒细胞减少风险明显增加[13]。UGT1A1*6突变型可使UGT1A1酶的葡萄糖醛化能力下降70%。药物基因组学知识数据库(pharmacogenomics knowledge base , Pharm GKB)推荐,伊立替康给药剂量大于250 mg·m-2的患者,UGT1A1*28携带者应减少30%剂量,而剂量低于250 mg·m-2者,则不用下调剂量。然而,国内伊立替康给药剂量相对减低,通常为125 mg·m-2或120 mg·m-2,或者更低,而UGT1A1*6基因突变与使用60 mg·m-2以上剂量伊立替康发生不良反应相关,能够更好预测中国人群采用较低剂量伊立替康发生不良反应的风险。因此,研究UGT1A1*6在中国区域人群中多态性分布,从而筛查风险人群,实施个体化治疗方案,具有重要临床意义。
UGT1A1*6存在明显种族及区域分布差异。UGT1A1*6目前仅在亚洲人群中发现,其分布频率约为13%~23%[6],其汉族随机人群中突变频率约为45%。吴穷等[14]在皖北地区人群中研究发现,UGT1A1*6野生型(GG)、突变杂合型(GA)和突变纯合型(AA)发生频率分别为73.7%、21.1%和5.3%,UGT1A1*6突变率为15.79%。本研究通过对来自安徽省不同地区的汉族人群进行UGT1A1*6基因检测,结果表明,222例送检肿瘤患者中,GG型占71.62%,GA型为23.42%,AA型4.96%,A等位基因发生频率为16.67%,与文献报道[14]相似。来向阳等[15]研究认为,男性、<40岁、肠道、山东地区、甘肃地区肿瘤患者UGT1A1*6基因型分布差异有统计学意义。本研究发现, UGT1A1*6在食道癌患者中突变率43.75%,明显高于其他部位肿瘤患者(P=0.001),且在马鞍山及滁州地区突变率分别为40.01%和34.62%,明显高于其他地区来源的患者(P=0.004)。因此,UGT1A1*6基因分型基础上,还要关注患者肿瘤发生部位及地区来源。
综上所述,本研究选取了来自安徽不同地区肿瘤患者资料,且选取的样本达到遗传平衡,基本能够反映UGT1A1*6在安徽地区汉族人群中的多态性分布。通过初步了解UGT1A1*6在安徽地区汉族人群中分布频率,为伊立替康实施个体化治疗提供用药参考。但本研究仍存在一定不足,如没有进一步阐明UGT1A1*6基因多态性与伊立替康不良反应的关联性,且由于纳入的样本量有限,可能在统计上存在偏倚。此外,随着对伊立替康不良反应相关基因多态性研究的深入,羧酸酯酶、细胞色素P450 3A4、有机阴离子转运多肽、ABC转运蛋白等基因多态性与伊立替康不良反应发生的关联性也逐渐被揭示。除了遗传因素外,患者年龄、性别、合并用药及生活习惯等非遗传因素均可能影响伊立替康不良反应的发生。因此,大样本、多因素联合研究对于预测伊立替康不良反应发生风险显得尤为重要,以期提高患者临床疗效,降低患者用药风险,实施临床个体化治疗。
[1] Mackenzie P I, Bock K W, Burchell B, et al. Nomenclature update for the mammalian UDP glycosyltransferase (UGT) gene superfamily[J].PharmacogenetGenomics, 2005,15(10):677-85.
[2] 郭建军,王丽丽,张 琪,等.单克隆抗体药物的药代动力学研究进展[J].中国药理学通报,2016,32(2):172-6.
[2] Guo J J,Wang L L,Zhang Q,et al. Progress on pharmacokinetic studies of therapeutic monoclonal antibodies[J].ChinPharmacolBull,2016,32(2):172-6.
[3] 王 岩,葛飞娇,林 莉,等. UGT1A1基因多态性与伊立替康为主方案治疗晚期结直肠癌的毒性和疗效的相关性分析[J].临床肿瘤学杂志,2012,17(11):961-6.
[3] Wang Y,Ge F J,Lin L,et al.Correlation between UGT1A1 gene polymorphisms and toxicity and efficacy in patients with metastatic colorectal treated with irinotecan based chemotherapy[J].ChinClinOncol,2012,17(11):961-6.
[4] Wang Y,Shen L,Xu N,et al. UGT1A1 predicts outcome in colorectal cancer treated with irinotecan and fluorouracil [J].WorldJGastroenterol,2012,18(45):6635-44.
[5] Zhou C F,Ma T,Su Y,et al. UGT1A1 gene polymorphisms and the toxicities of FOLFIRI in Chinese Han patients with gastrointestinal cancer [J].AnticancerAgentsMedChem,2013,13(2):235-41.
[6] Teh L K,Hashim H,Zakaria Z A,et al. Polymorphisms of UGT1A1*6,UGT1A1* 27 & UGT1A1* 28 in three major ethnic groups from Malaysia[J].IndianJMedRes,2012,136(2):249.
[7] 陈长仁,何发忠,周宏灏,等.精准医学的基础研究与临床转化[J].中国药理学通报,2015,31(12):1629-32.
[7] Cheng C R,He F Z,Zhou H H,et al. Basic research and clinical translation of precision medicine[J].ChinPharmacolBull,2015,31(12):1629-32.
[8] Duffour J,Gourgou S,Desseigne F,et al. Multicentre phase II study using increasing doses of irinotecan combined with a simplified LV5FU2 regimen in metastatic colorectal cancer[J].CancerChemotherPharmacol,2007,60(3):383-9.
[9] Schulz C,Heinemann V,Schalhorn A,et al. UGT1A1 gene polymorphism:impact on toxicity and efficacy of irinotecan based regimensio metastatic colorectal cancer[J].WorldJGastroenterol,2009,15(40):5058-66.
[10] Liu X,Cheng D,Kuang Q,et al. Association of UGT1A1*28 polymorphisms with irinotecan-induced toxicities in colorectal cancer:a meta-analysis in Caucasians[J].PharmacogenomicsJ,2014,14(2):120-9.
[11] Takano M,Kato M,Yoshikawa T,et al. Clinical significance of UDP- glucuronosyltransferase 1A1*6 for toxicities of combination chemotherapy with irinotecan and cisplatin in gynecologic cancers:a prospective multi-institutional study[J].Oncology,2009,76(5):315-21.
[12] Gao J,Zhou J,Li Y,et al. Associations between UGT1A1*6/*28 polymorphisms and irinotecan-induced severe toxicity in Chinese gastric or esophageal cancer patients [J].MedOncol,2013,30(3):630.
[13] 印亚双,王培香,段京莉.伊立替康致3~4级中性粒细胞减少与UGT1A1基因多态性相关性的Meta分析[J].中国药房,2017,28(18):2523-8.
[13] Yin Y S,Wang P X,Duan J L. Meta-analysis of association between irinotecan-induced 3-4 degree neutronpenia and UGT1A1 gene polymorphism[J].ChinPharm,2017,28(18):2523-8.
[14] 吴 穷,汪 蕊,陈余清,等. UGT1A1基因多态性在FOLFIRI方案二线治疗转移性结直肠癌中的临床意义[J].临床肿瘤学杂志,2013,18(11):990-5.
[14] Wu Q,Wang R,Chen Y Q,et al.Clinical significance of UGT1A1 gene polymorphisms on FOLFIRI regimen as second-line treatment in metastatic colorectal cancer[J].ChinClinOncol,2013,18(11):990-5.
[15] 来向阳,衡雪源,车峰远,等. 中国部分地区肿瘤患者UGT1A1*28和UGT1A1*6位点基因多态性分布的差异研究[J].中国全科医学,2016,10(30):3705-10.
[15] Lai X Y,Heng X Y,Che F Y,et al. Frequency of UGT1A1*28 and UGT1A1*6 gene polymorphisms in cancer patients in some areas of China[J].ChinaGenPract,2016,10(30):3705-10.