利拉鲁肽诱导肥胖2型糖尿病大鼠白色脂肪组织中FGF21的表达及机制
张 楠,张 一,章 秋,鲁云霞
(1. 安徽医科大学附属第一医院内分泌科,安徽 合肥 230022;2. 安徽医科大学生物化学教研室,安徽 合肥 230032)
由于全球肥胖或超重人群的逐年增加,导致胰岛素抵抗、2型糖尿病(type 2 diabetes mellitus,T2DM)等代谢性疾病的发病率明显上升[1]。新一代的降糖药胰高血糖素样肽-1类似物(glucagon-like peptide-1 analogues,GLP-1A)因具有独特的降糖机制、安全有效的降糖效果及减轻体重的特点,成为内分泌代谢病领域的研究热点。目前临床上常用的GLP-1A包括利拉鲁肽(liraglutide,LRG)、艾塞那肽、阿必鲁泰等。
成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)是一种新型的代谢调控分子,在包括肝脏、脂肪组织、胰腺等多个组织中都有表达,通过与辅助受体β-Klotho及FGF受体(fibroblast growth factor receptors, FGFRs)结合,实现调控糖脂代谢的功能[2]。Chau等[3]研究表明,FGF21通过激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK),增强线粒体氧化作用来调控脂肪细胞的能量平衡。GLP-1A可通过影响FGF21水平发挥作用。Yang等[4]报道,注射高剂量的利拉鲁肽(1 mg·kg-1),每日2次,连续8周,可增加高脂饮食脂联素基因敲除大鼠血FGF21的水平,改善胰岛素抵抗。利拉鲁肽可诱导KKAy小鼠肝脏FGF21生成,改善肥胖和高血糖,并增加GLP-1活性[5]。近期研究表明,利拉鲁肽通过激活脂肪组织中的固有天然杀伤T细胞(iNKT),诱导其FGF21的表达来调节体重和血糖[6]。但是,利拉鲁肽对肥胖T2DM白色脂肪组织(white adipose tissue,WAT)中FGF21水平及AMPK、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径的影响目前尚未见相关报道。本研究先建立肥胖T2DM大鼠模型,再予以利拉鲁肽干预,观察其对附睾脂肪组织细胞的形态学和FGF21表达、AMPK和MAPK信号通路的影响,以阐述其作用机制。
1 材料与方法
1.1材料
1.1.1实验动物 40只8周龄SD大鼠,♂,体质量(170±20)g,购自安徽医科大学实验动物中心,每笼5只,温度(20~25)℃,相对湿度35%~60%,自由摄食和进水,适应性饲养1周。
1.1.2药物与试剂 利拉鲁肽(诺和力)购自诺和诺德中国制药有限公司;链脲佐菌素(streptozotocin,STZ)购自美国Sigma-Aldrich公司;RNAiso Reagent、逆转录试剂盒、Premix TaqTM购自大连宝生物工程有限公司;所有引物均采用Primer 5.0软件设计,由上海生工生物工程有限公司合成;RIPA裂解液购自南京凯基生物科技有限公司;肝激酶B1(liver kinase B1, LKB1)、p-LKB1、AMPK、p-AMPK、乙酰CoA羧化酶(acetyl-CoA carboxylase,ACC)、p-ACC兔多克隆抗体购自美国Cell Signaling Technology公司;细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、p-ERK、c-Jun N端激酶(c-Jun N-terminal kinase,JNK)、p-JNK、p38、p-p38抗体购自美国Bioworld公司;FGFR3和p-FGFR3抗体购自美国Affinity公司;过氧化物体增殖剂活化受体γ (peroxisome proliferator-activated receptor γ,PPARγ)抗体购自美国Abcam公司;β-actin鼠单克隆抗体、山羊抗小鼠二抗、山羊抗兔二抗购自北京中杉金桥生物技术有限公司;增强化学发光底物检测试剂盒(ECL发光剂)购自美国Thermofisher公司。
1.1.3仪器 Olympus AU640全自动生化分析仪;日本Nikon 80i荧光正置显微镜;英国Teche PCR仪;北京六一仪器厂电泳仪、电转仪;Gel Documentation system曝光系统和Chemi Scope series凝胶成像系统均购自Clinx科学仪器有限公司。
1.2方法
1.2.1动物分组 适应性饲养1周后,将SD大鼠随机分为正常饮食组(CON,n=8)和高脂饮食组(HFD,n=32),CON组给予标准饲料,HFD组给予高脂饮食,8周后,HFD组大鼠给予小剂量STZ(30 mg·kg-1)一次性腹腔注射,建立肥胖T2DM大鼠模型(体质量超过基础饲料组平均体质量20%,取尾静脉血,测空腹血糖>7.8 mmol·L-1,即为造模成功),再随机分为2组:假干预组(DM,腹腔注射生理盐水)和利拉鲁肽干预组(DM+LRG,腹腔注射利拉鲁肽0.4 mg·kg-1·d-1,每天2次),干预6 周。所有操作均遵守安徽医科大学实验动物伦理委员会要求。
1.2.2血清代谢指标和FGF21测定 所有大鼠禁食12 h后水合氯醛麻醉,腹主动脉取血,分离血清(3 000 r·min-1,15 min),分析血清甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、丙氨酸转氨酶(alanine transaminase,ALT)、天冬氨酸转氨酶(aspartate transaminase,AST),ELISA法测定血清FGF21水平。
1.2.3病理形态学观察 取附睾脂肪组织,以10%的中性多聚甲醛固定,石蜡包埋切片,进行常规HE染色,在光镜下观察并拍照。
1.2.4免疫组化分析 石蜡包埋脂肪组织以4 μm连续切片,SABC法进行PPARγ、p-AMPK、p-ACC、p-ERK的免疫组化分析,DAB显色,苏木精复染细胞核,使用PBS缓冲液代替一抗作为空白对照,光镜下观察并拍照。每张切片随机选取10个视野,用生物图像软件计算各组免疫阳性细胞的平均光密度值(integral optical density, IOD )。
1.2.5RT-PCR RNAiso Reagent提取各组大鼠附睾脂肪组织总RNA,逆转录合成cDNA,RT-PCR分析FGF21、FGFR3、LKB1、AMPK、ACC的mRNA表达,GAPDH作为内参照,应用Gel Documentation System曝光系统对目的基因和参照基因条带进行定量分析。检测的目的基因及引物序列见Tab 1。

Tab1 Primer sequences for target genes
1.2.6Western blot 取0.1 g附睾脂肪组织,RIPA裂解液制备匀浆,12 000 r·min-1、4℃离心15 min取上清抽提总蛋白并定量。以β-actin为内参照,Western blot法检测FGF21、β-klotho、p-FGFR3、FGFR3、p-LKB1、LKB1、p-AMPK、AMPK、p-ACC、ACC、p-JNK、JNK、p-p38、p38、p-ERK、ERK的蛋白表达,Chemi Scope series凝胶成像系统分析结果。
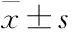
2 结果
2.1利拉鲁肽对DM大鼠体质量的影响与CON组相比,DM组体质量明显上升,与DM组相比,DM+LRG组的体质量明显下降,表明利拉鲁肽有降低DM大鼠体质量的作用,见Fig 1。
2.2利拉鲁肽对DM大鼠血生化指标、血清FGF21水平的影响与CON组比较,DM组大鼠TC、TG、ALT、AST均明显升高,DM+LRG组TC、TG与 DM组相比差异无统计学意义,ALT、AST水平明显降低(P<0.05或P<0.01),HDL-C明显升高(P<0.01),见Tab 2。与DM组相比,DM+LRG组血清FGF21水平明显升高(Fig 2)。
2.3利拉鲁肽对DM大鼠白色脂肪细胞大小的影响与CON组相比,DM组大鼠的WAT中脂肪细胞的体积明显增大(P<0.01);与DM组相比,DM+LRG组的WAT中脂肪细胞明显变小(P<0.01)。对脂肪细胞大小进行测量的结果与上述描述一致,见Fig 3。
2.4利拉鲁肽对DM大鼠白色脂肪组织mRNA表达的影响与CON组相比,DM组大鼠WAT中FGF21、FGFR3、AMPK、ACC基因的mRNA 表达较CON组增高,LKB1基因表达下降,差异均有统计学意义(P<0.05或P<0.01)。与DM组相比,DM+LRG组WAT中FGF21、FGFR3的mRNA表达继续上升,而LKB1、AMPK、ACC的mRNA表达下降,差异均有统计学意义(P<0.05或P<0.01),见Fig 4。
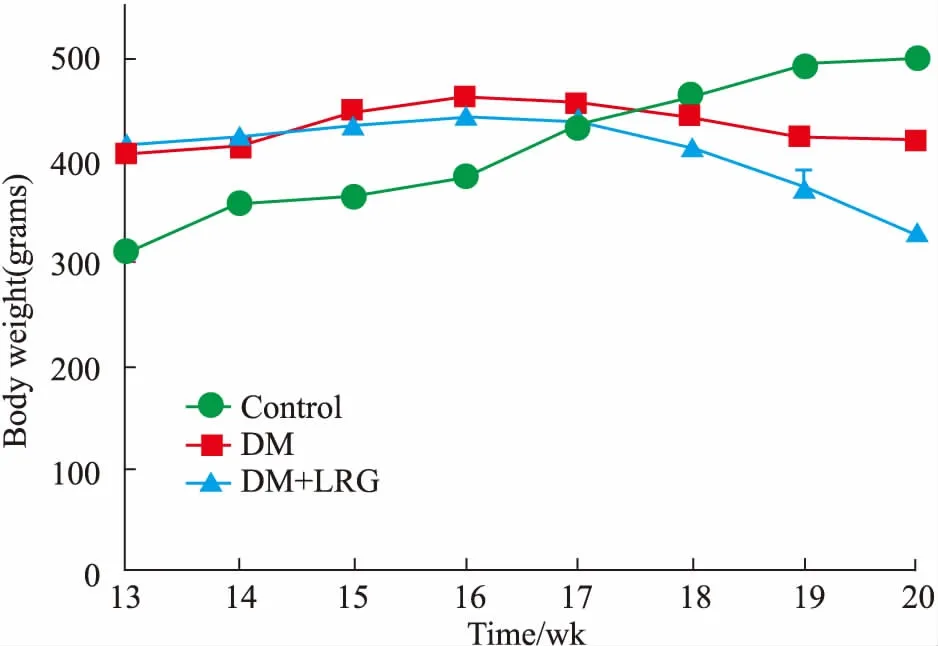
Fig 1 Effect of liraglutide on body mass of
CON: Control diet group; DM: Type 2 diabetic mellitus group; DM+LRG: DM and liraglutide treatment group (0.4 mg·kg-1·d-1)
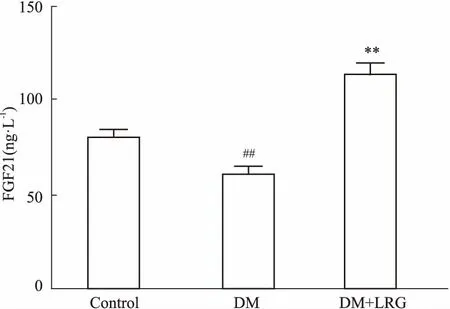
Fig 2 Effect of liraglutide on serum FGF21levels of obese DM n=8)

GroupTC/mmol·L-1TG/mmol·L-1HDL-C/mmol·L-1ALT/mmol·L-1AST/mmol·L-1CON1±0.360.39±0.141.08±0.2146.25±20.8592.75±26.91DM1.49±0.4#0.76±0.78#1.09±0.2593.33±36.12#101±23.98##DM+LRG1.501±0.03 0.56±0.231.38±0.12**70.95±15.88*70.95±12.73**
CON: control diet group;DM: type 2 diabetic mellitus group; DM+LRG: DM and liraglutide treatment (0.4 mg·kg-1·d-1) .#P<0.05,##P<0.01vsCON;*P<0.05,**P<0.01vsDM
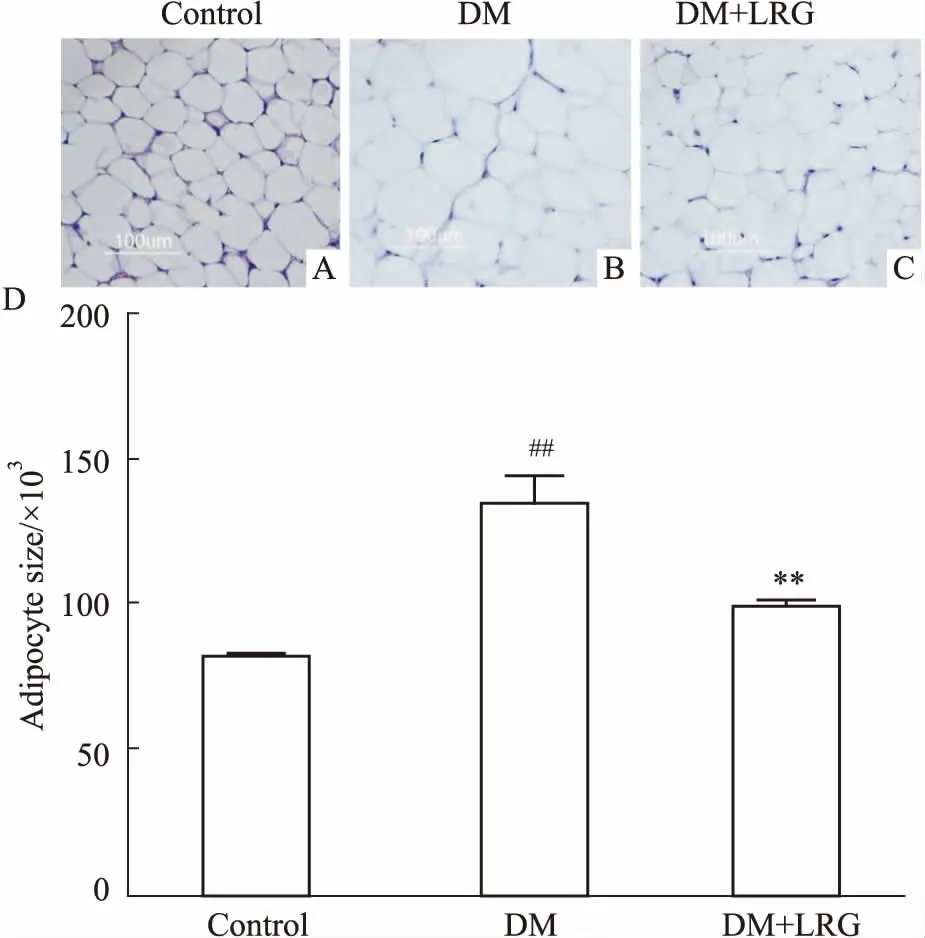
Fig 3 Representative photomicrographs of adipose tissuesstained with haematoxylin and n=8)
A: Control diet group; B: Type 2 diabetic mellitus group; C: DM and liraglutide treatment (0.4 mg·kg-1·d-1); D: Quantification of adipocyte size.##P<0.01vsControl;**P<0.01vsDM
2.5利拉鲁肽对DM大鼠白色脂肪组织蛋白表达的影响Fig 5免疫组化的结果显示,与CON组相比,DM组大鼠的WAT中PPARγ、p-AMPK、p-ACC的蛋白表达水平均明显降低,p-ERK蛋白表达水平明显升高,且主要分布在胞质中;DM+LRG组大鼠WAT中PPARγ、p-AMPK、p-ACC的蛋白表达均明显增加,p-ERK表达水平明显下降(P<0.05或P<0.01)。Western blot的结果显示,与CON组相比,DM组大鼠WAT中FGF21、β-klotho、p-FGFR3 蛋白表达均减少(P<0.05);与DM组相比,DM+LRG组白色脂肪组织中FGF21、β-klotho、p-FGFR3 蛋白表达均升高(P<0.05)(Fig 6A、6B)。在AMPK信号通路中上游p-LKB1、下游p-ACC均与p-AMPK的变化趋势一致,表明该信号通路在DM状态时下调,利拉鲁肽治疗后上调(Fig 6C、6D)。本研究还分析了MAPK 3条信号通路分子的磷酸化改变,结果发现它们均表现为先升后降的趋势,即在DM时ERK、JNK、p38磷酸化增加,利拉鲁肽治疗后磷酸化水平减少(Fig 6E、6F)。
3 讨论
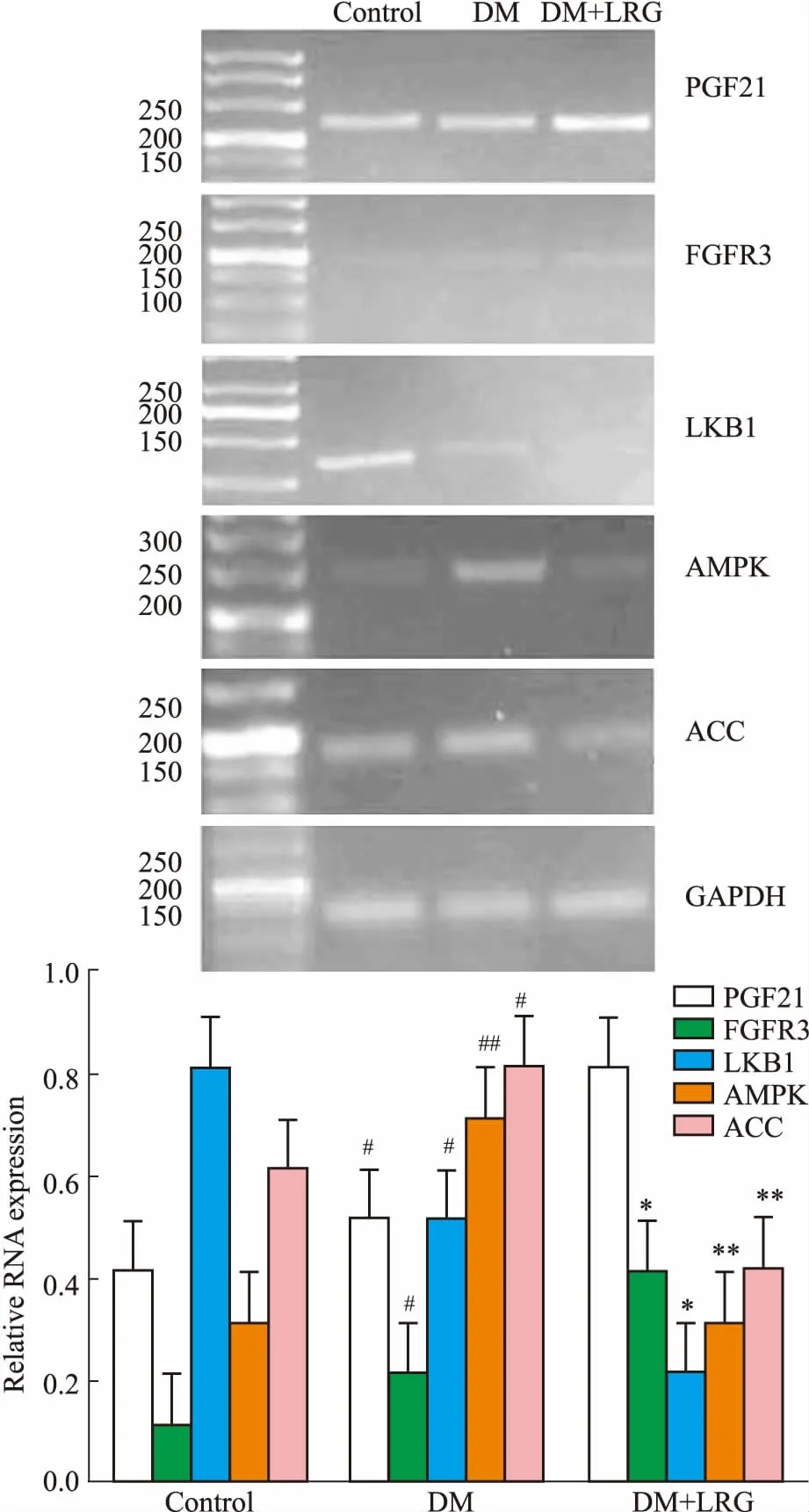
Fig 4 Effect of liraglutide on mRNA expressionin adipose tissue of obese DM n=8)
#P<0.05,##P<0.01vsCON;*P<0.05,**P<0.01vsDM
传统降糖药物的治疗过程中可能会出现体重增加、胰岛功能减退及慢性并发症等。LEAD(Liraglutide Effect and Action in Diabetes)研究表明,利拉鲁肽可有效降低血糖、血压、减轻体重,减少低血糖发生率。本研究结果表明,利拉鲁肽能明显降低T2DM大鼠的血脂水平和体重,其机制可能与诱导脂肪组织中FGF21 mRNA和蛋白水平的表达,进而激活AMPK和抑制MAPK通路有关,目前尚未见相关报道。
本实验显示,DM组大鼠的血脂和体重明显增加,HDL-C明显降低,DM+LRG组血脂和体质量明显下降,表明利拉鲁肽具有较好的改善高脂血症和降低体质量的作用。利拉鲁肽也能降低血清ALT、AST的水平,表明其还有一定的肝脏保护作用。
PPARγ可诱导WAT中FGF21的基因转录[7]。
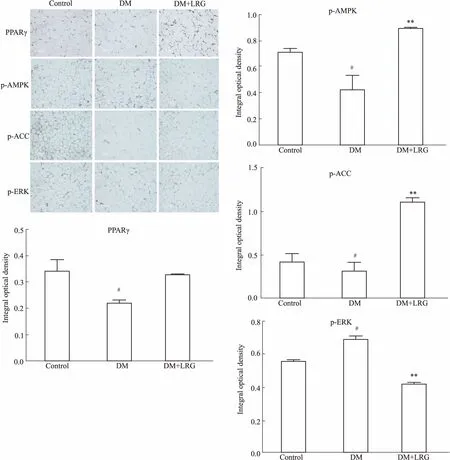
#P<0.05vsControl;*P<0.05,**P<0.01vsDM
本研究证实,DM+LRG组WAT中PPARγ的表达升高,对应的血清FGF21水平与WAT中FGF21表达升高,表明利拉鲁肽可能通过PPARγ诱导FGF21的表达,并成为血清FGF21的重要来源之一。
饮食诱导的肥胖小鼠静脉连续输注FGF21,能够明显降低体重和血糖的水平, 同时还会引起肝脂肪变性逆转和血甘油三酯含量降低[8]。β-Klotho在WAT中含量丰富[2],其选择性表达决定了FGF21生物学功能的组织特异性[9]。由于过度表达和活化的FGFR3主要与成脂分化有关[10],本研究中检测了FGFR3和p-FGFR3,DM+LRG组WAT的β-Klotho、p-FGFR3表达均增加,可介导AMPK信号通路的激活。
AMPK是一种重要的细胞能量调节器,其上游激酶主要有LKB1和CaMKK[11],其中LKB1广泛分布于人体多种组织中;下游靶分子ACC的磷酸化水平可作为机体内AMPK活化状态的标志物。本研究中DM+LRG组WAT中LKB1、AMPK、ACC磷酸化均增加,抑制脂肪酸及脂肪的合成,减少脂质沉积。RT-PCR和Western blot的结果不完全一致,推测可能与基因表达的转录后修饰有关。利拉鲁肽可增加大鼠血管内皮细胞中的AMPK磷酸化,减少JNK的磷酸化[12],与本研究结果一致。
MAPK途径主要由ERK1/2、JNK、p38三条信号通路组成,在调控细胞增殖、分化和基因表达中有重要的作用。既往研究表明,利拉鲁肽可通过上调ERK1/2的磷酸化、下调JNK和p38的磷酸化,减少缺血诱导的细胞凋亡,以发挥其神经保护作用[13]。利拉鲁肽还能通过活化GLP-1受体、抑制ERK1/2,减少高糖诱导的血管平滑肌细胞的迁移、增殖和凋亡[14]。李婷婷等[15]报道,重组人FGF21作用于药物诱导胰岛素抵抗的HL-7702细胞时,可促进ERK1/2的磷酸化。本研究结果显示,利拉鲁肽通过诱导WAT中FGF21的表达、抑制MAPK 3条信号通路分子的磷酸化和活化,抑制脂肪细胞的增殖,推测可能与细胞类型和给药方式的不同有关。
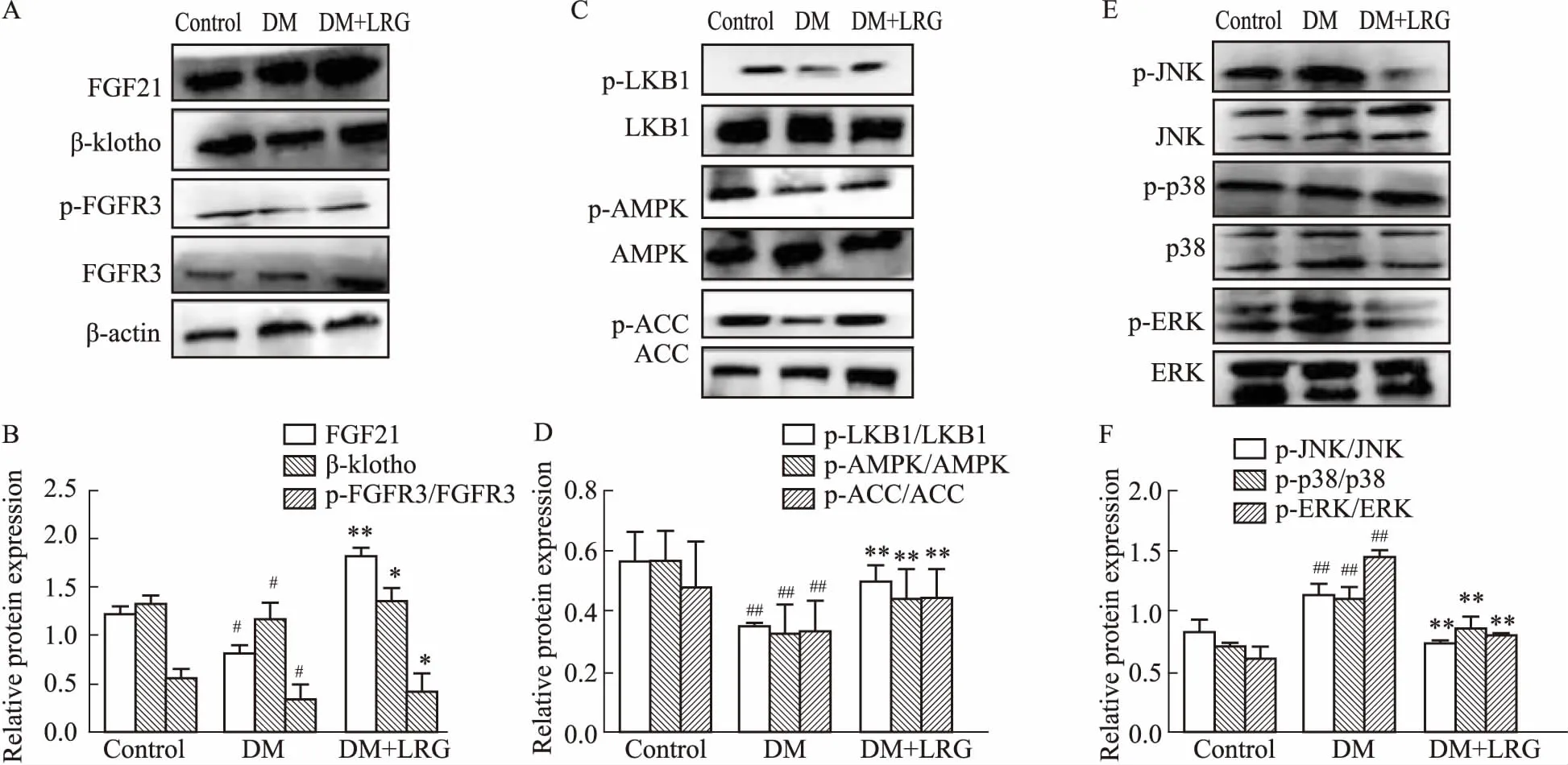
Fig 6 Effect of liraglutide on protein expression in adipose tissue of obese DM rats n=8)
A: Western blot of FGF21, β-klotho, p-FGFR3; B: Semi-quantitative analysis of protein expression of FGF21, β-klotho, p-FGFR3; C: Western blot of p-LKB1, p-AMPK, p-ACC; D: Semi-quantitative analysis of protein expression of p-LKB1, p-AMPK, p-ACC; E: Western blot of p-ERK, p-JNK, p-p38; F: Semi-quantitative analysis of protein expression of p-ERK, p-JNK, p-p38.#P<0.05,##P<0.01vsCON;*P<0.05,**P<0.01vsDM.
本研究从组织水平上阐明利拉鲁肽诱导白色脂肪组织中FGF21的表达可能与激活AMPK和抑制MAPK信号通路有关,为深入了解利拉鲁肽作为肥胖和T2DM的首选药物、改善糖脂代谢提供理论依据。
(致谢:本实验在安徽医科大学基础医学院药理学教研室、生物化学与分子生物学教研室和综合实验室完成,感谢实验室老师和同学们给予的帮助和指导!)
[1] Saltiel A R, Olefsky J M. Inflammatory mechanisms linking obesity and metabolic disease [J].JClinInvest, 2017,127(1):1-4.
[2] Kharitonenkov A, Shiyanova T L, Koester A, et al. FGF-21 as a novel metabolic regulator[J].JClinInvest, 2005,115(6): 1627-35.
[3] Chau M D, Gao J, Yang Q, et al. Fibroblast growth factor 21 regulates energy metabolism by activating the AMPK-SIRT1-PGC-1alpha pathway [J].ProcNatlAcadSciUSA, 2010,107(28): 12553-8.
[4] Yang M, Zhang L, Wang C, et al. Liraglutide increases FGF-21 activity and insulin sensitivity in high fat diet and adiponectin knockdown induced insulin resistance[J].PLoSOne, 2012,7(11): e48392.
[5] Nonogaki K, Hazama M, Satoh N. Liraglutide suppresses obesity and hyperglycemia associated with increases in hepatic fibroblast growth factor 21 production in KKAy mice[J].BiomedResInt, 2014,2014: 751930.
[6] Lynch L, Hogan A E, Duquette D, et al. iNKT cells induce FGF21 for thermogenesis and are required for maximal weight loss in GLP1 therapy [J].CellMetab, 2016,24(3):510-9.
[7] Muise E S, Azzolina B, Kuo D W, et al. Adipose fibroblast growth factor 21 is up-regulated by peroxisome proliferator-activated receptor gamma and altered metabolic states [J].MolPharmacol, 2008,74(2): 403-12.
[8] Xu J, Lloyd D J, Hale C, et al. Fibroblast growth factor 21 reverses hepatic steatosis, increases energy expenditure, and improves insulin sensitivity in diet-induced obese mice[J].Diabetes, 2009,58(1): 250-9.
[9] Adams A C, Coskun T, Rovira A R, et al. Fundamentals of FGF19 & FGF21 actioninvitroandinvivo[J].PLoSOne, 2012,7(5): e38438.
[10] Park J R, Lee H, Kim C H, et al. Functional characteristics of mesenchymal stem cells derived from the adipose tissue of a patient with achondroplasia[J].InVitroCellDevBiolAnim, 2016,52(5):545-54.
[11] Hardie D G. AMP-activated/SNF1 protein kinases: conserved guardians of cellular energy [J].NatRevMolCellBiol, 2007,8(10):774-85.
[12] Li N, Zhao Y, Yue Y, et al. Liraglutide ameliorates palmitate-induced endothelial dysfunction through activating AMPK and reversing leptin resistance [J].BiochemBiophysResCommun, 2016,478(1):46-52.
[13] Zhu H, Zhang Y, Shi Z, et al. The neuroprotection of liraglutide against ischaemia-induced apoptosis through the activation of the PI3K/AKT and MAPK pathways [J].SciRep, 2016,6:26859.
[14] Shi L, Ji Y, Jiang X, et al. Liraglutide attenuates high glucose-induced abnormal cell migration, proliferation, and apoptosis of vascular smooth muscle cells by activating the GLP-1 receptor, and inhibiting ERK1/2 and PI3K/Akt signaling pathways[J].CardiovascDiabetol, 2015,14:18.
[15] 李婷婷,高丽昌,唐 禄,等. 成纤维细胞生长因子-21改善胰岛素抵抗肝细胞对葡萄糖的吸收及机制[J]. 中国药理学通报,2012,28(3): 366-71.
[15] Li T T, Gao L C, Tang L, et al. The effect of FGF-21 on the glucose uptakes and insulin resistance in cultured human liver cells[J].ChinPharmacolBull, 2012,28(3): 366-71.