干扰对森林凋落物分解影响的研究现状及展望
肖文娅,关庆伟
南京林业大学生物与环境学院,南方现代林业协同创新中心,江苏 南京 210037
凋落物每年大约贡献 70%的森林总碳通量(Raich et al.,1992),是森林生态系统物质循环和能量流动的核心环节,在维持全球碳平衡和调节全球气候,减缓温室效应上也扮演着非常重要的角色。凋落物分解速率主要受凋落物性质、物理环境及分解者特性三方面控制(Coûteaux et al.,1995)。干扰是改变生态过程的重要因子,可对森林的结构与功能造成直接影响(Tian et al.,2010)。干扰会改变林分结构和生物环境,引起分解者的多样化及群落结构的变化,导致凋落物分解速率发生变化,进而影响森林生态系统养分循环(Saura-Mas et al.,2012;Hou et al.,2005)。本文通过整理现有干扰对森林凋落物分解影响的相关研究成果,综述干扰对凋落物分解的影响机制,并分析目前研究的不足,以期为未来干扰对森林凋落物分解机制的研究提供一定的理论依据与方向。
1 干扰对森林凋落物量与质的影响
凋落物的质与量是决定其分解速率和养分释放的重要指标(McClaugherty et al.,1987)。其中,凋落物量的测定包括森林年凋落物产量和凋落物现存量;凋落物质指凋落物的化学特性,以C含量、N含量、C/N、C/P等指标进行测度。间伐等对森林乔木层影响较大的干扰会降低森林郁闭度及密度,增加林内透射光照,从而减小乔木竞争,增加林下植被组成多样性,导致凋落物量与质的改变,从而对林下凋落物的分解过程产生影响(Tian et al.,2010)(图 1)。
1.1 干扰对凋落物量的影响
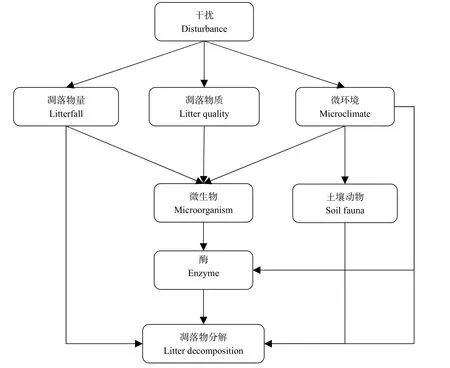
图1 干扰对凋落物分解研究机制简述Fig. 1 A Brief Introduction to the Mechanism of Disturbance on Litter Decomposition
目前,有关干扰对森林凋落物量的影响研究主要集中于间伐干扰,研究结果均表明间伐后短期内森林年生产量会显著降低(Inagaki et al.,2008;Roig et al.,2005;Kunhamu et al.,2009)。短期间伐干扰使森林凋落物产量减少的机理一方面来自于林分密度的降低,另一方面来自间伐后林冠密度的改变影响下层分解微环境改善,加速了现存凋落物的分解(马川等,2012;Navarro et al.,2013),导致森林凋落物总量降低。间伐后保留木的资源与养分竞争压力减小,能更长时间地保持自身资源的利用,而未间伐林分内乔木由于养分等资源竞争,对外界环境变化的抵抗能力变弱,更易造成林木凋落物的产生与积累(Jimenez et al.,2016)。同时,间伐后林分结构的改变导致林下植被多样性提高,丰富凋落物种类组成,使得微生物可利用养分和资源显著提升,分解过程更加迅速有效(Prescott et al.,2013)。尽管凋落物产量及现存量在间伐干扰后会有一定程度的降低,但由于森林凋落物分解作用的加强,森林土壤肥力以及土壤养分的回归仍有一定程度的上升(Blanco et al.,2010;Slodicak et al.,2005)。Roig et al.(2005)对不同强度间伐10年的林下凋落物量研究表明,凋落物年产量随间伐强度的增加而减小,但这种影响在间伐5年之后逐渐消失,其原因可能是由于森林冠层密度的恢复。
但以上不同地区开展的干扰对凋落物量的研究主体多为针叶森林,这往往不能代表所有树种对间伐的响应。森林上层植被的生态习性及树种遗传特性等均会对干扰产生不同程度与时长的响应。同时这种响应还会受到森林多样性,林内气候资源等的高度异质性的显著影响,此类研究仍有待进一步的完善。
1.2 干扰对凋落物质的影响
凋落物化学特性的变化,是决定分解速率的关键因子,以凋落物 C、N、P含量等为主要指标(McClaugherty et al.,1987)。其分解过程是陆地生态系统物质及养分循环的重要环节,是生态系统物质与养分回归土壤的主要形式之一。
木质素和纤维素是凋落物在分解过程中最难降解的自然生产有机物,且是凋落物中C的主要存在形式(McClaugherty et al.,1987)。Sariyildiz et al.(2003)对不同凋落物进行室内控制分解试验,发现木质素的初始浓度是预测不同凋落物种类质量损失的最佳因子,这种响应在物种间差异显著,但施肥提升土壤养分能显著提升凋落物分解速率。森林常受飓风干扰,其内乔木多为强风适应种,树叶宿存的时间更长或叶片更为坚硬,而凋落物中的木质素和纤维素含量更高,分解艰难而缓慢(Wang et al.,2016;李晗等,2015),阻滞森林生态系统的物质循环(Liao et al.,2006)。然而 ,目前为止,有关干扰是否会改变森林凋落物木质素和纤维素特性的研究还相对较少。干扰对树种的木质素等含量并不产生直接影响,而是通过影响森林植被群落(Navarro et al.,2013),导致林下凋落物木质素与纤维素含量发生变异(李晗等,2015),从而显著影响凋落物分解(Li et al.,2004)。
凋落物的分解与凋落物的养分含量关系密切。N含量决定了微生物生物量和活性以及微生物的碳矿化及周转,凋落物分解速率与其初始N含量线性正相关(Li et al.,2009;Huang et al.,2007)。间伐能提升森林凋落物中N含量,而导致凋落物迅速分解(Inagaki et al.,2008;葛晓敏等,2017)。但也有部分研究表明,间伐后森林凋落物中N含量更低,其主要原因在于间伐能减缓保留木的养分竞争,保留木体内营养的损失降低表现为凋落物中N浓度的减少,致使植物叶片寿命延长(Kunhamu et al.,2009;Slodicak et al.,2005;Huang et al.,2007)。Smolander et al.(2008)通过对森林采伐后10年的监测发现,伐木移除方式(全株移除、保留伐木残桩)对凋落物C/N影响显著,主要是由于保留伐木残桩能显著提高森林凋落物中N含量。而施肥对凋落物化学特性并不会造成显著改变(Thirukkumaran et al.,2002)。
有关干扰对凋落物P含量的影响鲜有研究,可能是由于P是较为稳定的化学元素,在新鲜叶片和衰老叶片中并不轻易转移,主要受植被特性的影响。Kunhamu et al.(2009)研究表明间伐会减少凋落物中的总P含量,主要也是由于间伐导致凋落物年产量减少所致。
干扰后植被群落发生变化,林下凋落物特性也随之变化,但干扰对凋落物中木质素及P含量影响并不显著,多是通过改变植被种类和凋落物产量所致C、P总量的变化。但N是植物体中易转移的化学元素,也是影响森林凋落物分解速率最主要的养分因子,主要能为凋落物中的微生物分解者提供养分。但目前对干扰后森林凋落物中化学特性对微生物分解者影响方面的研究还相对较少,干扰是如何通过改变微生物的群落结构和功能来影响森林凋落物的分解速率还有待进一步证实。
2 干扰对森林凋落物分解的微环境影响
气候等环境因子变化仅次要作用于凋落物分解过程,气候直接或间接影响了林内温度、土壤性质、土壤水分以及相关凋落物的组成和质量,这些因素直接影响分解者的种类与数量的变化,从而改变凋落物分解速率(Duboc et al.,2012;Pang et al.,2016)。在大尺度研究区域上,凋落物分解与降水、温度更为相关;但在某一局地上,凋落物底物质量、微生物的作用更为主要(Song et al.,2012)。
间伐等干扰会导致林密度降低,林内透射光增强,森林蒸发量上升,易导致凋落物中木质素以及碳水化合物的含量发生较大变化,这是由于温度升高引起与之分解相关的微生物活动的增强(Hilli et al.,2010;He et al.,2010)。Tian et al.(2010)对20年生马尾松林干扰的研究结果表明,间伐减少凋落物生产量,削弱林地表层的保护作用,导致林下土壤的温湿度降低,凋落物分解减慢,森林土壤碳积累显著增加(Marimon-Junior et al.,2008)。郭彩虹等(2018)也发现,通过在森林开设林窗,森林地表温度升高,林内环境干燥,导致凋落物水分含量降低,致使凋落物分解缓慢。这些结果的矛盾可能来自于森林干扰后对温湿度影响的交互作用对凋落物分解产生了多变的影响。
诸多模拟降水干扰的研究表明,凋落物分解速率随水量的增加呈线性增加(Austin et al.,2000;Austin,2002)。干旱条件下,水分亏缺会造成养分从凋落物中返还至土壤的过程更为缓慢(Saura-Mas et al.,2012)。间伐等易改变森林微环境的干扰在升高林地温度的同时也降低了地表的水分含量,而森林系统在凋落物分解水分有限的条件下,将减缓凋落物分解作为一种缓冲行为(Smyth et al.,2011)。而干扰使得林地表面更易暴露于太阳辐射下,导致土壤湿度降低,从而减缓凋落物分解(Riutta et al.,2012)。
适宜的温度与湿度更利于微生物分解者的活动繁殖,高温与干旱条件均会对凋落物分解产生阻滞。因此,适宜强度的间伐等人为干扰方式,能有效的提高森林凋落物分解速率,促进系统的物质与能量循环。但干扰研究鲜少涉及梯度,何为最适宜的分解环境,能最大化提高凋落物的分解速率,还待具体研究。
3 干扰对森林凋落物分解者的影响
森林凋落物的质量损失归因于降雨淋洗及土壤分解者的协同作用。凋落物的分解与分解者的种群和数量关系密切,分解者的种类及生物量变化受凋落物质量、树种组成、土壤水热状况等多种因素的影响(Bauhus et al.,1998;Fanin et al.,2011),与凋落物和土壤中的养分状况、特性(Saetre et al.,2000;Duboc et al.,2012)以及元素周转速率密切相关(Wang et al.,2006)。植被密度和多样性与凋落物的分解者以及快速分解直接相关,不同凋落物种类之间的营养交换,能够促进土壤动物和微生物群落的活动(Lecerf et al.,2010)。尤其是真菌的衍生菌丝对凋落物分解中营养物质的主动运输有积极影响(Song et al.,2010)。
3.1 干扰对土壤动物的影响
凋落物在大孔径网袋中比小孔径分解更快,证明土壤动物会促进凋落物分解(Wang et al.,2009;Smith et al.,2009)。诸多干扰对土壤动物的研究均表明,干扰对土壤动物群落与结构会产生一定的负效应(和润莲等,2015)。热带地区森林暴雨造成的山体滑坡使得土壤动物丰度和结构发生改变,导致凋落物分解过程受到影响,但这种短期效应会在长时间的森林恢复后消失(Hou et al.,2005)。森林采伐的残桩清除会造成凋落物的分解速率降低,其主要原因也在于伐木留桩的清除抑制了土壤动物活动,千足虫密度及微生物量降低(Ruan et al.,2005)。而在采伐和表层松土扰动的耕地系统内,表层土壤动物群落活动减弱也会导致土壤深层凋落物分解比土壤表层迅速,进而影响生态系统内植物群落可利用养分的有效性(Smith et al.,2009)。排除放牧干扰的草地生态系统内有更大的甲虫和蚂蚁种群数量,对无脊椎动物群落组成及丰富度有促进作用,对凋落物分解过程有益,本地种丰度更优,植被生长和分布状况更好(张亮等,2017;Lindsay et al.,2009)。
诸多干扰对土壤动物影响的研究均集中于对土壤动物丰度数量的研究。干扰后会否通过对其生境及养分来源的影响,导致土壤动物原生物种的消失或外生物种的入侵,从而加速或抑制凋落物的分解与养分循环,其相关机理研究还有待加强。
3.2 干扰对土壤微生物的影响
近年来,有关凋落物中的微生物分解群落研究进展迅速。凋落物分解过程与微生物动态联系紧密,凋落物质量的损失量与微生物多样性种类显著正相关(Zhang et al.,2008)。细菌、放线菌、真菌群落均参与凋落物分解过程,它们之间存在复杂的协同作用(Zhang et al.,2008),是影响凋落物分解过程的最关键因子(Trinder et al.,2009)。凋落物分解过程中微生物组成与环境因子间的相互作用会影响微生物的呼吸速率(Matulich et al.,2014;Smyth et al.,2015)。
干扰后植被组成不同,凋落物的质和量就不同(Chapman et al.,2010;Wang et al.,2010),适于微生物生长的营养源也不同,因而微生物的种类和数量也不同(Mukhopadhyay et al.,2010)(图 1)。火烧、间伐等干扰对微生物生长活动所需的养分和能量的主要来源影响显著,从而能有效提升凋落物分解,其主要原因在于间伐有利于太阳光渗透至土壤,促进不耐荫植物的恢复和生长,提升了植被丰度,增加了土壤养分的回归,为微生物提供能多的生存与活动资源(刘敏等,2016;刘发林,2017;Cheng et al.,2015;Rietl et al.,2012)。火烧与间伐等干扰会造成林分的短期或长期恢复,而造成森林植被的显著改变,而微生物主要以植物残体为营养源,植物群落类型与质和量的差异必然会导致微生物在各植物群落中分布的不均性(Bray et al.,2012;Chapman et al.,2010;Krashevska et al.,2012)。
干扰对凋落物量与质的影响会直接导致土壤特性的差异,与微生物间接相关(Zhang et al.,2013),其中,间伐等干扰后凋落物产量及N含量的改变与微生物活动显著相关,凋落物中C形态、P含量与微生物呼吸显著相关,两者共同限制了微生物的能源(Fanin et al.,2011)。而增加凋落物会造成土壤养分增加,能刺激土壤微生物活动,促使真菌大量生长,提高微生物对凋落物中 C的利用(Wang et al.,2014)。同时,干扰后生态系统内的微环境改变,水热条件的相互作用也决定了微生物呼吸的季节性动态变化(Chemidlin et al.,2011)。
微生物直接决定了凋落物的分解,但微生物分解者数量及种类受水热养分等条件限制,在此方面亟需进一步的诠释。
3.3 干扰对凋落物中酶活性的影响
微生物群落最终是通过代谢酶来完成凋落物的分解,土壤中酶的活性可以作为微生物矿化过程的敏感指标(Allison et al.,2004)。凋落物分解速率与累积酶活性关系密切(Rietl et al.,2012),而凋落物的化学性质与林分的特点主要决定了土壤酶的活性(Adamczyk et al.,2014;Kourtev et al.,2002)。
干扰引起的土壤温湿度的改变对土壤呼吸起关键作用,也会影响土壤生物群落的类型和土壤酶活性(Ushio et al.,2010;Pang et al.,2013;Chen et al.,2016),对凋落物分解起到关键性的控制作用。火烧过后土壤有机质增加,会造成土壤磷酸酶活性降低(韩春兰等,2015;Rietl et al.,2012)。森林间伐、火烧等干扰直接影响了林内小气候,地面植被,林冠遮荫程度和降雨截留效力,导致土壤的酸碱性改变,致使土壤及凋落物层有关酶活性的显著变异(陆梅等,2010;Lv et al.,2014;Smolander et al.,2008)。穿透雨量增加导致的土壤过酸,会抑制纤维素酶、转化酶、硝酸还原酶,磷酸酶等的活动(Wang et al.,2010),从而抑制凋落物的分解,造成系统碳循环的延滞。尽管间伐后土壤酶的活性有所降低(Geng et al.,2012),但采伐剩余物(如枝、叶等)的保留可以增加土壤C、N矿化及酶活性,剩余物越多,土壤酶活性越大(Adamczyk et al.,2015)。
作为最终分解者的微生物酶,是提供植物养分的关键,直接决定林分生产力和土壤变化过程。而酶活性受林内微环境与土壤条件影响显著,干扰导致的森林内部环境的变化与分解酶的活性关系研究也应该受到重视。
4 展望
目前,有关干扰对凋落物分解的影响研究较为分散,并不能取得干扰对凋落物分解的统一结论,原因之一是干扰方式不固定,二是干扰程度不一致。不同方式——人为或自然——的干扰对凋落物分解的影响均会产生显著的差异,不能一概而论。人为干扰方式,如人工间伐、合理施肥等森林经营模式则因干扰程度不同,不能简单表述为线性相关。就中国森林现状而言,适度间伐干扰对提高森林生产力,促进养分循环,维持可持续发展等有至关重要的作用,而现有的研究结果对此结论还缺乏系统的理解和探讨。
4.1 如何进行合理的森林经营以促进凋落物分解及养分归尚待进一步研究
森林凋落物分解过程的机制研究将对全球森林生态系统养分循环的研究起到积极的推动作用。目前对影响凋落物分解的非生物因素研究相对较为全面,如何通过合理的干扰方式促进森林凋落物的分解与其养分归还仍待进一步研究,且干扰后森林生态系统并非单一因子的改变,而是多因素共同作用变化的结果(Coûteaux et al.,1995),干扰对凋落物分解产生的影响尚缺乏系统和完善的研究理论。
4.2 研究不同林分优势树种的凋落物分解特点,深入理解植被演替进程同凋落物分解的关系
干扰能改变森林生态系统演替进程,使凋落物的功能特性随森林结构的变化而变化,不同森林类型的优势树种对群落的组成和发育起着支配性的作用(Prescott et al.,2013)。通过研究不同森林生态系统优势树种的凋落物分解特点,可以深入理解植被演替进程与凋落物分解的关系。不同类型森林的分解者组成、数量和活性的差异对凋落物分解速率的影响是不可忽视的一个重要方面(Zhang et al.,2008)。林下凋落物层真菌群落的变化必然影响凋落物分解,在凋落物分解过程中起到重要作用(Trinder et al.,2009)。然而,作为最重要的分解者,有关凋落物中微生物种类的鉴别及种群大小的研究相对较少。微生物的功能特性对凋落物分解起着至关重要的作用,目前对更精确的微生物种类鉴别等研究相对不足。且干扰后微生物群落与凋落物组成和性质之间如何相互作用进而促进凋落物分解尚缺乏系统研究。
4.3 生物多样性与凋落物分解之间关系的研究应受到重视
森林植被多样性、微生物多样性与凋落物分解速率之间的相互关系研究应受到重视,从微生物生态学层面能更深入地探讨地带性森林对环境变化的响应与适应机制(Prescott et al.,2013)。现代分子方法能够将影响凋落物分解的直接因子与间接因子相结合,形成一个完善的研究体系,对凋落物的分解过程会有更全面、透彻的认识和理解。目前,干扰对土壤动物分解影响的研究也相对较少,凋落物分解初期的粉碎作用主要通过土壤动物完成,土壤动物的改变对凋落物分解也有一定影响。国内外直接测定凋落物层酶系统的研究不是很多,凋落物层酶系统的研究方式相对于土壤也略为复杂,但对凋落物层的影响会更为直接。
4.4 森林植被、凋落物及土壤三者关系的相互作用研究应进一步加强
全球气候变化背景下,森林经营对森林生态系统的结构与功能影响十分显著。不同森林植被造成土壤特性的变化也主要来源于凋落物分解的差异(Kourtev et al.,2002)。土壤酶对凋落物的最终分解是提高森林土壤养分可利用率的关键(Adamczyk et al.,2014)。解释土壤管理对林分系统养分的影响也只是造成系统整体变化研究的一部分。干扰对林分生产力的提高归因于土壤酶对凋落物的加速分解和微生物矿化作用的提升(Adamczyk et al.,2015)。因此,森林植被、凋落物及土壤三者的相互影响过程亟待进一步研究,其中的相互制约和促进作用有待进一步挖掘。通过设立干扰强度梯度建立一个森林地上部分对地下部分的调控及反馈系统,深入研究森林经营对土壤性质的影响及土壤养分可利用性对林木增长的影响。充分理解并解释森林生态系统物质及养分循环的过程所受制约及影响,以及如何通过适当干扰发挥凋落物最大效用,释放更多养分至土壤以供林木吸收提高林分生产力。
5 结论
本文通过对前人研究成果的总结,得出以下几点主要结论:间伐等降低林分密度的干扰方式会显著减少森林凋落物产量,有效改变凋落物化学特性,并通过增加林内贯穿雨量显著提升森林地面湿度,从而对凋落物分解产生促进作用;干扰对土壤动物群落及数量的短期负影响较为显著,但对微生物的种类和数量的显著增加能够有效促进凋落物分解,其主要原因在于干扰改善了分解微环境与凋落物底物质量;干扰会通过土壤条件等的改变对与分解相关微生物酶的活性造成影响,进而改变凋落物分解速率,分解相关酶的活性越高,凋落物分解越为迅速。
现有研究仍有不足,干扰对林分结构、分解环境等影响因素的改变与凋落物分解之间的关系错综复杂,其中的机制与机理仍有待明晰;不同方式及程度干扰对森林恢复过程中凋落物的分解模式需长期监测;还应着重建立干扰梯度,并结合研究森林地上部分与地下部分的调控及反馈。本文可为深入理解干扰对凋落物分解的影响及合理揭示干扰对森林生态系统稳定性机理和应对全球气候变化的能力提高提供一定的科学思路。
ADAMCZYK B, ADAMCZYK S, KUKKOLA M, et al. 2015. Logging residue harvest may decrease enzymatic activity of boreal forest soils[J]. Soil Biology and Biochemistry, 82: 74-80.
ADAMCZYK B, KILPELÄINEN P, KITUNEN V, et al. 2014. Potential activities of enzymes involved in N, C, P and S cycling in boreal forest soil under different tree species [J]. Pedobiologia, 57(2): 97-102.
ALLISON SD, VITOUSEK P M. 2004. Extracellular enzyme activities and carbon chemistry as drivers of tropical plant litter decomposition [J].Biotropica, 36(3): 285-296.
AUSTIN A T, VITOUSEK P M. 2000. Precipitation, decomposition and litter decomposability of Metrosideros polymorpha in native forests on Hawaii [J]. Journal of Ecology, 88(1): 129-138.
AUSTIN M P. 2002. Spatial prediction of species distribution: an interface between ecological theory and statistical modelling [J]. Ecological Modelling, 157(2-3): 101-118.
BAUHUS J, PARE D, COTE L. 1998. Effects of tree species, stand age and soil type on soil microbial biomass and its activity in a southern boreal forest [J]. Soil Biology and Biochemistry, 30(8-9): 1077-1089.
BLANCO J A, IMBERT B J, CASTILLO F J. 2010. Thinning affects Pinus sylvestris needle decomposition rates and chemistry differently depending on site conditions [J]. Biogeochemistry, 106(3): 397-414.
BRAY S R, KITAJIMA K, MACK M C. 2012. Temporal dynamics of microbial communities on decomposing leaf litter of 10 plant species in relation to decomposition rate [J]. Soil Biology and Biochemistry,49: 30-37.
CHAPMAN S K, NEWMAN G S. 2010. Biodiversity at the plant-soil interface: microbial abundance and community structure respond to litter mixing [J]. Oecologia, 162(3): 763-769.
CHEMIDLIN PREVOST-BOUREN, MARON P, RANJARD L, et al. 2011.Seasonal dynamics of the bacterial community in forest soils under different quantities of leaf litter [J]. Applied Soil Ecology, 47(1): 14-23.CHEN X L, CHEN Y H H, CHEN X, et al. 2016. Soil labile organic carbon and carbon-cycle enzyme activities under different thinning intensities in Chinese fir plantations [J]. Applied Soil Ecology, 107: 162-169.
CHENG X Q, KANG F F, HAN H R, et al. 2015. Effect of thinning on partitioned soil respiration in a young Pinus tabulaeformis plantation during growing season [J]. Agricultural and Forest Meteorology,214-215: 473-482.
COÛTEAUX, M M., BOTTNER P, BERG B. 1995. Litter decomposition climate and litter quality [J]. Trends in Ecology & Evolution 10(2): 63-66.DUBOC O, ZEHETNER F, DJUKIC I, et al. 2012. Decomposition of European beech and Black pine foliar litter along an Alpine elevation gradient: Mass loss and molecular characteristics [J]. Geoderma,189-190: 522-531.
FANIN N, HÄTTENSCHWILER S, BARANTAL S, et al. 2011. Does variability in litter quality determine soil microbial respiration in an Amazonian rainforest? [J]. Soil Biology and Biochemistry, 43(5):1014-1022.
GENG Y, DIGHTON J, GRAY D. 2012. The effects of thinning and soil disturbance on enzyme activities under pitch pine soil in New Jersey Pinelands [J]. Applied Soil Ecology, 62: 1-7.
HE X B, LIN Y H, HAN G M, et al. 2010. The effect of temperature on decomposition of leaf litter from two tropical forests by a microcosm experiment [J]. European Journal of Soil Biology, 46(3-4): 200-207.
HILLI S, STARK S, DEROME J. 2010. Litter decomposition rates in relation to litter stocks in boreal coniferous forests along climatic and soil fertility gradients [J]. Applied Soil Ecology, 46(2): 200-208.
HOU P L, ZOU X, HUANG C, et al. 2005. Plant litter decomposition influenced by soil animals and disturbance in a subtropical rainforest of Taiwan [J]. Pedobiologia, 49(6): 539-547.
HUANG J, WANG X, YAN E. 2007. Leaf nutrient concentration, nutrient resorption and litter decomposition in an evergreen broad-leaved forest in eastern China [J]. Forest Ecology and Management, 239(1-3):150-158.
INAGAKI Y, KURAMOTO S, TORII A, et al. 2008. Effects of thinning on leaf-fall and leaf-litter nitrogen concentration in hinoki cypress(Chamaecyparis obtusa Endlicher) plantation stands in Japan [J]. Forest Ecology and Management, 255(5-6): 1859-1867.
JIMENEZ M N, NAVARRO F B. 2016. Thinning effects on litterfall remaining after 8 years and improved stand resilience in Aleppo pine afforestation (SE Spain) [J]. Journal of Environment Management, 169:174-183.
KOURTEV P S, EHRENFELD J G, HUANG W Z. 2002. Enzyme activities during litter decomposition of two exotic and two native plant species in hardwood forests of New Jersey [J]. Soil Biology and Biochemistry,34(9): 1207-1218.
KRASHEVSKA V, MARAUN M, SCHEU S. 2012. How does litter quality affect the community of soil protists (testate amoebae) of tropical montane rainforests? [J]. FEMS Microbiol Ecology, 80(3): 603-607.
KUNHAMU T K, KUMAR B M, VISWANATH S. 2009. Does thinning affect litterfall, litter decomposition, and associated nutrient release inAcacia mangiumstands of Kerala in peninsular India? [J]. Canadian Journal of Forest Research, 39(4): 792-801.
LECERF A, RICHARDSON J S. 2010. Litter decomposition can detect effects of high and moderate levels of forest disturbance on stream condition [J]. Forest Ecology and Management, 259(12): 2433-2443.
LI Q, LEE A H, WOLLUM A G. 2004. Microbial biomass and bacterial functional diversity in forest soils: effects of organic matter removal,compaction, and vegetation control [J]. Soil Biology and Biochemistry,36(4): 571-579.
LI Q, MOORHEAD D L, DEFOREST J L, et al. 2009. Mixed litter decomposition in a managed Missouri Ozark forest ecosystem [J].Forest Ecology and Management, 257(2): 688-694.
LIAO J, WANG H, TSAI C, et al. 2006. Litter production, decomposition and nutrient return of uplifted coral reef tropical forest [J]. Forest Ecology and Management, 235(1-3): 174-185.
LINDSAY E A, CUNNINGHAM S A. 2009. Livestock grazing exclusion and microhabitat variation affect invertebrates and litter decomposition rates in woodland remnants [J]. Forest Ecology and Management,258(2): 178-187.
LV Y N, WANG C Y, JIA Y Y, et al. 2014. Effects of sulfuric, nitric, and mixed acid rain on litter decomposition, soil microbial biomass, and enzyme activities in subtropical forests of China [J]. Applied Soil Ecology, 79: 1-9.
MARIMON-JUNIOR B H, HAY J D. 2008. A new instrument for measurement and collection of quantitative samples of the litter layer in forests [J]. Forest Ecology and Management, 255(7): 2244-2250.
MATULICH K L, MARTINY J B H. 2014. Microbial composition alters the response of litter decomposition to environmental change [J]. Ecology,96(1): 154-163.
MCCLAUGHERTY C, BERG B. 1987. Cellulose, lignin and nitrogen concentrations as rate regulating factors in late stages of forest litter decomposition [J]. Pedobiologia, 30(2): 101-112.
MUKHOPADHYAY S, JOY V C. 2010. Influence of leaf litter types on microbial functions and nutrient status of soil: Ecological suitability of forest trees for afforestation in tropical laterite wastelands [J]. Soil Biology and Biochemistry, 42(12): 2306-2315.
NAVARRO F B, ROMERO-FREIRE A, CASTILLO T D, et al. 2013.Effects of thinning on litterfall were found after years in a Pinus halepensis afforestation area at tree and stand levels [J]. Forest Ecology and Management, 289: 354-362.
PANG X Y, BAO W K, ZHU B, et al. 2013. Responses of soil respiration and its temperature sensitivity to thinning in a pine plantation [J].Agricultural and Forest Meteorology, 171-172: 57-64.
PANG X Y, HU B, BAO W K, et al. 2016. Effect of thinning-induced gap size on soil CO2efflux in a reforested spruce forest in the eastern Tibetan Plateau [J]. Agricultural and Forest Meteorology, 220: 1-9.
PRESCOTT C E, GRAYSTON S J. 2013. Tree species influence on microbial communities in litter and soil: Current knowledge and research needs [J]. Forest Ecology and Management, 309: 19-27.
RAICH J W, SCHLESINGER W H. 1992. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate [J]. Tellus B, 44(2): 81-99.
RIETL A J, JACKSON C R. 2012. Effects of the ecological restoration practices of prescribed burning and mechanical thinning on soil microbial enzyme activities and leaf litter decomposition [J]. Soil Biology and Biochemistry, 50: 47-57.
RIUTTA T, SLADE E M, BEBBER D P, et al. 2012. Experimental evidence for the interacting effects of forest edge, moisture and soil macrofauna on leaf litter decomposition [J]. Soil Biology and Biochemistry, 49:124-131.
ROIG S, RÍO M DEL, CAÑELLAS I, et al. 2005. Litter fall in Mediterranean Pinus pinaster Ait. stands under different thinning regimes [J]. Forest Ecology and Management, 206(1-3): 179-190.
RUAN H H, LI Y Q, ZOU X M. 2005. Soil communities and plant litter decomposition as influenced by forest debris: Variation across tropical riparian and upland sites [J]. Pedobiologia, 49(6): 529-538.
SAETRE P, BÅÅTH E. 2000. Spatial variation and patterns of soil microbial community structure in a mixed spruce-birch stand [J]. Soil Biology and Biochemistry, 32(7): 909-917.
SARIYILDIZ T, ANDERSON J M. 2003. Interactions between litter quality,decomposition and soil fertility: a laboratory study [J]. Soil Biology and Biochemistry, 35(3): 391-399.
SAURA-MAS S, ESTIARTE M, PEÑUELAS J, et al. 2012. Effects of climate change on leaf litter decomposition across post-fire plant regenerative groups [J]. Environmental and Experimental Botany, 77:274-282.
SLODICAK M, NOVAK J, SKOVSGAARD J P. 2005. Wood production,litter fall and humus accumulation in a Czech thinning experiment in Norway spruce (Picea abies (L.) Karst.) [J]. Forest Ecology and Management, 209(1-2): 157-166.
SMITH J, POTTS S G, WOODCOCK B A, et al. 2009. The impact of two arable field margin management schemes on litter decomposition [J].Applied Soil Ecology, 41(1): 90-97.
SMOLANDER A, LEVULA TAND KITUNEN V. 2008. Response of litter decomposition and soil C and N transformations in a Norway spruce thinning stand to removal of logging residue [J]. Forest Ecology and Management, 256(5): 1080-1086.
SMYTH C E, KURZ W A, TROFYMOW J A. 2011. Including the effects of water stress on decomposition in the Carbon Budget Model of the Canadian Forest Sector CBM-CFS3 [J]. Ecological Modelling, 222(5):1080-1091.
SMYTH C E, MACEY D, TROFYMOW J A. 2015. Long-term litter decay in Canadian forests and the influence of soil microbial community and soil chemistry [J]. Soil Biology and Biochemistry, 80: 251-259.
SONG F Q, FAN X X, SONG R Q. 2010. Review of mixed forest litter decomposition researches [J]. Acta Ecologica Sinica, 30(4): 221-225.
SONG X Z, JIANG H, PENG C H, et al. 2012. Leaf litter decomposition along the temperate-tropical transect(east China): the influence of stand succession, litter quality and climate [J]. Polish Journal of Ecology, 60:265-276.
THIRUKKUMARAN C M, PARKINSON D. 2002. Microbial activity,nutrient dynamics and litter decomposition in a Canadian Rocky Mountain pine forest as affected by N and P fertilizers [J]. Forest Ecology and Management, 159(3): 187-201.
TIAN D L, PENG Y Y, YAN W D, et al. 2010. Effects of thinning and litter fall removal on fine root production and soil organic carbon content in Masson pine plantations [J]. Pedosphere, 20(4): 486-493.
TRINDER C J, JOHNSON D, ARTZ R R E. 2009. Litter type, but not plant cover, regulates initial litter decomposition and fungal community structure in a recolonising cutover peatland [J]. Soil Biology and Biochemistry, 41(3): 651-655.
USHIO M, KITAYAMA K, BALSER T C. 2010. Tree species effects on soil enzyme activities through effects on soil physicochemical and microbial properties in a tropical montane forest on Mt. Kinabalu,Borneo [J]. Pedobiologia, 53(4): 227-233.
WANG C Y, GUO P, HAN G M, et al. 2010. Effect of simulated acid rain on the litter decomposition of Quercus acutissima and Pinus massoniana in forest soil microcosms and the relationship with soil enzyme activities [J]. Science of the Total Environment, 408(13): 2706-2713.
WANG Q K, WANG S L, HE T X, et al. 2014. Response of organic carbon mineralization and microbial community to leaf litter and nutrient additions in subtropical forest soils [J]. Soil Biology and Biochemistry,71: 13-20.
WANG Q K, WANG S L. 2006. Microbial biomass in subtropical forest soils: effect of conversion of natural secondary broad-leaved forest to Cunninghamia lanceolata plantation [J]. Journal of Forestry Research,17(3): 197-200.
WANG S J, RUAN H H, WANG B. 2009. Effects of soil microarthropods on plant litter decomposition across an elevation gradient in the Wuyi Mountains [J]. Soil Biology and Biochemistry, 41(5): 891-897.
WANG W Q, SARDANS J, TONG C, et al. 2016. Typhoon enhancement of N and P release from litter and changes in the litter N:P ratio in a subtropical tidal wetland [J]. Environmental Research Letters, 11(1):014003.
ZHANG B, WANG H L, YAO S H, et al. 2013. Litter quantity confers soil functional resilience through mediating soil biophysical habitat and microbial community structure on an eroded bare land restored with mono Pinus massoniana [J]. Soil Biology and Biochemistry, 57:556-567.
ZHANG P, TIAN X J, HE X B, et al. 2008. Effect of litter quality on its decomposition in broadleaf and coniferous forest [J]. European Journal of Soil Biology, 44(4): 392-399.
葛晓敏, 唐罗忠, 王瑞华, 等. 2017. 杨树人工林生态系统凋落物生物量及其分解特征[J]. 生态环境学报, 26(9): 1457-1464.
郭彩虹, 杨万勤, 吴福忠, 等. 2018. 川西亚高山森林林窗对凋落枝早期分解的影响[J]. 植物生态学报, 42(1): 28-37.
韩春兰, 邵帅, 王秋兵, 等. 2015. 兴安落叶松林火干扰后土壤有机碳含量变化[J]. 生态学报, 35(9): 3023-3033.
和润莲, 陈亚梅, 邓长春, 等. 2015. 雪被期川西高山林线交错带两种地被物凋落物分解与土壤动物多样性[J]. 应用生态学报, 26(3):723-731.
李晗, 吴福忠, 杨万勤, 等. 2015. 亚高山森林林窗对凋落物分解过程中半纤维素动态的影响[J]. 植物生态学报, 39(3): 229-238.
刘发林. 2017. 模拟火干扰对森林土壤微生物活性及氮矿化的影响[J].生态学报, 37(7): 2188-2196.
刘敏, 王长庭, 字洪标, 等. 2016. 火烧干扰下高寒草甸土壤微生物群落功能多样性变化特征[J]. 应用与环境生物学报, 22(2):263-270.
陆梅, 田昆, 张仕艳, 等. 2010. 不同干扰程度下高原湿地纳帕海土壤酶活性与微生物特征研究[J]. 生态环境学报, 19(12): 2783-2788.
马川, 董少锋, 莫江明. 2012. 鼎湖山马尾松林凋落物分解对凋落物输入变化的响应[J]. 生态环境学报, 21(4): 647-653.
张亮, 韩静艳, 王道涵, 等. 2017. 草地生态系统土壤呼吸对放牧干扰的响应研究进展[J]. 生态科学, 36(2): 201-207.
——以杉木抚育间伐为例

