免疫型肠内营养对食管癌患者术后免疫功能和生活质量的影响
张思文
(中国医科大学附属盛京医院胸外科,辽宁 沈阳 110004)
食管癌是一种较为常见的恶性肿瘤[1],手术切除是常用的治疗方法之一[2],由于患者术后短期内无法进食,术后常常需要辅以肠外或者肠内营养[3-4]。近些年在其他疾病中的研究显示,与肠外营养比较,肠内营养有助于降低患者院内感染率、提高患者免疫力、保护胃肠道黏膜屏障等众多功能[5]。且由于食管癌患者术后禁食时间较长,因此肠内营养在食管癌患者术后的价值越来越得到重视。2014年我国学者官禹等研究显示,与肠外营养相比,早期肠内营养患者术后排气时间、排便时间和平均住院时间显著缩短,术后营养指标和免疫功能显著改善[6]。最近研究显示食管癌患者可存在一定的免疫抑制[7],癌症患者免疫抑制主要表现为Th1/Th2细胞免疫功能向Th2漂移,而组织微环境中调节性T细胞占优势,进而介导肿瘤细胞对免疫系统的免疫耐受,与肿瘤的转移、复发等息息相关[8-9]。免疫型肠内营养在对患者进行肠内营养支持的同时,还可以通过调节免疫系统改善患者免疫功能,可能在食管癌术后患者中具有重要的临床意义。但目前相关研究较为缺乏。本研究探讨了免疫型肠内营养对食管癌患者术后免疫功能和生活质量的影响,具有一定的临床意义和创新性。现报告如下。
1 资料与方法
1.1一般资料自2014年1月至2016年1月,前瞻性收集中国医科大学附属盛京医院收治的食管癌患者80例,纳入标准:(1)食管癌(所有食管癌患者均经过术中病理确诊);(2)年龄大于等于18岁且小于等于65岁;(3)无远处转移;(4)同意参与本研究。排除标准:(1)合并其他恶性肿瘤;(2)肝肾等脏器功能不全;(3)既往重大心脑血管疾病史;(4)甲状腺功能不全;(5)免疫系统疾病;(6)血液系统疾病;(7)内分泌系统疾病;(8)急性或慢性感染期;(9)研究期间不配合、放弃、转院或随访期间失访。本研究中所有患者均知情同意并签署知情同意书,本研究通过中国医科大学附属盛京医院医学伦理委员会批准。研究期间,根据纳入标准和排除标准,共纳入患者80例,所有患者均择期行食管癌切除术。术后将患者按照完全随机数字表法,分为观察组和对照组,每组各40例。两组患者性别、年龄、组织类型、食管病变长度和临床TNM分期等一般资料比较均差异无统计学意义(P>0.05),见表1。
1.2治疗方法所有患者入院后,完善相关检查,如有手术适应证无手术禁忌证,则择期行“食管癌切除术”,术后所有患者均给予肠内营养支持、镇痛、补液、抗感染等对症支持治疗。肠内营养支持方案:(1)观察组:术后第1天仍只给予肠外营养,术后第2天开始经术中放置的肠内营养管给予肠内营养,目标营养支持水平为35 kcal·kg-1,从20 mL·h-1开始,逐日增加5 mL·h-1至目标水平,如患者有腹泻、腹痛、腹胀等不适症状,则适当减量。肠内营养试剂为立适康(西安立邦临床营养公司,批号20141245)+谷氨酰胺(成都力思特制药股份有限公司,批号201407AD)。使用至术后第14天。(2)对照组:不给予谷氨酰胺,其余肠内营养支持方案同观察组。
1.3观察指标主要观察指标为两组患者CD4+T细胞、CD8+T细胞、白蛋白、C反应蛋白、吻合口瘘、切口部位感染、出血、腹泻、腹胀、腹痛、住院时间和健康相关的生存质量评分(SF-36)。
1.4数据测定(1)CD4+T细胞和CD8+T细胞:抽取静脉血5 mL,留存在乙二胺四乙酸二钠试管中,加入单克隆抗体后室温下避光反应30 min后立刻进行流式细胞仪检测(Epics XL型流式细胞仪,美国Beckman coulter公司)。(2)健康相关的生存质量评分(SF-36):总分为100分,得分越高,表明患者生存质量越高[10]。

表1 两组患者一般资料比较
1.5统计学方法本研究中所有数据分析均采用SPSS 22.0统计软件完成,P<0.05则认为差异有统计学意义,所有的检验均是双侧检验。两组患者白蛋白、球蛋白等计量资料之间的差异采用两独立样本的t检验进行统计分析,组内比较采用配对t检验;两组患者吻合口瘘、切口部位感染等计数资料之间的差异采用χ2检验或确切概率法进行统计分析。
2 结果
2.1两组患者免疫功能比较两组患者术后第1天CD4+T细胞和CD8+T细胞比例均差异无统计学意义[(25.85±2.21)%比(25.08±2.09)%,P=0.111]和[(29.18±3.44)%比(28.75±3.41)%,P=0.576]。与对照组比较,观察组患者术后第7天和第14天CD4+T细胞比例显著增高[(27.74±2.65)%比(25.29±2.74)%,P<0.001和(27.95±2.715)%比(25.52±2.47)%,P<0.001];第7天和第14天CD8+T细胞比例显著增高[(30.85±2.79)%比(28.44±2.69)%,P<0.001和(30.91±3.79)%比(29.07±3.64)%,P=0.030]。
2.2两组患者白蛋白和C反应蛋白水平比较两组患者术后第1天和第14天白蛋白均差异无统计学意义(P>0.05)。两组患者术前C反应蛋白差异无统计学意义[(18.58±5.39)mg·L-1比(19.12±6.24)mg·L-1,P=0.617]。与对照组比较,观察组患者术后第14天C反应蛋白显著降低[(7.37±2.85)mg·L-1比(11.57±4.85)mg·L-1,P<0.001]。见表2。
2.3两组患者术后并发症比较两组患者术后切口部位感染、腹泻、腹胀和腹痛等均差异无统计学意义(P>0.05)。两组均无患者发生吻合口瘘和出血。见表3。
2.4两组患者住院时间和健康相关的生存质量比较与对照组比较,观察组患者住院时间显著缩短[(21.73±3.26)d比(24.38±4.28)d,P=0.002];术后第14天健康相关的生存质量评分显著增高[(79.57±8.57)分比(74.38±7.12)分,P=0.035]。
3 讨论
癌症患者常常伴有一定程度的免疫抑制,2015年学者Kiyomi等[9]研究显示乳腺癌组织中Th1/Th2/Th17细胞因子与肿瘤分期有关。2011年Krohn等[11]研究同样显示乳腺癌患者可存在Th1/Th2细胞免疫失衡,手术切口原发肿瘤后有助于促进细胞免疫向Th1细胞免疫漂移。2014年HONG等[7]研究显示食管癌患者放化疗后存在免疫抑制,主要表现为Th1/Th2平衡功能失调,使用热温疗法有助于改善患者免疫功能。鉴于免疫功能在机体抗肿瘤细胞中的重要性,探讨免疫型肠内营养对食管癌患者术后免疫功能的影响具有十分重要的临床意义。目前相关研究较为缺乏,因此本研究具有一定的创新性和临床意义。本研究显示与普通的肠内营养相比,免疫型肠内营养显示提高了患者CD4+T细胞和CD8+T细胞水平。CD4+T细胞和CD8+T细胞分别是免疫系统的重要组成部分。在白介素-2的介导下,CD4+T细胞可以分化为Th0,并进一步分化为Th1和Th2细胞,分别介导细胞免疫和体液免疫[12-14]。CD8+T细胞可以分化为细胞毒性T细胞,细胞毒性T细胞是机体杀灭肿瘤细胞的主要细胞。肿瘤细胞产生免疫耐受的主要机制是通过降低肿瘤微环境中CD8+T细胞水平,进而减少免疫系统对肿瘤细胞的杀伤作用。提高CD4+T细胞和CD8+T细胞水平有助于增强机体对肿瘤细胞的杀伤作用。在其他肿瘤患者中的研究尚显示免疫抑制程度与临床预后相关[15]。但本研究未对两组患者临床预后进行长期跟踪,这是本研究的主要不足。另外,本研究显示免疫型肠内营养显著降低了患者术后C反应蛋白水平,显示其有助于降低患者术后体内炎性反应,促进患者快速康复,并改善患者生活质量。
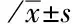
表2 两组患者白蛋白和C反应蛋白水平比较

表3 两组患者术后并发症比较/例(%)
本研究中所采用的免疫型肠内营养是在普通肠内营养中加入谷氨酰胺,其是淋巴细胞分泌、增殖和维持其正常功能的必须成分,因此可以作为免疫调节剂。谷氨酰胺还可以增加肿瘤坏死因子、白介素-1等炎性因子,从而提高患者体内抵抗力,发挥抗肿瘤作用。提供外源性谷氨酰胺可明显增加危重病人的淋巴细胞总数、T淋巴细胞和循环中CD4/CD8的比率,增强机体的免疫功能。2016年我国学者章露文等[16]研究同样显示在肠内营养中加入谷氨酰胺有助于提高患者IL-6水平,但该研究观察指标较少,仅仅观察了两组患者IgM、CD4+T细胞、IL-6和谷氨酰胺水平,相比较而言,本研究系统性地观察了两组患者免疫功能、炎性反应、并发症、生活质量等指标,更具临床意义。
[1] GHARAI L,VERMA V,DENNISTONENNISTON KA,et al.Radiation therapy and cardiac death in long-term survivors of esophageal cancer:An analysis of the surveillance,epidemiology,and end result database[J].PLoS One,2016,11(7):e0158916.DOI:10.1371/journal.pone.0158916.
[2] WU SG,XIE WH,ZHANG ZQ,et al.Surgery combined with radiotherapy improved survival in metastatic esophageal cancer in a surveillance epidemiology and end results population-based study[J].Sci Rep,2016,6(2):28280-28288.
[3] MIYATA H,YANO M,YASUDA T,et al.Randomized study of the clinical effects of ω-3 fatty acid-containing enteral nutrition support during neoadjuvant chemotherapy on chemotherapy-related toxicity in patients with esophageal cancer[J].Nutrition,2017,33:204-210.
[4] TAKESUE T,TAKEUCHI H,OGURA M,et al.Erratum to:A prospective randomized trial of enteral nutrition after thoracoscopic esophagectomy for esophageal cancer[J].Ann Surg Oncol,2016,23(12):1074-1082.
[5] PENG L,WU LG,LI B,et al.Early enteral nutrition improves intestinal immune barrier in a rat model of severe acute pancreatitis[J].J Hepatobiliary Pancreat Sci,2016,23(11):681-687.
[6] 官禹.食管癌患者术后肠内营养临床效果分析[J].局解手术学杂志,2014,23(3):247-250.
[7] HONG M,JIANG Z,ZHOU YF.Effects of thermotherapy on Th1/Th2 cells in esophageal cancer patients treated with radiotherapy[J].Asian Pac J Cancer Prev,2014,15(5):2359-2362.
[8] NUNEZ C,LOZADA-REQUENA I,YSMODES T,et al.Immunomodulation of Uncaria tomentosa over dendritic cells,il-12 and profile TH1/TH2/TH17 in breast cancer[J].Rev Peru Med Exp Salud Publica,2015,32(4):643-651.
[9] KIYOMI A,MAKITA M,OZEKI T,et al.Characterization and clinical implication of Th1/Th2/Th17 cytokines produced from three-dimensionally cultured tumor tissues resected from breast cancer patients[J].Transl Oncol,2015,8(4):318-326.
[10] ANTIPOVA EI,SHIBKOVA DZ.[Evaluation of the life quality of specialists in the social work with the use of the SF-36 Questionnaire][J].Gig Sanit,2016,95(4):369-375.
[11] KROHN M,LISTING M,TJAHJONO G,et al.Depression,mood,stress,and Th1/Th2 immune balance in primary breast cancer patients undergoing classical massage therapy[J].Support Care Cancer,2011,19(9):1303-1311.
[12] HIRAHARA K,NAKAYAMA T.CD4+T-cell subsets in inflammatory diseases:beyond the Th1/Th2 paradigm[J].Int Immunol,2016,28(4):163-171.
[13] JANKOVIC D,FENG CG.CD4(+) T cell differentiation in infection:Amendments to the Th1/Th2 axiom[J].Front Immunol,2015,6(4):198-206.
[14] PEREZ-MAZLIAH D,LANGHORNE J.CD4 T-cell subsets in malaria:TH1/TH2 revisited[J].Front Immunol,2014,5(3):671-679.
[15] PAWAR VK,PANCHAL SB,SINGH Y,et al.Immunotherapeutic vitamin E nanoemulsion synergies the antiproliferative activity of paclitaxel in breast cancer cells via modulating Th1 and Th2 immune response[J].J Control Release,2014,196(12):295-306.
[16] 章露文,黄娟,张晴,等.免疫型肠内营养剂对食管癌患者术后影响的探讨[J].医药论坛杂志,2016,37(3):8-9.

