水稻光温敏核不育系Y58S花培后代改良株系的分子鉴定
黄翠红, 黄明, 陈淳, 杨瑰丽, 周丹华, 黄钰婷, 罗文龙, 陈志强, 王慧
(国家植物航天育种工程研究中心,华南农业大学,广东 广州 510642)
水稻光温敏核不育系Y58S(安农S-1/常菲22B//安农S-1/Lemont///培矮64S)由湖南杂交水稻研究中心选育,具有广适性、不育起点温度低、配合力好、抗逆性强以及株叶形态好、异交结实率高、米质优良等优点[1].自1989年两系法推广以来,不育起点温度“漂变”及制种风险等问题一直制约着其发展.随后,人们开始对提纯改良不育系开展了大量的研究,实践证明,不断提纯改良不育系是两系法杂交水稻研究和超级杂交水稻组合选育的关键.水稻花药培养技术自1970在我国开始至今经历了四十多年的研究与发展,并且取得了丰硕的成果.通过花药培养可在短期内获得稳定、纯合的二倍体,大大缩短了育种年限,且提高选择效率.但由于花药培养受较多因素的影响,其绿苗率往往较低,尤其是籼稻品种,其中不同基因型对花药培养力影响很大,前人研究认为导入一定的粳稻血缘能有效提高花药培养力[23].
花培后代植株鉴定存在较大的局限性,往往易受外界环境的影响导致鉴定周期较长,其中田间种植鉴定是水稻品质、外部形态特征等形状鉴定的主要方法[2-3].然而,随着DNA分子标记鉴定技术的不断发展,通过DNA分子标记鉴定法可从DNA水平上反映遗传多样性,具有准确可靠、取材方便、不受季节和组织特异性限制等优点,能广泛应用于水稻品种种质鉴定中.近年来,以SSR标记为基础的DNA指纹鉴定技术日渐成熟,并能广泛应用于水稻等农作物品种的特异性、真实性及纯度鉴定中,应用前景较为可观;应用在杂交种质鉴定的DNA分子标记主要有DNA指纹法和互补扩增法[4-13].目前,常用于水稻品种分子检测鉴定的方法是聚丙烯酰胺凝胶电泳检测法,但该方法不能准确读出目标DNA片段的大小,检测工作量较为繁琐,且检测效率偏低,难以对大批量品种的DNA指纹鉴定图谱数据进行有效整合和准确比较.因此,有待于建立一套准确、高效且能直接读出DNA片段大小的SSR标记检测新方法、新体系.
本研究在前期工作的基础上通过对水稻两系不育系Y58S与02428进行杂交回交的后代(Y58S//02428/02428,BC1F3的两系不育株系,目的为导入一定的粳稻血缘)进行花药培养,选育出新的光温敏核不育系株系M196S,在此,结合本课题组的基因分型平台.进行品种种质鉴定与基因分型,检测花培后代不育系M196S与各亲本间的血缘关系并进行综合性状分析,以期快速获得聚有多个优良基因的改良光温敏不育系材料.
1 材料与方法
1.1 供试材料
M196S(Y58S//02428/02428 BC1F3的两系不育株系的花培H2代材料,经连续两代育性跟踪调查均表现为典败);对照(亲本)材料:Y58S;02428;培矮64S;安农S-1.
1.2 方法
1.2.1 DNA的提取 使用改进的CTAB法提取全基因组DNA,并保存于-20 ℃冰箱中待用.
1.2.2 基因检测方法 采用T-ARMS-PCR(四引物PCR毛细管电泳检测方法)与SNP-HRM(高分辨溶解曲线)检测结合进行.
1.2.3 引物的选择 使用《水稻品种真实性鉴定 SSR标记法》的48对引物与本课题组基因分型平台开发的10个有利基因的标记.所用的引物均由上海生工有限公司合成提供.
1.2.4 T-ARMS-PCR分析 PCR 在20 μL体系中进行,包括4 μL DNA模板、1.4 μL dNTP、2 μL 10×PCR Buffer、0.1 μLTaq酶(以上试剂均由Takara公司购买)、0.4 μL primer (R+F)、14 μL ddH2O.PCR 扩增循环为95 ℃,5 min;94 ℃,40 s;55 ℃,30 s;72 ℃ 45 s;72 ℃,7 min;25 ℃,1 min;33个循环.PCR扩增结束后,吸取2 μL PCR产物进行毛细管电泳检测,使用DNF-900双链DNA试剂盒,并在Fragment analyzer全自动毛细管电泳上进行检测分析.
HRM分析:采用巢式PCR扩增,第一轮多重PCR以基因组DNA为模板,利用外部引物扩增;第二轮PCR以稀释的第一轮PCR扩增产物为模板,利用内部引物扩增.第一轮PCR:反应体系依次加入2×PCR Mix母液(北京百泰克)5 μL、2~5对外部引物F/R(10 μmol·L-1)各0.3 μL以及0.5 μL基因组DAN,最后以双蒸水补足10 μL.PCR扩增循环为95 ℃,5 min;25×(95 ℃,20 s; 57 ℃,20 s;72 ℃,10 s);72 ℃,5 min.反应完成后,向PCR管加入200 μL双蒸水,以稀释第一轮PCR产物(约20倍).第1轮PCR:反应体系依次加入2×PCR Mix母液(北京百泰克)4 μL、内部引物F/R(10 μmol·L-1)各0.3 μL、0.5 μL 20×EvaGreen染液(Biotium, USA)、以及0.5 μL稀释过的第一轮PCR产物,最后以双蒸水补足10 μL.PCR扩增循环为95 ℃,2 min;25×(95 ℃,20 s; 59 ℃,20 s;72 ℃,10 s);72 ℃,5 min;95 ℃,2 min;25 ℃,2 min.反应完成后,向第2轮PCR产物加入20 μL矿物油转移至HRM检测板后放入LightScanner96高分辨率溶解曲线分析系统(Idaho Technology Inc,美国)进行HRM检测,最后以配套的小片段法(small amplicon)进行基因分型分析,具体分析步骤按照软件操作指南进行.
1.2.5 结果统计 记录检测样品在48对引物中的扩增片段长度,以及花培H2代株系M196S与几个亲本之间的相似条带,并对其之间进行相似性比较.
1.2.6 指纹记录和聚类分析 将扩增产物清晰、稳定、可重复的SSR引物的扩增结果统计后进行聚类分析.统计方法:把各引物的扩增产物根据电泳后特异标记有无,分别相应转化记录为数字1和0,即用“1”表示有扩增条带,“0”表示无扩增条带[14-16].品种间遗传相似度用公式GS(i,j)=2N(i,j)/[N(i)+N(j)] 计算,在这里N(i,j)表示品种i和j间共有的扩增条带数, 而N(i)和N(j)分别表示品种i和j各自扩增的总条带数[17].这个数据矩阵用计算机软件STATISTICA的UPGA (unweighted pair group average)聚类分析计算连锁距离的分离百分比(percent disagreement linkage distance)[14].
2 结果与分析
2.1 花培H2代株系M196S与亲本的指纹图谱数据构建
利用分布在12条染色体的48对SSR引物对花培H2代株系M196S与4个亲本Y58S、02428、培矮64S、安农S-1进行毛细管电泳扩增(图1)并记录各扩增片段大小,结果表明,各对引物经PCR扩增出的条带数从2~7条不等,扩增产物的稳定性和重复性也有所差异,其中M196S分别在RM71、RM85、RM471、RM336、RM311、RM267、RM253、RM481、RM278、RM561、RM551、RM432、RM331、RM21、RM3331、RM567、RM542、RM332 等18对SSR引物中的扩增结果与Y58S表现一致;在RM471、RM311、RM253、RM258、RM17、RM598、RM542、RM316等8对引物中的扩增结果与02428表现一致;在RM583、RM71、RM85、RM471、RM274、RM336、RM267、RM253、RM258、RM561、RM8277、RM551、RM331、OSR28、RM21、RM3331、RM231、RM567、RM542等19对引物中与培矮64S表现一致;而在RM71、RM274、RM336、RM119、RM258、RM561、RM551、RM598、RM432、RM331、RM3331、RM443、RM490、RM423、RM567、RM332、RM7102等17对引物中与安农S-1表现一致.另外,毛细管电泳检测法的准备度与灵敏度较高,能快速检测出DNA片段的准确大小,同时利用毛细管电泳仪的分析软件能快速无误地将检测结果转换成数字(1/0)模式(表1),便于数据分析及图谱数据的构建,实现指纹图谱数据构建的高通量.
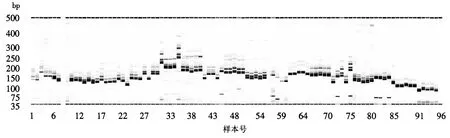
图1 M196S等材料在48对SSR引物中的部分扩增结果Fig.1 Amplification results of the samples at 48 DNA fingerprint markers (section)
2.2 结果分析
用48对SSR引物的所有扩增条带对M196S等5个供试水稻材料按照遗传相似度进行聚类分析比较,结果表明,5个供试水稻材料的遗传相似度0.45~0.69,在相似度0.45处分为2个组(图2),M196S、安农S-1、Y58S和培矮64S为第1组,而02428为第2组.其中,第1组的4个材料具有较为相近的遗传背景,Y58S(安农S-1/常菲22B//安农S-1/Lemont///培矮64S)具有安农S-1和培矮64S的血缘,而来自安农S-1的血缘大于培矮64S,同时M196S为Y58S花培后代,也即均具有以上材料血缘.另外,在相似度0.56和0.60处又被各自分组,根据品种间的相似性,最后分为4组,除了02428单独1组外,M196S与安农S-1各为1组、Y58S和培矮64S为另1组.这表明花培H2代材料M196S血缘更接近于安农S-1,同时也遗传了另外3个两系不育系亲本的血缘,而02428的血缘相对较少,M196S是花药培养技术快速选育出来的1个新的不育系材料,同时分析结果也符合前期田间表现观察的筛选结果.
2.3 花培H2代株系M196S综合性状的基因分型检测
利用本课题组基因分型平台分子标记辅助选择技术对花培H2代M196S株系进行Wxb(低直链淀粉基因)、fgr(香味)、Chalk5(垩白度)、Alk(糊化温度)、Pita(稻瘟病抗性)、Pik-H4(稻瘟病抗性)、Pi2/9(稻瘟病抗性)、Xa23(白叶枯抗性)、Rf3(野败不育恢复基因)和Rf4(野败不育恢复基因)等多个关于米质、香味、抗病以及恢复力等有利基因的检测,检测结果表明(表2),M196S含有2个纯合的Wxb和Rf3基因,而两个对照(亲本)材料,其中Y58S含有4个纯合的Wxb、Alk、Pita、Rf3以及携带杂合的Pi2/9基因;02428含有4个纯合的Wxb、Chalk5、Pik-H4、Rf4基因.这表明M196S含有的有利基因均少于两对照(亲本)材料,而父母亲本均为纯合基因方能保证后代的稳定纯合,另一方面,花药培养能快速得到纯合的株系(由加倍单倍体形成的株系,简称DH系),加快育性的纯合稳定,然而DH系在加大力度注重育性选择的过程中却难免造成一些有利基因的丢失,这与前人研究结果一致[18-19],也为后期花药培养进行选育种提供一定的参考价值.

表1 M196S等材料在48对SSR标记上的毛细管电泳扩增信息(部分)1)Table 1 Fragment sizes and transfer digital format of the samples by capillary and gel electrophoresis with 48 DNA fingerprint markers (section)
1)片段误差为±0~1 bp.

图2 用48对SSR引物对M196S等5个水稻品种的聚类分析结果Fig.2 Clustering of five rice materials with 48 DNA fingerprint markers
2.4 M196S的育性表现
2.4.1 田间育性鉴定 M196S株叶型表现较好(图3),将其株系的单株不断分蔸种植,让其持续抽穗,在广州自然光照(长日高温)条件下考察花粉育性,花粉不育度保持在100%,与Y58S的花粉不育度相符,显微镜碘液染色检查结果显示为典败类型.
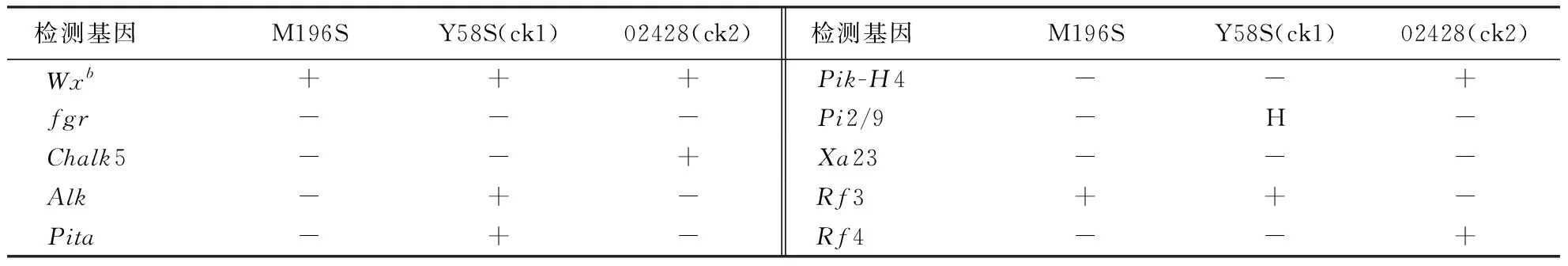
表2 M196S等材料综合性状检测结果的比较1)Table 2 Comprehensive characters of the materials
1)“+”表示含有该基因;“-”表示不含该基因;“H”表示基因型为杂合.

图3 M196S(左)与Y58S(右)田间种植情况Fig.3 The field performance of M196S (L) and Y58S (R)
2.4.2 光温箱育性鉴定 将M196S株系处于幼穗发育期的单株分蔸,用小桶移栽,放置于人工气候箱长日低温条件(23 ℃,14 h)下分别处理0、2、4、6 d后观察育性的变化,结果表明处理0~2 d,M196S花粉不育度为100%,处理4~6 d后检测花粉不育度为50%~75%,并能收获少量种子,此结果也表明了M196S的育性受光温调控.
3 讨论
3.1 水稻两系不育系的指纹图谱鉴定
目前,种质鉴定方面应用前景较好的分子标记主要是以SSR为基础的DNA指纹图谱标记[5-6],此类标记能在各种生物组织中广泛存在,具有稳定遗传和共显性等特点,而且相对来说,SSR技术操作简单、快速、重复性好,可直接用于水稻等农作物品种的真实性鉴定,还可鉴别串粉引起的假杂种和杂交种子中混杂的母本杂株[20-21].然而,采用聚丙烯酰胺电泳检测法对SSR指纹图谱标记进行水稻品种DNA指纹数据库构建,如何准确地对大批量不同批次、不同胶块的水稻品种DNA指纹鉴定数据进行整合一直是个难题[22].本课题组的基因分型平台的DNA提取与检测方法经反复多次的应用实践证明,结果是准确可靠的,并很好地解决了大规模不同批次DNA指纹鉴定数据的有效整合和准确比较的问题,同时毛细管电泳检测出的各多态性DNA片段的准确性更有利于转换成数字(1/0)模式,便于后期数据分析及图谱数据的构建.本研究通过电泳检测及分析结果表明,花培H2代材料M196S为异于Y58S的新的改良两系不育系材料,血缘更接近于安农S-1,这与Y58S同样来源于安农S-1有关,同时也遗传了其余3个亲本(培矮64S、Y58S与02428)的血缘,其中与02428血缘较远,这与前期田间的选择淘汰的育种手段有关,与02428杂交回交是为了保证导入一定的粳稻血缘以提高花药培养力,随后经3代自交多次选留与母本血缘更为接近的单株,并淘汰偏粳血缘材料,因此,经人为选择育种后的检测结果与预期的结果基本一致,也说明了通过与02428杂交导入一定粳稻血缘提高花药培养力的途径是有效可行的[23].
3.2 利用花药培养加快选育进程
大量的研究结果表明,花培育种具有缩短育种年限、选择效率高和遗传类型多等特点[24],主要表现为:第一,加速遗传特性的稳定,使杂种从杂合子迅速达到纯合,从而缩短了育种周期;第二,花粉植株来源于单倍体加倍后的双单倍体,其基因型与表现型一致,排除了显性基因遮盖隐性基因的干扰,大大避免了选择的盲目性,提高了选择效率;第三,由于花粉植株是经过基因重组,具有多种多样基因型的每个花粉粒再生成的植株,在自然加倍过程中不受有性受精过程的竞争,且在离体培养过程中或多或少会诱导基因的突变,使花药培养后代的遗传变异类型较常规,杂交后代更丰富[25].花药培养可用于水稻新光温敏核不育系的选育以及原光温敏核不育系的提纯[26-27].通过花药培养获得所有的植株在遗传标记位点均为纯合,因为无论单倍体、二倍体还是多倍体均由小孢子诱导而来,其中二倍体均为DH系.在单个性状选育过程中,通过花药培养技术能得到快速纯合稳定的单株,然而在两系不育系改良中由于过多集中在育性的选择上,忽略了其他有利基因如品质、抗性基因等,若子代基因型为杂合型时,对分离群体的选择中往往会造成某些有利基因的丢失,因此在得到育性稳定改良两系不育系株系后可结合分子辅助选择育种及时进行检测验证,以便于指导后期田间改良工作进一步的开展,有待于进一步的杂交选育以及结合分子辅助选择方法的不断验证,最终获得育性稳定且聚合有多个优良基因的改良不育系株系.
3.3 分子辅助选择与花药培养的结合
以水稻光温敏核不育系为母本配制的两系法杂交水稻具有高效、便捷、受限制因素少的特点,已经成为我国杂交水稻育种中提高产量、改良品质的主要途径之一[28].而分子辅助选择作为一种有效的辅助育种手段与两系不育系选育方法的结合极大地提高了两系法的效率,同时结合花药培养技术能大大加快两系不育系的提纯进程,缩短育种程序.分子标记辅助选择育种是利用分子标记与决定目标性状基因紧密连锁或表现共分离关系的特点,通过检测分子标记检测目的基因的存在,实现对个体的目标区域以及全基因组筛选,从而减少连锁累赘,获得期望的个体,以实现有目的的提高育种效率的辅助手段[29].通过分子标记辅助选择既可以鉴别亲缘关系,也可在回交育种中鉴别数量性状和隐性性状的转移、杂种后代的选择、杂种优势的预测及品种纯度鉴定等各个育种环节,达到选择目标性状的目的,具有快速、准确、不受环境条件干扰等优点.基于分子标记辅助选择本课题组开发了基因分型平台,实现DNA的自动提取以及T-ARMS-PCR技术、高分辨溶解曲线(HRM)检测技术的完善,保证检测结果更为快速、准确、可靠,并实现高通量,这为花培后选育出来的育性改良两系不育株系进一步进行综合性状改良的进程提供保证.
[1] 邓启云.广适性水稻光温敏不育系Y58S的选育[J].杂交水稻,2005,20(2):15-18.
[2] 辛业芸,张展,熊易平,等.应用SSR分子标记鉴定超级杂交水稻组合及其纯度[J].中国水稻科学,2005,19(2):95-100.
[3] 李进波,方宣钧,杨国才,等.两系杂交稻亲本SSR指纹图谱的建立及其在种子纯度鉴定中的应用[J].杂交水稻,2005,20(2):50-53.
[4] 陆维忠,郑企成.植物细胞工程与分子育种技术研究[M].北京:中国农业科学技术出版社,2003:167-181.
[5] 程本义,施勇烽,沈伟峰,等.南方稻区国家水稻区域试验品种的微卫星标记分析[J].中国水稻科学,2007,21(1):7-12.
[6] 程本义,施勇烽,沈伟峰,等.水稻品种DNA指纹检测技术体系及其应用[J].杂交水稻,2008,23(1):54-59.
[7] 程本义,吴伟,夏俊辉,等.浙江省水稻品种DNA指纹数据库的初步构建及其应用[J].浙江农业学报,2009,21(6):555-560.
[8] 朱玉君,毛一剑,庄杰云,等.利用SSR标记鉴定杂交水稻种子纯度[J].中国稻米,2009,16(6):24-26.
[9] HUANG X Q, BORNER A , RODER S, et al. Asseing genetic diversity of wheat (TriticumaestivumL.) germplasm using microsatellite markers[J]. Theor Appl Genet, 2002,105:699-707.
[10] 王凤格,赵久然,郭景伦,等.中国玉米新品种DNA指纹库建立系列研究:Ⅰ.玉米品种纯度及真伪鉴定中SSR技术标准实验体系的建立[J].玉米科学,2003,11(1):3-6.
[11] 李俊芳,张雪原,孙世贤,等.国家玉米主产区预试品种的SSR分析:Ⅰ.预试品种的真实性和一致性评价[J].玉米科学,2006,14(6):38-42.
[12] 张雪原,赵攀峰,王凤格,等.玉米品种SSR分子标记与田间小区种植一致性鉴定结果的比较[J].玉米科学,2009,17(1):40-45.
[13] 王立新,李云伏,常利芳,等.建立小麦品种DNA指纹方法的研究[J].作物学报,2007,33(10):1 738-1 740.
[14] WENG M L, LIU B, JIN D, et al. Identification of 27 porphyra lines (Rhodophyta) by DNA fingerprinting and molecular markers[J]. Journal of Applied Phycology, 2005,17(1):91-97.
[15] WANG B, JIA J H, SHI J F, et al. Idetification of porphyra lines using computerized DNA fingerprinting[J]. Acta Oceanologica Sinica, 2001,20(3):401-407.
[16] 王斌,贾建航,李传友,等.通过DNA指纹的计算机分析进行水稻种质鉴定[J].云南大学学报,1999,21(S1):20.
[17] NEI M, LI W H. Mathematical model for studying genetic variation interms of restriction endonuclease[J]. Proc Natl Acad Sci, 1979,76(1):5 269-5 273.
[18] 何平,李晶昭,朱立煌.影响水稻花药培养力的数量性状基因座位间的互作[J].遗传学报,1999,26(2):524-528.
[19] 唐海芹.水稻花药培养力的QTL分析[D].广州:华南农业大学,2009.
[20] 赵久然,王凤格,郭景伦,等.中国玉米新品种DNA指纹库建立系列研究Ⅱ.适于玉米自交系和杂交种指纹图谱绘制的SSR核心引物的确定[J].玉米科学,2003,11(2):3-5.
[21] 张彦,郭士伟,何冰,等.利用SSR标记建立杂交水稻分子指纹图谱数据库[J].江苏农业学报,2006,22(2):181-183.
[22] 贺梅,黄少锋,张丽萍,等,花药培养育种在水稻育种上的应用[J],北方水稻,2010,40(1):75-78.
[23] 沈锦骅,李梅芳,陈银全,等.花药培养在水稻品种改良上的应用[J].中国农业科学,1982,4(2):15-19.
[24] 赵维娜.水旱稻杂交F1代花药培养技术的研究及其DH系的构建[D].北京:中国农业大学,2004.
[25] 尹建华.籼型光敏核不育水稻杂种花粉植株的育性表现[J].江西农业学报,1993,3(1):27-32.
[26] 向跃武,张志雄,张安中,等.水稻光敏核不育系的花药和体细胞培养选育研究[J].西南农业大学学报,1993,15(5):462-465.
[27] MOU T M, LU X G, HOAN N T, et al. Two-line hybrid rice breeding in and outside China[C].国际杂交水稻学术研讨会,2003.
[28] MARCEL R J, DAVID H. Maker-assisteds election: new tools and strateges[J]. Trendsi Plant Sci, 1998(3):236-239.
[29] REED G H, WITTWER C T. Sensitivity and specificity of single-nucleotide polymorphism scanning by high-resolution melting analysis[J]. Clinical Chemistry, 2004,50(10):1 748-1 754.
——农民邓祚荣曾绘的水稻“两系”育种神话图谱

