油橄榄雄花分化比例与花序轴、叶片内源激素含量及产量的关系
姜成英, 芦 娟, 赵梦炯, 吴文俊
(甘肃省林业科学研究院/国家林业局油橄榄工程技术研究中心/甘肃省油橄榄工程技术研究中心,甘肃 兰州 730020)
油橄榄(OleaeuropaeaL.),原产于地中海地区,是人类最早认识、驯化、种植的油料作物之一,有4 000多年的栽培历史[1].我国规模引种油橄榄始于1964年,位于西秦岭南坡的白龙江河谷地是油橄榄最佳适生区之一,已成为中国最大的油橄榄种植基地[2].但与原产地相比,严重的大小年现象极大地制约了油橄榄产业的发展[3].经过长期的研究和观察,对油橄榄花芽分化和花器官形态建成的认识已经基本清晰[4-6],而且发现不同部位的内源激素含量的变化在其成花过程中起着关键的调控作用,成花之间存在紧密关系,尤其是IAA和ABA与核酸的代谢调控息息相关[7-12].朱振家等[13]在中国白龙江河谷地对引种的油橄榄花芽分化期激素水平进行研究,表明高水平的ABA、IAA、ABA/GA3、IAA/GA3和(ABA+IAA)/GA3有利于油橄榄成花诱导,高水平的ZR、ZR/GA3、ZR/ABA和ZR/IAA有利于油橄榄花芽分化.植物的性器官表现出雄全同株的性系统,通常认为是植物本身优化雌雄功能调配繁殖资源,从而适应环境达到最大化繁殖的一种适应机制,内源激素的含量及相互间的平衡对调配繁殖资源起着重要的调控作用,有研究就发现高水平的ABA/GA有利于花芽形态的分化,高水平的IAA/ZR及ABA/ZR促进花芽形态分化,但抑制雌雄蕊的形成,从而影响到雄花分化数量,进而影响单株产量[14-16].试验通过HPLC方法测定花期油橄榄叶片和花序轴内源激素的变化,统计雄花比例和产量,明确内源激素变化对雄花比例和产量的影响,揭示一定比例雄花的分化对调节其自身内源激素变化及繁殖策略的影响.
1 材料与方法
1.1 材料
供试材料的采集及试验观测全部于2014和2015年在甘肃陇南武都区大湾沟油橄榄示范园完成.品种名称及来源见表1.试验地点年平均气温13.9~14.9 ℃,绝对最高气温39.9 ℃,绝对最低气温-8.8 ℃,年平均降水量474 mm,年日照数1 911 h,无霜期263 d.

表1 供试材料名称、起源及用途Table 1 The name of varieties,orign and use
1.2 方法
1.2.1 雄花比例统计 在试验地点各品种随机标记树势一致的9个植株,每个植株选择60个花序,观测开花进程并统计花序中两性花和雄花的数目.
1.2.2 样品采集及内源激素测定 在花期采集孕育花芽的叶片,孕育叶芽的叶片及花序轴,各品种每个部位采集3份样品立即用液氮速冻,带回实验室保存在-80 ℃超低温冰箱中,激素(ZR, GA3, ABA, IAA)测定方法采用高效液相色谱法,使用Agilent 1200液相色谱仪(美国Agilent公司),色谱条件:色谱柱为ODS-C18,流动相为甲醇∶0.075%冰醋酸水溶液=45∶55(体积比),检测波长254 nm,流速为0.25 mL·min-1,柱温25 ℃,进样量为10 μL.
2 结果与分析
2.1 各品种雄花分化比例

表2 各品种2014、2015年度雄花比例Table 2 Mate flower ratio in 2014 and 2015
供试的4个品种都为甘肃陇南油橄榄产区主要栽培品种,4个品种中‘城固32’和‘鄂植8号’表现出典型的雄全同株现象(表2),2014和2015年度雄花比例分别为18.73%和21.31%,37.5%和31.74%,而‘莱星’和‘佛奥’没有分化雄花.
2.2 不同取样部位内源激素含量
2.2.1 IAA含量变化 花期,花序轴中IAA含量高于叶片中,孕育花芽和叶芽叶片中IAA含量变化无明显规律.就4个品种而言,花序轴上分化出一定比例雄花的品种‘鄂植8号’和‘城固32’在3个采样部位都表现出较高的IAA水平,尤其是‘鄂植8号’表现的尤为明显(图1).

图1 各品种不同采样部位IAA含量变化Fig.1 Changes of IAA content in the different parts of four olive varieties
2.2.2 ABA含量变化 花期,3个采样部位中花序轴中ABA含量水平最高,孕育花芽的叶片与孕育叶芽的叶片ABA含量水平较低,‘鄂植8号’和‘城固32’花序轴中ABA水平显著低于‘莱星’和‘佛奥’.
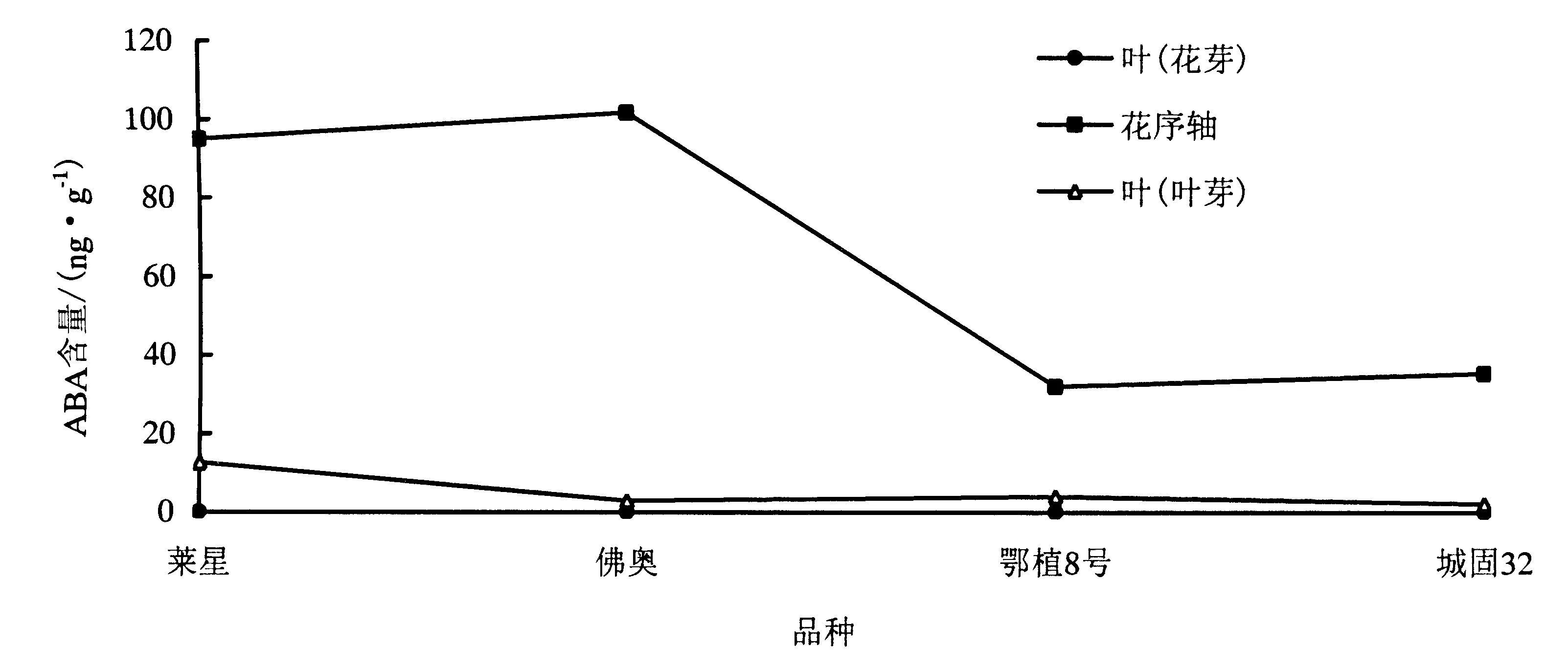
图2 各品种不同采样部位ABA含量变化Fig.2 Changes of ABA content in the different parts of four olive varieties
2.2.3 ZR含量变化 在油橄榄花期,如图3所示4个品种的3个采样部位中花序轴中ZR含量水平最高,分化出雄花的品种‘鄂植8号’和‘城固32’花序轴中ZR含量水平明显高于‘莱星’和‘佛奥’(图3).

图3 各品种不同采样部位IAA含量变化Fig.3 Changes of ZR content in the different parts of four olive varieties
2.2.4 花序轴ABA/ZR与IAA/ZR比值变化 在油橄榄花期,具有雄花分化数量的品种‘鄂植8号’和‘城固32’花序轴中ZR/IAA和ZR/ABA比值较高(图4).

图4 各品种花序轴中ZR/ABA和ZR/IAA变化Fig.4 Changes of the ratio of ZR/ABA and ZR/IAA in four olive varieties
2.3 雄花比例与产量的关系
通过连续2年的产量测定可知(图5),有一定雄花数量的分化的‘鄂植8号’和‘城固32’相对于平均产量的波动是4.52%和12.24%,而不分化雄花的品种‘莱星’和‘佛奥’相对于平均产量的波动是57.96%和41.85%,可见具有雄全同株现象的品种表现的更加稳产大小年现象不明显.
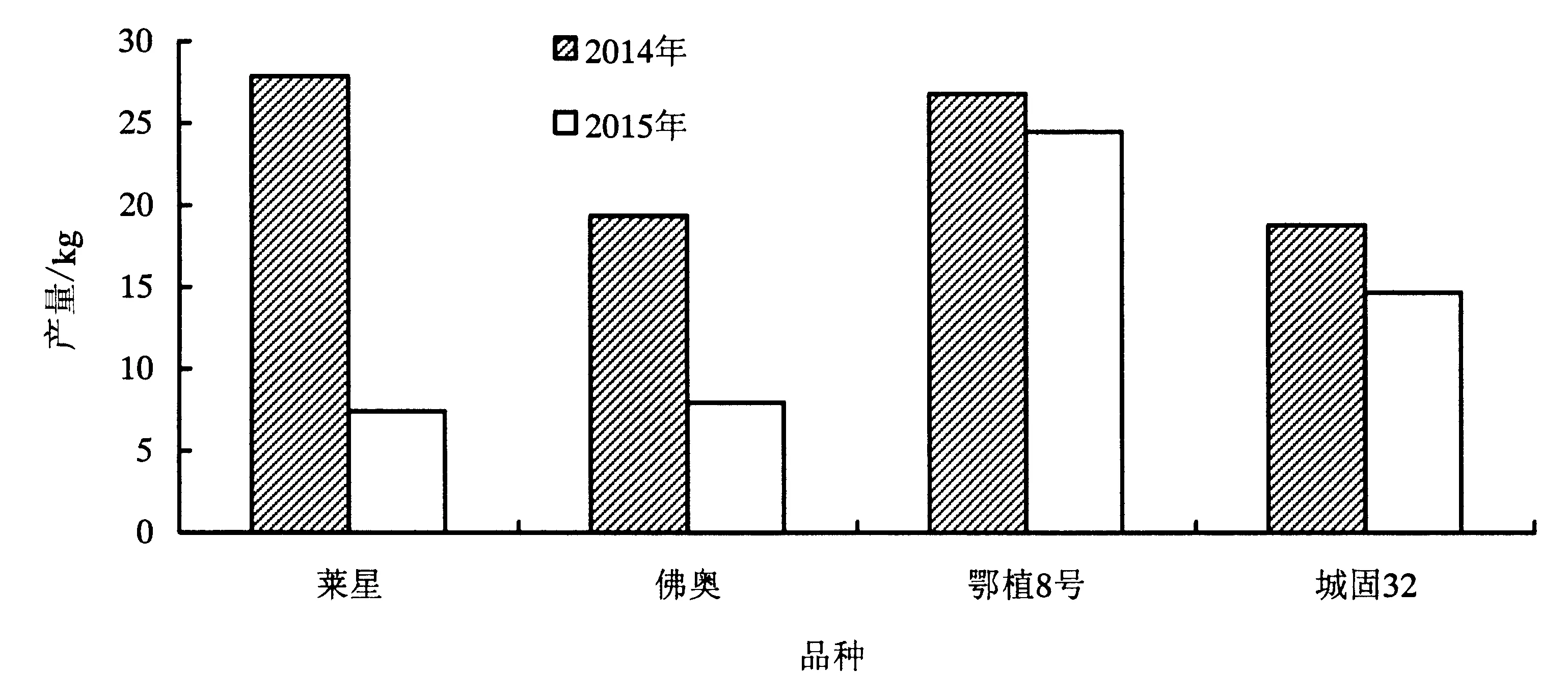
图5 不同品种2014—2015年产量变化Fig.5 Changes of yield in 2014—2015 in four varieties
3 讨论
虽然只有不到2%的被子植物具有雄全同株性系统,但是这种性表达模式格外被研究者所关注[17],认为有限的繁殖资源在雌雄两个功能之间优化分配的一种适应机制.植物的成花是一个非常复杂的过程,所分配到的资源也是通过各内源激素动态平衡或顺序性的变化调运营养物质向生殖器官转运而来的,而许多植物在长期的进化过程中,为了适应生态环境,繁衍后代,其有性繁殖系统通过自身形态建成调控内源激素的变化,从而达到最优化的资源分配,保障其繁殖成功.
在油橄榄花期,GA3对果树成花具有抑制作用,因此在花期3个采样部位GA3都未检出,果树要保持低水平的GA3以防抑制花芽形态建成[18].细胞分裂素(ZRs)、脱落酸(ABA)和生长素(IAA)在花序轴中的含量都高于叶片.3类激素中脱落酸ABA含量水平最高,与促进受精完成后花瓣脱落有关.
依据品种来看,花序轴上分化出一定比例雄花的品种‘鄂植8号’和‘城固32’在3个采样部位都表现出较高的IAA和ZR水平,较低的ABA水平,高水平ZR/IAA和ZR/ABA值促进了雄花分化.连续2年的产量测定可以看出,一定雄花数量分化的品种‘城固32’和‘鄂植8号’表现的更加稳产,而其他2个品种在产量上大小年明显.
结合观察,油橄榄部分品种表现出典型的雄花同株现象,产生雄花比产生两性花需要的资源量更少,避免雌器官败育导致的树体资源浪费,从而提高个体的适合度,这与1982年Bertin提出了最优资源分配假说(optimal resource allocation hypothesis)相一致.从繁殖策略方面来说,一定数量雄花的分化有效节省了树体资源,为第二年花芽分化预留了一定的营养物质,表现的比较稳产,而没有雄花分化的树体资源,在第二年树体资源向性系统分配资源时就表现的捉襟见肘,从而导致产量的大小年波动.
4个品种中‘城固32’和‘鄂植8号’表现出典型的雄全同株现象,‘莱星’和‘佛奥’极少或没有分化雄花,4个品种连续2年的雄花分化比例分别为:‘城固32’ 37.5%±18.91%、31.74%±13.24%,‘鄂植8号’18.73%±8.74%、21.31%±6.66%,‘莱星’0%、0%,‘佛奥’0%、0%.
花期叶片、花序轴内源激素含量,除了GA3没有检出,其他3大类激素在4个品种不同部位样品中的含量都有所不同,其中花序轴中的含量都高于叶片.较高的IAA和ZR水平,较低的ABA水平与促进油橄榄花期雄花分化有关.从激素平衡的角度来看,高水平ZR/IAA和ZR/ABA值促进了雄花分化.
一定数量雄花的分化是植物本身的一种繁殖策略,具有雄全同株现象的品种‘城固32’和‘鄂植8号’表现的更加稳产,而其他2个品种在产量上大小年明显.
[1] 宋子才,华尚铭.华家岭林带考察报告[J].甘肃农大学报,1983(4):53-63.
[2] 邓煜,刘婷,梁芳.中国油橄榄产业发展现状与对策[J].经济林研究,2015,33(2):172-174.
[3] 姜成英,戚登臣,苏瑾,等.甘肃省油橄榄生产现状与发展对策[J].经济林研究,2006,24(2):78-81.
[4] LAVEE S. Biology and physiology of the olive[R]// International Olive Oil Council, 1996. 61-110.
[5] ROSA R, RALLO L, RAPOPORT H F. Olive floral bud growth and starch content during winter rest and spring budbreak[J]. HortScience, 2000,35(7):1 223-1 227.
[6] GEORGIOS C K, IOANNIS T M, MILTIADIS D V. Phenological, morphological and functional indicators of genetic variability and their implication in the sexual reproductive system ofOleaeuropaeaL[J]. Scientia Horticulturae, 2010,123:547-550.
[7] 王海波,赵君全,王孝娣,等.新稍内源激素变化对设施葡萄花芽孕育的影响[J].中国农业科学,2014,47(23):4 695-4 705.
[8] 孙文全,褚孟源.梅树花芽生理分化期木质部液中赤霉素与细胞分裂素的变化[J].园艺学报,1988,15(2):73-76.
[9] 李佳,闫田力,赵善仓,等.葡萄新梢内源激素含量与幼树丰产性能的相关性[J].山东农业科学,2004(6):26-28.
[10] 林玲,黄羽,谢太理,等.3个葡萄品种花芽分化过程中内源激素含量变化初报[J].南方农业学报,2012,43(6):806-809.
[11] 安丽君,金亮,杨春琴,等.外源赤霉素对桃的成花效应及其作用机制[J].中国农业科学,2009,42(2):605-611.
[12] HOAD G V. Hormonal regulation of fruit-bud formation in fruit trees[J]. Flowering and Fruit Set in Fruit Trees, 1983,149(3):13-24.
[13] 朱振家,姜成英,史艳虎,等.油橄榄成花诱导与花芽分化期间侧芽内源激素含量变化[J].林业科学,2015,51(11):32-39.
[14] BERTIN R I. The evolution and maintenance of andromonoecy[J]. Evolutionary Theory,1982,6:25-32.
[15] WILLSON M F. Plant reproductive ecology[M]. New York:John Wiley and Sons, 1983.
[16] SPALIK K. On evolution of andromonnecy and ‘overproduction’ of flowers: a resource allocation model[J].Biological Journal of the Linnean Society, 1991,42:325-336.
[17] LEWIS D. The evolution of sex in flowing plants[J]. Biological Reviews, 1942,17:46-47.
[18] PRANG L, STEPHAN M, SCHNEIDER G, et al. Gibberellin signals originating from apple fruit and their possible involvement in flower induction[J].Acta Hortic.1997,463: 235-241

