泽兰的耐荫性研究
王京伟,张晓飞,崇晓泽,董彦娜,刘冬云
(河北农业大学 园林与旅游学院,河北 保定071000)
随着社会的快速发展,城市中的建筑群越来越多,使得城市绿地约一半都处于荫蔽的环境之中,光照强度弱成为城市绿化植物面临的一大问题[1],而地被植物是城市植物群落的重要组成部分,因此,有针对性地对地被植物开展耐荫性研究,对生态城市的良好建设具有重要的意义。
泽兰(Eupatoriumlindleyanum)为唇形科(Labiatae)地笋属(Eupatorium)多年生草本植物,其茎直立且呈四棱形,叶暗绿色,轮散花序,观赏价值较高。多野生于低洼地或溪流沿岸的灌木丛及草丛、林边等处,在中国东北、华北、华东、西南等地均有分布。目前国内外学者对于泽兰的研究,主要集中在化学成分[2]、中医药理作用[3]、营养成分的测定[4]等方面,但有关光强对泽兰生长、光合特性的影响以及在园林上的应用还未见报道。因此,本试验通过不同的人工遮荫处理对泽兰的形态、生理、光合指标进行测定及分析,旨在确定其耐荫性及适宜的光照范围,为今后推动泽兰的开发和利用,使其在园林植物配置以及药用领域中得到更广泛应用提供依据。
1 材料与方法
1.1 试验地概况
试验在河北农业大学试验田进行,地理坐标为116°48′E,38°65′N,海拔18m。春秋凉爽少雨,夏季炎热多雨,冬季寒冷干燥,属于暖温带亚湿润气候区。年平均气温12.5℃,7月平均最高气温27℃,年均降雨量575.4mm,无霜期198d[5]。
1.2 试验材料
以泽兰3年生苗为材料,于2016年4月下旬进行株行距0.5m×0.5m种植,于当年5月中旬统一进行遮荫处理。遮荫度分别为0%(全光照,对照)、30%、50%、70%、90%。于2016年7月中旬对泽兰的形态指标进行测定,其他各项指标于8月进行测定。
1.3 指标测定方法
形态指标 选取生长势旺盛且一致的植株作为测量样本,用扫描仪扫描叶片,然后用AutoCAD软件测量植物叶片的叶长、叶宽、叶面积。
叶片含水量的测定 采集各处理下同一位置且长势相近的叶片10片,测量其鲜重后,将其放在80°C恒温干燥箱内烘干至恒重,测量得其干重,根据叶片鲜重与干重计算出叶片含水量。
叶绿素含量的测定 采用分光光度计法进行叶绿素含量的测定[6]。将称好的新鲜叶片剪碎放入10mL萃取液(丙酮︰无水乙醇︰水=4.5︰4.5︰1)中黑暗处理24h,待叶片组织变白后,取其上清液于比色皿中,用721型分光光度计于663nm、652nm、646nm和440nm处测定吸光度,依据Lichtenthaler公式计算叶绿素含量:
叶绿素a含量(mg/g)=(12.21×D663-2.81×D646)×V/(1000×W) ①
叶绿素b含量(mg/g)=(20.13×D645-5.03×D663)×V/(1000×W) ②
叶绿素(a+b)含量(mg/g)=D652×V/(34.5×W)③
D663、D652、D646、D440分别为色素提取液在波长663nm、652nm、646nm和440nm处的光密度值,V为浸提液的最终体积(mL),W为叶片鲜重(g)。
可溶性糖含量的测定 采用蒽酮比色法进行可溶性糖含量的测定[7]。
光合特性的测定:利用Li-6400光合仪进行测定。手动设置人工光源光强(PAR)从高到低为2000μmol/(m2·s-1)、1 700μmol/(m2·s-1)、1 400μmol/(m2·s-1)、1200μmol/(m2·s-1)、1 000μmol/(m2·s-1)、800μmol/(m2·s-1)、600μmol/(m2·s-1)、400μmol/(m2·s-1)、200μmol/(m2·s-1)、150μmol/(m2·s-1)、100μmol/(m2·s-1)、50μmol/(m2·s-1)、20μmol/(m2·s-1)、0μmol/(m2·s-1)共14个光强梯度。利用叶子飘[8]设计的光合计算软件对光响应曲线进行拟合。于晴朗天气,对各遮荫处理下的植物叶片(选择长势一致的植株并选取植株主干顶部的叶片)进行不离体的光合日变化测定,时间从800至1800,间隔2h测定1次,每株重复3次,最终分别取所测10株共30次数据的平均值。
1.4 数据分析
使用Excel 2003进行数据统计,利用软件SPSS进行相关性、方差等数学关系的分析,使用叶子飘研发的光合计算软件得到光响应曲线的标准拟合方程。
2 结果与分析
2.1 遮荫对泽兰形态特征的影响
2.1.1 遮荫对泽兰叶形态的影响
遮荫对泽兰叶形态特征的影响见表1。泽兰的叶面积在全光照条件下与其他遮荫处理下差异显著,在遮光率为50%下达到最大值。随着遮荫度的增加,叶长和叶宽均表现出先增加后下降的趋势,且以50%遮荫处理下的最大,此时叶长比对照增加32.99%,叶宽比对照增加42.30%。随着遮荫度的增加,泽兰的比叶重逐渐减小,全光照下与70%、90%遮荫处理下表现出极显著差异水平,在全光照下达到最大值,在90%遮荫处理下达到最小值,比对照减少56.62%。

表1 不同遮荫处理对泽兰叶面积、叶长、叶宽的影响
注:大写字母不同表示同列之间差异极显著(P<0.01)小写字母不同表示同列之间差异显著(P<0.05),下表同。
2.1.2 遮荫对泽兰花期的影响
遮荫对泽兰花期的影响见表2。在全光照下,泽兰开花最早,在50%遮荫环境下花期最长,70%遮荫环境下次之,在遮光率为30%处理下和全光照下花期最短,在遮光率为90%处理下泽兰不开花。

表2 不同遮荫处理对泽兰花期的影响
2.2 遮荫对泽兰叶片生理特性的影响
2.2.1 遮荫对泽兰叶片含水量和相对电导率的影响
不同遮荫处理下泽兰的叶片含水量和相对电导率见表3。随着遮荫度的增加,泽兰叶片的相对含水量和相对电导率均逐渐增加,在90%遮荫处理下达到最大值,相对含水量与对照相比增加5.64%,电导率比全光照增加54.13%。叶片含水量在全光照下和遮光率为90%处理下差异显著,而其他处理均无显著差异。相对电导率在全光照下与70%、90%遮荫处理下表现出极显著差异水平。

表3 不同遮荫处理下泽兰的叶片含水量和相对电导率
2.2.2 遮荫对泽兰叶片叶绿素含量及叶绿素a/b值的影响
遮荫对泽兰叶片叶绿素含量及叶绿素a/b值的影响见表4。

表4 不同遮荫处理下泽兰叶片的叶绿素含量
在不同遮荫处理下,泽兰的叶绿素含量及叶绿素a/b的值表现出了不同的变化。泽兰的叶绿素a含量在70%遮荫条件下时达到最大值,但在遮光率为90%处理下,叶绿素a含量急剧减小。泽兰的叶绿素b含量的变化趋势随遮荫度的增加先上升后下降,变化范围为0.51-0.85mg/g。遮荫处理后,泽兰在30%遮荫处理时叶绿素总量最高,比对照高出30.80%。在遮荫度70%下,叶绿素a/b值为最大值,各处理之间差异不显著。
2.2.3 遮荫对泽兰叶片可溶性糖和可溶性蛋白含量的影响
不同遮荫处理下泽兰的可溶性糖和可溶性蛋白含量见表5。泽兰的可溶性糖和可溶性蛋白含量均随着光强的降低呈现逐渐减小的趋势。可溶性糖含量在遮光率90%时与CK处理差异显著,而各处理之间可溶性蛋白含量无显著差异。
2.3 遮荫对泽兰光合特性的影响
2.3.1 遮荫对泽兰光合日变化的影响
不同遮荫处理下泽兰叶片的光合日变化情况见图1。泽兰的净光合速率日变化在5个遮荫处理下呈现出“单峰”曲线。各处理的净光合速率最大值出现在正午1200时,随后逐渐降低,且随遮荫程度的降低,泽兰的日均光合速率也逐渐降低。在全光照下的峰值和日均光合速率分别是90%遮荫处理的3.7倍和4.0倍。

表5 不同遮荫处理下泽兰的可溶性糖和可溶性蛋白含量

图1不同遮荫对泽兰叶片光合日变化的影响
Fig.1 Effects of different shading on the light response curve ofEupatoriumlindleyanumleaves
随着遮荫度的增加,泽兰全天的胞间CO2浓度都有所下降,总的来看遮光率90%<遮光率70%<遮光率50%<遮光率30%<全光照,且在不同遮荫处理下都在1200时达到谷值。
2.3.2 遮荫对泽兰叶片光响应曲线的影响
由图2可知,不同强度遮荫环境下的泽兰的光响应曲线均呈抛物线型。泽兰的净光合速率随光合有效辐射的变化包括3个阶段:在光强小于600μmol/m2·s-1时各遮荫处理下的净光合速率均随着光合有小辐射的增强而快速上升,Pn几乎呈直线上升;在光强介于600μmol/m2·s-1和各自的光饱和点时,净光合速率增加逐渐变缓,当光合效辐射达到各自的光饱和点后,净光合速率的值达到最大,之后当光合有效辐射继续增加,净光合速率稍有下降的趋势。
由表6可知,遮荫对泽兰的光饱和点、光补偿点以及暗呼吸速率均有较为显著的影响(P<0.05),各指标均呈现出随遮荫度的增加而依次减小的趋势。表观量子效率越大,表明植物对弱光的利用能力越强,随着遮荫度的增加,泽兰的表观量子效率呈现出先增加后减小的趋势,且在90%遮荫处理下达到最小值,与对照相比降低19.03%。

图2 遮荫对光响应曲线的影响
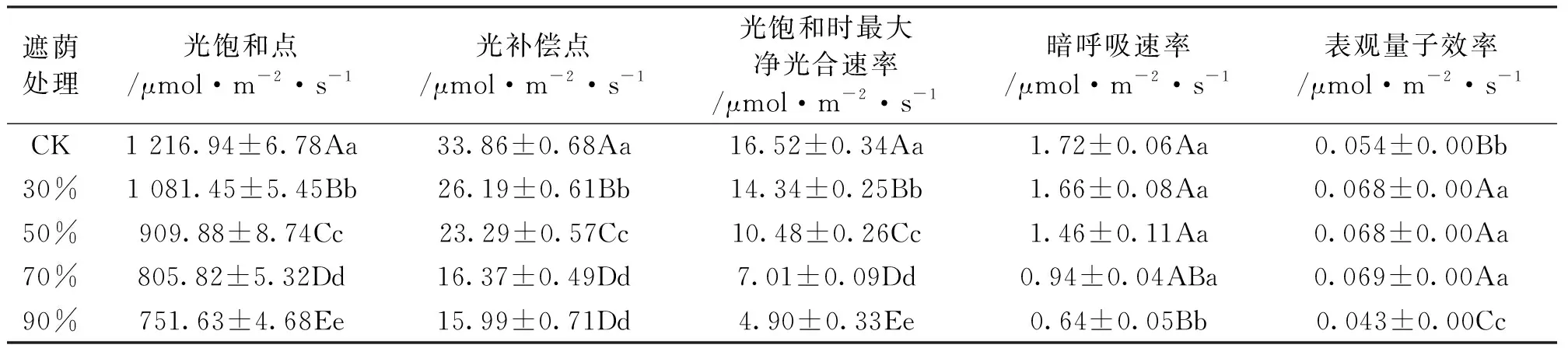
遮荫处理光饱和点/μmol·m-2·s-1光补偿点/μmol·m-2·s-1光饱和时最大净光合速率/μmol·m-2·s-1暗呼吸速率/μmol·m-2·s-1表观量子效率/μmol·m-2·s-1CK1 216.94±6.78Aa33.86±0.68Aa16.52±0.34Aa1.72±0.06Aa0.054±0.00Bb30%1 081.45±5.45Bb26.19±0.61Bb14.34±0.25Bb1.66±0.08Aa0.068±0.00Aa50%909.88±8.74Cc23.29±0.57Cc10.48±0.26Cc1.46±0.11Aa0.068±0.00Aa70%805.82±5.32Dd16.37±0.49Dd7.01±0.09Dd0.94±0.04ABa0.069±0.00Aa90%751.63±4.68Ee15.99±0.71Dd4.90±0.33Ee0.64±0.05Bb0.043±0.00Cc
3 结论与讨论
有研究表明,在中等遮荫条件下,耐荫植物的叶片会变大,喜光植物则相反;在强度遮荫条件下,植物的叶片均会变小[9-10]。本试验以优良的地被植物泽兰为试验材料对其耐荫性进行研究后可知,遮荫对泽兰的形态特征有显著影响,叶长、叶宽、叶面积均随遮荫度的增加呈现出先增大后减小的趋势,均在50%遮荫条件下达到最大值,说明植物为了适应新的光环境会在叶片形态上进行自身的调节变化[11]。随着遮荫度的增加,泽兰进入开花期的时间延长,叶片的相对含水量和相对电导率均逐渐增加,在90%遮荫处理下达到最大值。分析出现这种情况的原因可能是,随着遮荫度的增加,植物的蒸腾速率相对减弱。
植物进行光合作用的主要色素就是叶绿素,其也是光敏催化剂,同时反映植物的光合作用能力[12]。植物为了适应不同的光环境,叶绿素的含量会随着光照环境的不同发生变化,因此叶绿素含量和叶绿素a/b值是衡量植物耐荫程度的重要指标。对植物进行遮荫处理后,泽兰在30%遮荫处理时叶绿素总量最高,在50%和70%遮荫处理时,叶绿素含量也有所增加,在遮荫度70%下,叶绿素a/b值为最大值,各处理之间差异不显著。这说明遮荫有利于泽兰叶片光合作用的增强。
植物进行光合作用,主要是为了生成能够提供自身生长的养分,其中可溶性糖便是光合作用的重要产物,植物在弱光条件下,光合效率降低,叶片合成碳水化合物的能力下降,因此可溶性糖含量能反映植物在低光照下的适应能力[13]。泽兰的可溶性糖和可溶性蛋白含量均随着光强的降低呈现逐渐减小的趋势。可溶性糖含量在遮光率90%时与其他处理差异显著,而各处理之间可溶性蛋白含量无显著差异。可以得出遮荫对泽兰的叶片可溶性糖含量产生了一定的影响,从而影响其光合作用。这与Krasnuk等[14]的研究结果一致。泽兰的可溶性蛋白含量随着遮荫度的增加而降低。
光补偿点、光饱和点以及暗呼吸速率等指标是衡量植物光合能力强弱的重要指标[15-16]。一般情况下,耐荫能力较强的植物具有较低的光补偿点以及较低的暗呼吸速率,原因是植物在弱光条件中,植物为保证自身最大限度的积累有机物,来保持正常的生命活动,所以会降低光补偿点来提高植物利用弱光的能力,同时也要相应地降低呼吸速率,减少有机物的消耗[17-18]。泽兰的净光合速率日变化和气孔导度日变化在各遮荫处理下均呈现出“单峰”曲线,随着光强逐渐减弱,蒸腾速率、日均气孔导度和胞间CO2浓度也逐渐降低。对光合特性的影响主要表现在随遮荫度的增加,光饱和点、光补偿点、暗呼吸速率明显降低,从而保证了自身最大限度的积累有机物,保持正常的生命活动。这与李金鹏和李彪等[19-20]的研究结果一致。
综上所述,泽兰具有一定的适应弱光环境的能力,在遮荫度为30%-70%时,植株生长良好,在50%遮荫下观赏效果较佳。但遮荫度过大,会抑制植物的生长,所以在园林中,可将其配置在疏林下应用。
植物间耐荫性的比较研究对于城市绿化植物的选择具有一定的指导意义,但是现代城市园林绿化的条件非常复杂,同一种植物由于造景的需要可能要用于不同的光照环境中,所以应对具体的植物在不同的光照环境下其形态特征的变化以及其适应性表现即耐荫程度有所研究。
参考文献:
[1] 曾小平,赵平,蔡锡安,等.25种南亚热带植物耐荫性的初步研究[J].北京林业大学学报,2006,28(4):88-95.
[2] 许冰.泽兰与佩兰化学成分研究[D].大连:辽宁师范大学,2003.
[3] 王琼.泽兰和丹参中凝血因子Xa抑制成分的研究[D].南京:南京中医药大学,2013.
[4] 刘娜.泽兰中营养成分的测定及其三萜酸的分离纯化的研究[D].重庆:西南大学,2016.
[5] 杨露,于晓跃,刘煜光,等.遮荫对2种彩叶风箱果叶色及光合特性的影响[J].河北农业大学学报,2016,9(5):75-81.
[6] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:135.
[7] 陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2006.
[8] 叶子飘.光合作用对光和CO2响应模型的研究进展[J].植物生态学报,2010,34(6):727-740.
[9] 尹慧,安莹,陈雅君,等.不同遮荫强度下白三叶形态特征和生长动态[J].中国草地学报,2015,37(5):86-91.
[10] Blackman G E.Influence of light and temperature leaf growth[M].London:Milthorpe F L,1956:151-152.
[11] 刘菲.遮荫对11种园林植物形态及光合生理特性的影响[D].武汉:华中农业大学,2011.
[12] 赵明水,刘欣欣,张明如.浙西北15个树种叶片叶绿素含量分析[J].浙江林业科技,2014,34(2):49-52.
[13] 杨东海.七种常用园林植物耐荫性的研究[D].长春:吉林农业大学,2011.
[14] Krasnuk M,Jung G A,Witham F H.Electrophoretic studies of the relationship of peroxidases,polyphenol oxidayse,and indole acetic acid oxidase to cold tolerance of alfalfa[J].Cryobiology,1975,12(1):62-80.
[15] 王建华,任士福,史宝胜,等.遮荫对连翘光合特性和叶绿素荧光参数的影响[J].生态学报,2001,31(7):1811-1817.
[16] 汤飞洋,金荷仙,唐宇力,等.4个杜鹃品种的光合特性比较[J].广东园林,2015(6):20-25.
[17] 李炎林,桂克印,唐前瑞,等.地被植物耐荫性研究进展[J].现代园艺,2008(5):4-5.
[18] 朱延姝,樊金娟,冯辉.弱光胁迫对不同生育期番茄光合特性的影响[J].应用生态学报,2010,21(12):3141-3146.
[19] 李金鹏,赵和祥,董然,等.光照强度对两种玉簪生长及光合特性的影响[J].南京林业大学学报(自然科学版),2012,36(4):57-61.
[20] 李彪,黄永韬,黄永芳,等.遮荫对烈香茶花光合作用参数日变化的影响[J].广东林业科技,2013,29(3):49-52.

