福贡龙竹种子无菌诱导植株再生及快速繁殖
呼延丽,毕玮,李灿雯,李丹,王娟,王毅,2,王四海,杨宇明
(1.云南省林业科学院,云南 昆明 650201;2.国家林业局重点开放性实验室云南珍稀濒特森林植物保护和繁育实验室,云南省森林植物培育与开发利用重点实验室,云南 昆明 650201)
福贡龙竹(Dendrocalamsfugongensis),又名马跨(福贡傈僳语),系禾本科(Gramineae)竹亚科(Bambusoideae)牡竹属(Dendrocalamus)大中型合轴丛生竹,产自云南福贡、维西等地,生于海拔1200m-1 800m的河谷地区[1]。福贡龙竹秆光滑,生长快速,姿态优美,具有较高观赏价值。福贡龙竹是怒江河谷地区的重要经济竹种,既是良好的笋用竹,也是优质的材用竹[2-3],其开发前景广阔。
竹类是一次性开花植物,开花周期长而不稳定,开花后可能结实也可能不结实,但都将死亡。因此,人们还不能对竹类植物进行有规律的稳定的有性繁殖[4]。竹类植物的组培快繁技术一直是竹类研究领域的热点和难点,导致很多基于组培技术的深入研究如转基因、体细胞杂交育种技术等研究目前尚无法在大多数竹种中开展,并极大阻碍竹类植物大规模的引种和推广[5]。目前尚未见到国内外关于福贡龙竹良种选育和组织培养的研究报道。因此,本试验以福贡龙竹种子为原始外植体,无菌诱导其植株再生,率先建立福贡龙竹的离体快繁体系,旨在短期内为种质资源的保存及工厂化育苗提供工作基础,同时为进一步抗性研究、遗传改良、生理生化特性研究等提供理论参考。
1 材料与方法
1.1 试验材料
供试材料采自云南省怒江州福贡县,为2014年11月收获的福贡龙竹种子。
1.2 方法
1.2.1 培养基和培养条件
以MS为基本培养基,加入不同浓度的植物生长调节剂。均添加3%蔗糖,0.5%-0.7%琼脂或卡拉胶,抗坏血酸100mg/L或活性炭0.5g/L,调整pH值的范围在5.8±0.2。培养温度为(26±2)℃,光照度为30-50μmol/m2·s-1,光照时间为12h/d。灭菌温度为121℃,灭菌时间25min。
1.2.2 种子消毒与预处理
挑选色泽鲜亮、颗粒饱满、无病虫害的种子,剥掉种壳。自来水冲洗3min,去除种子附属器即种尖长花柱一端较多的茸毛。再浸泡于20%漂白剂(甲A bleach)且振荡10min后无菌水冲洗3遍,放入超净台。
1.2.3 无菌系的建立和初代培养
在超净台内,将处理好的种子先用75%酒精消毒60s,再浸入0.1%的HgCl2溶液。HgCl2溶液消毒时间设置10min、20min、30min、40min、50min、60min 6个时间梯度,即6个处理(表1)。每个处理接种40粒为1个重复,共3个重复,即每个处理接种120粒种子。消毒过程中需用镊子不断搅动,充分灭菌,待消毒完毕,从HgCl2溶液取出后用无菌水冲洗5遍,并用无菌滤纸吸干水分,分别接种于初代培养基MS上,放置于培养室,14d后开始统计萌芽和污染状况,其余既不萌芽也没污染的死胚不作统计。萌发率=(无污染萌芽的胚数/每个处理接种的总胚数)×100%,污染率=(污染外植体数/每个处理接种的总胚数)×100%,30d后观察记录种胚萌发和幼芽生长状况。
1.2.4 诱导丛生芽
种子萌发长出单株无菌幼苗,苗高2-3cm时,则剪去芽顶部分,剩1-1.5cm到生长点,根也应尽量剪除,转接到诱导丛芽培养基中,诱导丛生芽培养基配方为MS+6-BA+IBA+KT,其中6-BA浓度为1mg/L和2mg/L,IBA浓度为0.5mg/L和1mg/L,KT浓度为0.2mg/L和0.4mg/L,组合成8个处理(表2)。每个处理接种10瓶为1个重复,每瓶接种1个外植体,共3个重复,即每个处理接种30株苗。30d后统计丛生芽的诱导率、丛生芽数量和生长情况,从而筛选出最适合诱导丛生芽的植物生长调节剂的配比。丛生芽诱导率=(发丛芽的株数/总接种株数)×100%。
1.2.5 继代增殖培养
诱导丛生芽发生后,需转接到增殖培养基进行多次继代增殖。把幼嫩丛生芽分株成3-9个芽为一丛,接到增殖培养基中进行壮苗,每30-60d继代一次。增殖培养基配方为MS+6-BA+NAA,其中6-BA浓度为2mg/L、3mg/L和4mg/L,NAA浓度为0.1mg/L、0.2mg/L、0.3mg/L,组合成9个处理(表3)。每个处理接种10瓶为1个重复,每瓶3个丛芽,共3个重复,即每个处理接种30瓶,90个丛芽。60d后观察统计其增殖率和生长情况,筛选最优丛生芽增殖培养基。
1.2.6 生根培养
以3-5个苗丛为一组,切取生长健壮,高5cm左右的苗丛接种到生根培养基中,转入添加不同浓度IBA和NAA的MS培养基进行生根培养。每个处理接种30瓶,每瓶1个单株,重复3次。培养7-10d可长出根点和须根,30d后统计生根数和生根率,并观察苗丛的生长情况。生根率=(生根的外植体数/接种的外植体总数)×100%。由于考虑下一步组培苗移栽的成活率,故不等到根系发育完全便打开封口膜炼苗。
1.2.7 炼苗移栽
经生根培养,挑选出生根整齐、生长健壮,苗高约5-7cm的植株进行炼苗。首先,将培养瓶移到大棚内放置1周,大棚内有覆盖遮光率为50%的遮阳网,温度控制在15-30℃,湿度为60%-70%。1周后揭开瓶盖,每隔3-5h向瓶内喷雾状水1次,且浇1层水,覆盖1层薄膜保湿,保证80%以上相对湿度的小环境。持续4d左右,将苗取出,流水洗净根上的培养基,移栽到预备好的2种基质中,即基质1(红壤︰河砂︰腐殖土︰珍珠岩=2︰1︰1︰1)和基质2(红壤︰河砂︰腐殖土=2︰1︰2)2个处理。基质均用0.2%的高锰酸钾溶液拌土消毒备用。每个处理移栽30株,共3个重复。移栽时,小苗根部先用1‰的多菌灵溶液浸泡10min,移栽后立即用1‰的多菌灵水溶液作定根水,喷洒至基质浸透,用无纺布遮盖保温保湿。
1.3 数据统计
数据分析采用SPSS 16.0软件,方差分析中两两均数比较采用S-N-K法。
2 结果与分析
2.1 外植体灭菌效果和初代培养
福贡龙竹种皮难剥离,种子两端有皱褶且被茸毛,不易消毒,对其进行预处理是控制污染行之有效的前提。把种子先用75%酒精消毒60s后,再浸入0.1%的HgCl2溶液,进行不同消毒时间处理,见表1。
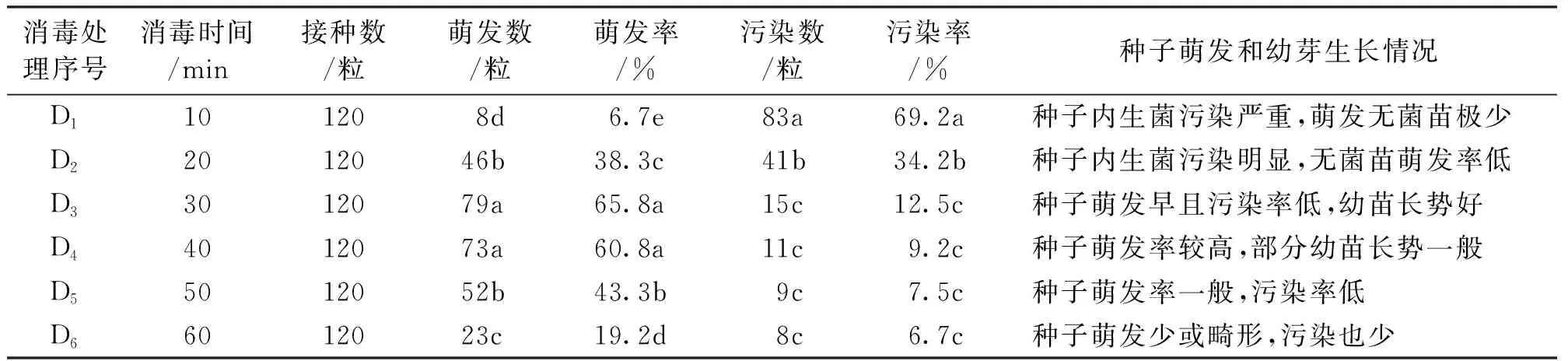
表1 不同消毒时间的灭菌效果
注:表中不同小写字母表示差异显著(P<0.05)。下同。
由表1可见,随着消毒时间的增加,污染控制越好,但时间过长,易对种子造成伤害,导致幼芽畸形或死亡。种子浸入0.1%的HgCl2溶液30-40min后接种为宜,既能保持种子生活力又可控制污染率在10%左右。因此,D3号处理的消毒效果最为理想(图1-A),种子萌发早,接种后5-14d,可萌芽产生小植株,且萌发率达65.8%。
2.2 筛选诱导丛生芽的培养基
初代培养中种子萌发长出的单株无菌幼苗,应及时转接到诱导丛生芽的培养基。约两周茎段基部开始分化芽丛,培养30d后芽苗长势差异明显,可形成3-7个芽的丛生芽,见表2。从试验结果看,6-BA在诱导福贡龙竹丛生芽的分化过程中起着主导作用。在8组诱导形成丛生芽的培养基中,丛生芽诱导率差异不大,各培养基对诱导丛生芽的影响主要表现在成丛时间、繁殖倍数、长势方面的差异。综合来看,适合诱导福贡龙竹丛生芽的最佳培养基为F5(图1-B):MS+6-BA 2mg/L +IBA 0.5mg/L +KT 0.2mg/L。

图1 福贡龙竹的组织培养再生过程
注:A为刚萌发的无菌幼芽,B为单个芽尖培养诱导形成丛生芽,C为丛生芽的继代增殖培养,D为丛生芽诱导生根,E为炼苗4d的组培苗,F为移栽90d后的幼苗

Fig.1 Regeneration process of D.fugongensis
2.3 丛生芽继代增殖培养基的筛选
诱导出丛生芽后应及时分株,转接到增殖培养基中。一般培养20d后,丛生芽基部可再分化出新的芽丛。经3-5次继代增殖培养,可扩繁成9-20个芽的丛生芽。培养60d后统计丛生芽在各培养基的增殖状况,结果见表3。不同6-BA浓度对福贡龙竹增殖培养的效果不同,6-BA浓度较低时,增殖效果不明显;随着6-BA浓度的增加,组培苗分化的不定芽明显增加,当6-BA浓度高达4mg/L时增殖倍数最高,但芽丛密集,叶片扭曲呈水草状;当6-BA浓度为3mg/L时增殖倍数高且苗生长最健壮。因此,筛选出最优增殖培养基为P5(图1-C):MS+6-BA 3mg/L+NAA 0.2mg/L。

表3 植物生长调节剂对福贡龙竹丛生芽继代增殖的影响
2.4 生根培养基的筛选
丛生芽接种于生根培养基后,14d左右开始产生不定根,苗丛基部长出白色根尖,之后迅速伸长,30d形成良好根系。丛生芽在不添加IBA或NAA的培养基中无法生根,其在添加IBA或NAA的培养基中均能100%生根,差异在于发根的快慢和根系生长状况,见表4。
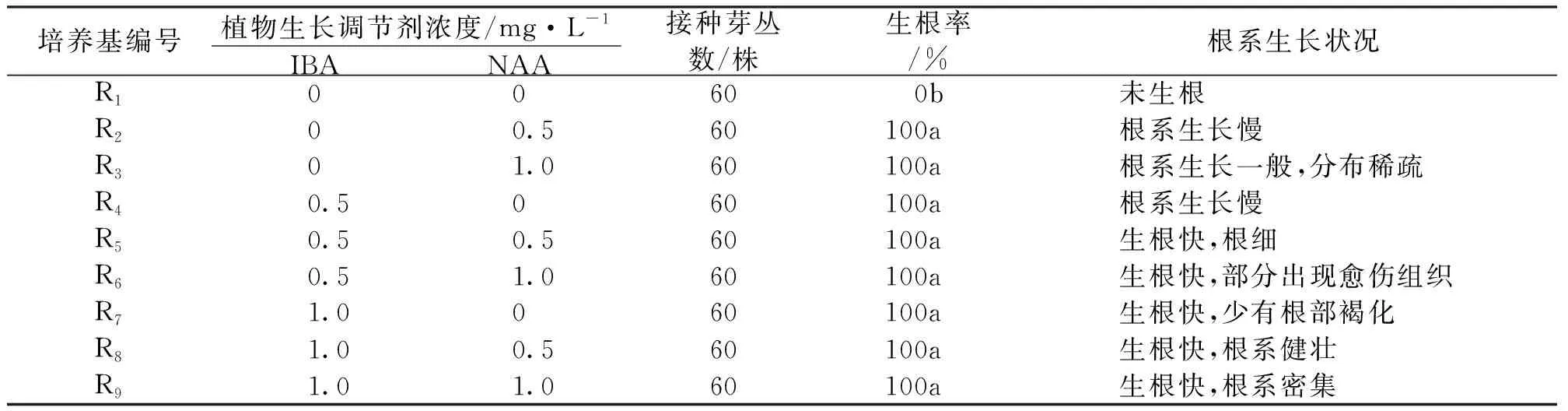
表4 植物生长调节剂对福贡龙竹生根的影响
故从整体比较而言,福贡龙竹丛生芽生根的最优培养基为R8(图1-D),MS+IBA 1mg/L +NAA 0.5mg/L。
2.5 炼苗与移栽
将180瓶组培苗揭盖,先置于室内炼苗1周后可清洗处理(图1-E),然后移栽到已经备好的基质中,移栽初期尤其要控制好小环境温度18-30℃,需常喷雾状水,保持相对湿度70%-85%。移栽1个月左右有新叶抽出,移栽3个月后苗高可达20cm(图1-F),见表5。3个月后统计成活率达81.1%。

表5 不同移栽基质对组培苗生长的影响
3 结论与讨论
以福贡龙竹种子的组培快繁技术研究结果表明,用75%酒精消毒60s,再用0.1%的HgCl2溶液消毒30min的效果最好;适宜诱导形成丛生芽的培养基为MS+6-BA 2mg/L+IBA 0.5mg/L+KT 0.2mg/L;最佳继代增殖培养基为MS+6-BA 3mg/L+NAA 0.2mg/L;以MS+IBA 1mg/L+NAA 0.5mg/L为最佳生根培养基;将生根组培苗炼苗移栽,90d后成活率达81%以上。
无菌材料的获得是建立无菌体系的关键前提[6]。福贡龙竹种尖长花柱一端密布茸毛,灭菌操作较困难,故应尽量清洗去除种子附属器,加之采用75%酒精消毒60s和0.1%HgCl2溶液消毒30min对外植体表面消毒处理,获得比较好的灭菌效果,同时也保证了种子正常萌发。继代增殖过程中,偶有丛生芽内生菌污染现象[7]。随着继代次数的增加,菌量积累后才显现出来,对于内生菌污染问题,目前采取的措施是剔除被污染的丛生芽,今后将考虑加入抗生素、生物活性物质等加以防治。
植物激素和植物生长调节物质在组织培养中起着至关重要的作用[8]。细胞分裂素在诱导丛生芽形成及增殖过程中作用明显,当6-BA和KT浓度过高时,甚至出现不同程度的玻璃化丛生芽,苗一旦出现玻璃化,只能丢弃。不同原因为何均导致木质素合成受阻是研究植物玻璃化的核心问题[9]。要克服玻璃化现象,有待进一步研究。
褐变在植物组织培养过程中普遍存在,尤以木本植物组织培养中褐变明显[10]。福贡龙竹褐化的现象在不同基因型间差异显著,且会随着继代时间的增长而加重。因此,以褐化较严重的植物材料为研究对象,设法建立无其他因素干扰的组培体系,对于研究植物褐化的发生及作用机制很有必要[11]。
参考文献:
[1] 耿平介,王正平.中国植物志:第九卷,第一分册[M].北京:科学出版社,1996:158-160.
[2] 孙必兴,李德铢,薛纪如.云南植物志:第九卷[M].北京:科学出版社,2003:39-41.
[3] 孙茂盛,鄢波,徐田,等.竹类植物资源与利用[M].北京:科学出版社,2015.
[4] 王娟,毕玮,普晓兰,等.小叶龙竹愈伤组织诱导及植株再生[J].植物生理学报,2012,48(4):359-363.
[5] 王曙光,丁雨龙,林树燕,等.慈竹组织培养消毒方法筛选及丛芽诱导研究[J].西部林业科学,2013,42(1):38-41.
[6] 蔡月琴,陆銮眉,黄志丹,等.火焰树的组织培养与快速繁殖[J].植物生理学报,2015,51(5):709-714.
[7] 吴玲利,柯镔峰,龚春,等.白木通组织培养与快速繁殖[J].植物生理学报,2015,51(6):903-908.
[8] 李浚明,朱登云.植物组织培养[M].北京:中国农业大学出版社,2008.
[9] 黄烈健,王鸿.林木植物组织培养及存在问题的研究进展[J].林业科学研究,2016,29(3):464-470.
[10] 陈正华.木本植物组织培养及其应用[M].北京:高等教育出版社,1986.
[11] 冯代弟,王燕,陈剑平.植物组培褐化发生机制的研究进展[J].浙江农业学报,2015,27(6):1108-1116.

