基因多态性、饮酒种类与乙醇代谢的相关性
(四川大学华西基础医学与法医学院,四川 成都 610041)
在法医学实践中,许多案(事)件都需要测定活体或尸体血液中的乙醇含量。当案发时间和采样时间存在时间差时,还需对案发当时的血乙醇含量进行回推[1],从而合理地解释乙醇对机体的影响。因此,系统了解乙醇在体内代谢过程及其影响因素对法医学实践中乙醇检测结果的解释和评价有重要意义。
乙醇进入体内后,主要通过乙醇脱氢酶(alcohol dehydrogenase,ADH)和乙醛脱氢酶(aldehyde dehydrogenase,ALDH)参与的氧化途径进行代谢[2]。ADH和ALDH对应的基因编码区存在单核苷酸多态性(SNP)位点,会引起对应酶结构和功能的变化,影响乙醇体内代谢。ADH1B*2/*2(rs1229984)纯合子对应的酶活性是ADH1B*1/*1纯合子个体的40倍,催化乙醇快速氧化为乙醛;ADH1C*1(rs698)所编码的酶氧化乙醇的能力是ADH1C*2所编码的酶的2.5倍[3];ALDH2*2(rs671)编码的亚基,影响ALDH2四聚体结构的稳定性,导致酶活性显著降低,乙醛在体内蓄积[4]。
中国汉族人群中约33%的个体携带一个ALDH2*2等位基因,84%~92%携带一个ADH1B*2等位基因,83%是ADH1C*1/*1纯合子[5]。在前期ALDH2对乙醇代谢影响研究[6]的基础上,本研究提高饮酒剂量,增加样本量,探讨ADH1B和ALDH2的基因多态性及饮酒种类对乙醇代谢的影响,为司法鉴定实践中涉及乙醇代谢结果解释或乙醇含量回推的案件提供科学依据。
1 材料与方法
1.1 实验对象
本研究志愿者均为四川大学在校学生,汉族,常规体检正常,告知试验流程后,签署知情同意书,填写《明尼苏达多相人格测验》(399版本)、《乙醇使用障碍筛查量表》[7]和《密西根乙醇依赖调查表》,根据评分值,提示存在精神障碍和乙醇依赖问题的,不纳入本次研究。本研究由四川大学伦理委员会批准。
本研究共筛选出81名合格志愿者,其中男性60名,女性 21名,平均年龄为(22.4±2.4)岁,平均身高为(170.2±7.0)cm,平均体质量为(62.4±11.2)kg,平均体质量指数(body mass index,BMI)为(21.4±3.0)kg/m2。
1.2 基因型测定
采集志愿者肘静脉血2mL,用QIAamp DNA Investigator试剂盒(德国QIAGEN公司)提取总DNA。在已报道的ADH1B和ALDH2的多重SNaPshot分型方法[8]基础上,修改ADH1B和ALDH2的延伸引物,加入ADH1C扩增和延伸引物,采用PRISM®SNaP-shotTMMultiplex试剂盒(美国AB公司)建立同时检测ADH1B、ADH1C和ALDH2基因上3个SNP位点(rs1229984、rs698 和 rs671)的多重 SNaPshot分型方法,具体步骤参照试剂盒说明书。
1.3 饮酒实验
实验前一周禁酒,志愿者在医护人员监护下进行饮酒实验,实验用酒为泸州老窖特曲(52度),剂量为1.0g/kg,在30min内匀速饮完,伴食花生。在饮酒前以及饮酒后 30min、45min、1h、1.5h、2h、3h、4h、5h、6 h、7 h和8 h经留置针静脉采血1 mL。通过本实验室建立的顶空气相色谱法[6]检测血中乙醇和乙醛的浓度。同时,记录各时间点志愿者脸红、心悸等不适情况。
本研究还考察了饮酒种类对乙醇代谢的影响,在81名志愿者中选取10名ADH1B、ADH1C和ALDH2基因型均相同的个体开展3次饮酒实验,实验用酒分别为泸州老窖特曲(52度)、青岛啤酒(4.3度)、守望堡赤霞珠红葡萄酒(14.5度),实验过程同上,剂量为0.8g/kg,每次实验间隔1个月。
1.4 数据处理
依据检测所得各时间点血中乙醇和乙醛的浓度,获得乙醇达峰时间(Tmax,单位:h)、乙醇峰值质量浓度(Cmax,单位:mg/dL)数据;计算乙醇曲线下面积(area under curve,AUC乙醇,单位:mg·h/dL)和 AUC乙醛(单位:μmol·h/L);运用最小二乘法对血乙醇消除相进行线性拟合,获得乙醇消除斜率(β)[9-10]和线性相关系数(r)。
根据基因型将志愿者分组,描绘各组的血药浓度-时间曲线(简称“药时曲线”),统计各组 Tmax、Cmax、AUC乙醇、AUC乙醛和 β 数据,以±s表示。 采用 SPSS 21.0软件对各组的上述参数进行单因素方差分析(one-way ANOVA),并运用最小显著差异法(least significant difference,LSD)进行组间比较。不同基因间的相互作用关系采用双因素方差分析(two-way ANOVA)。对3种饮酒种类组间的各参数进行随机区组设计方差分析。检验水准α=0.05。
2 结果和讨论
2.1 乙醇消除斜率的分布
本研究81名志愿者累计进行饮酒实验111次。结果显示,血乙醇达最大质量浓度后,部分出现一段平台期,大部分则很快进入消除期,血乙醇质量浓度呈线性下降,r值为-0.9917±0.0081。因此,根据线性回归关系回推乙醇质量浓度是合理的。
本研究中111次乙醇消除斜率绝对值的区间分布见图1,最小绝对值为6.2181mg·h/dL,最大绝对值为 26.654mg·h/dL,平均绝对值为 13.828mg·h/dL,与卓先义等[1]报道的中国汉族人群乙醇消除斜率的平均绝对值(13.6mg·h/dL)基本一致。对于大部分志愿者的药时曲线,在血乙醇质量浓度低于20mg/dL后,血乙醇转为指数曲线消除。
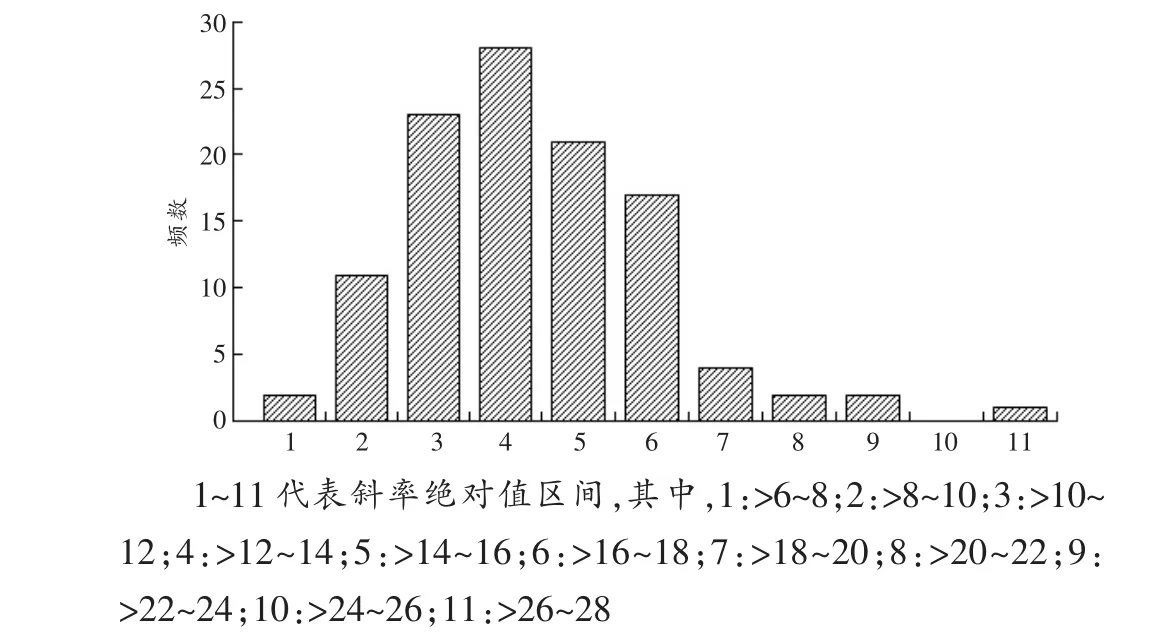
图1 血液中乙醇消除斜率绝对值的区间分布
2.2 基因型分组及对应的药时曲线
通过本研究建立的多重SNaPshot方法,成功获得81名志愿者ADH1B、ADH1C和ALDH2的分型结果。因本研究着重关注ADH1B和ALDH2基因多态性对乙醇代谢的影响,为排除ADH1C基因多态性的干扰,从志愿者中筛选出携带ADH1C*1/*1纯合子的个体,共71人。然后,根据ADH1B和ALDH2的基因型将志愿者分为4组:ALDH2*1/*1-ADH1B*1/*2,16 人;ALDH2*1/*1-ADH1B*2/*2,24 人;ALDH2*1/*2-ADH1B*1/*2,12 人;ALDH2*1/*2-ADH1B*2/*2,13 人;剩余6人因基因型人数较少,未单独分组讨论。各基因型组血中乙醇、乙醛平均药时曲线分别见图2。
2.3 基因多态性对乙醇代谢的影响
各基因型组 Tmax、Cmax、AUC乙醇、β 和 AUC乙醛比较结果见表1。结果显示,不同基因型组间Tmax和Cmax值差异无统计学意义。在ALDH2*1/*2基因型个体中,ADH1B*2/*2组 AUC乙醇值低于 ADH1B*1/*2组(P〈0.05);在 ALDH2*1/*1基因型个体中,ADH1B*2/*2组β 绝对值高于 ADH1B*1/*2 组(P〈0.05);在 ADH1B*2/*2基因型个体中,ALDH2*1/*1组β绝对值高于ALDH2*1/*2组(P〈0.05)。 在两种 ADH1B 基因型个体中,ALDH2*1/*2组AUC乙醛值均高于ALDH2*1/*1组(P〈0.05)。双因素方差分析结果显示,ADH1B基因与AUC乙醇有关,而 ALDH2基因与 AUC乙醛有关,且两基因在AUC乙醇和AUC乙醛上无交互作用(表2)。
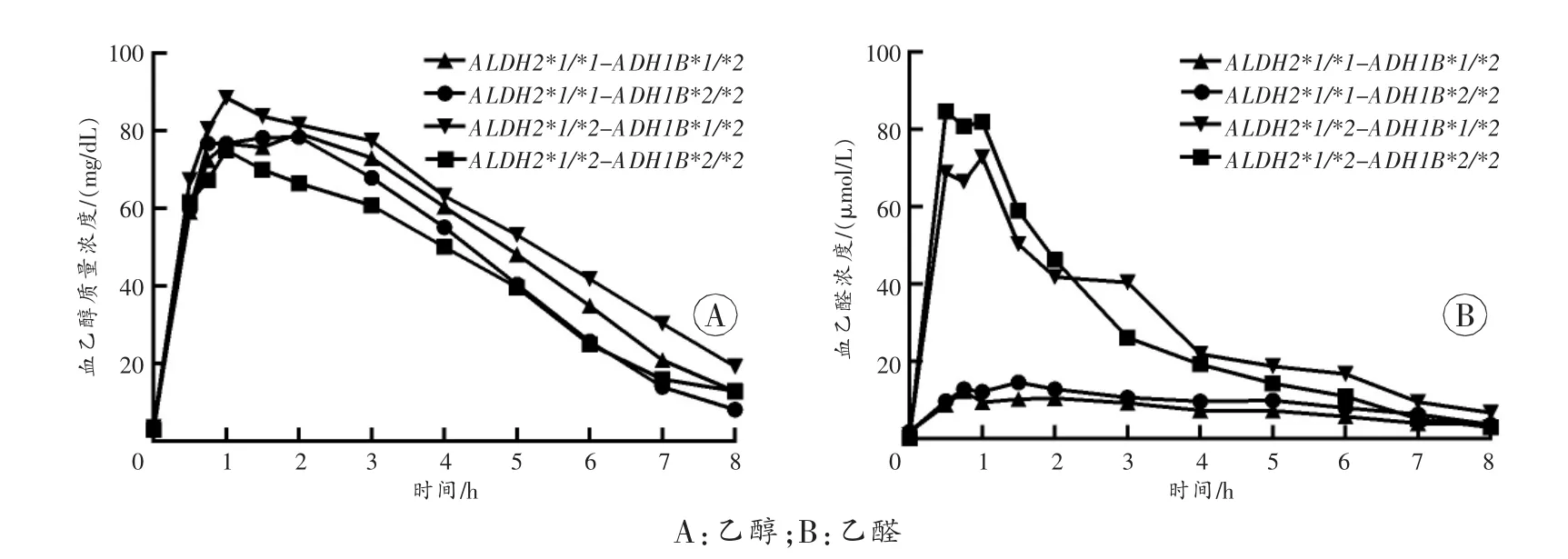
图2 各基因型组血乙醇和乙醛的平均药时曲线
表1 不同基因型组 Tmax、Cmax、AUC乙醇、β 和 AUC乙醛比较结果 (±s)

表1 不同基因型组 Tmax、Cmax、AUC乙醇、β 和 AUC乙醛比较结果 (±s)
注:1)与 ALDH2*1/*2-ADH1B*1/*2 比较,P〈0.05;2)与 ALDH2*1/*1-ADH1B*1/*2 比较,P〈0.05;3)与 ALDH2*1/*1-ADH1B*2/*2比较,P〈0.05
ALDH2*1/*2-ADH1B*2/*2(n=13)Tmax/h 1.45±0.65 1.61±0.84 1.15±0.64 1.40±0.69 Cmax/(mg·dL-1) 88.41±27.40 88.59±24.40 94.00±23.20 78.33±14.55 AUC乙醇/(mg·h·dL-1) 408.60±101.79 381.80±98.06 443.38±143.63 339.91±100.321)β-12.51±2.92 -14.92±3.262) -12.30±2.85 -12.08±2.673)AUC乙醛/(μmol·h·L-1) 43.31±28.06 50.22±58.22 226.74±117.032) 214.59±107.493)参数 ALDH2*1/*1-ADH1B*1/*2(n=16)ALDH2*1/*1-ADH1B*2/*2(n=24)ALDH2*1/*2-ADH1B*1/*2(n=12)
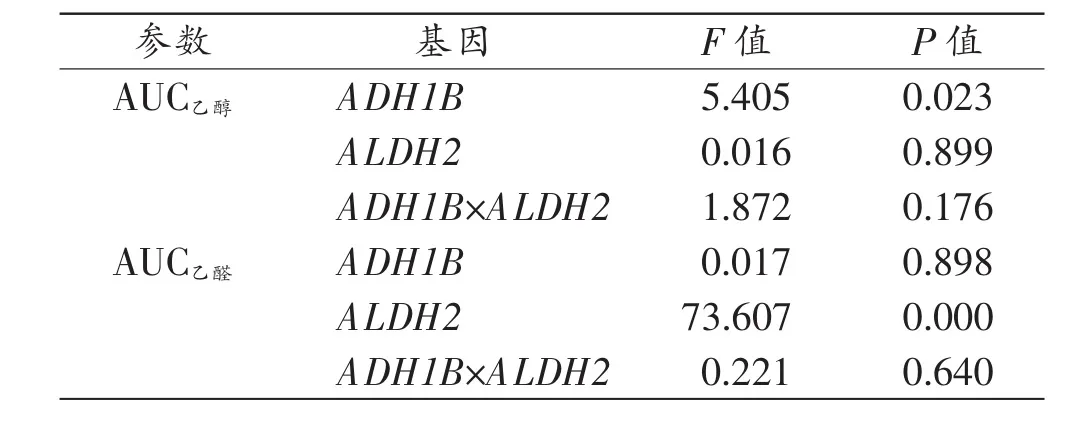
表2 ALDH2和ADH1B基因对AUC乙醇、AUC乙醛的影响
ADH1B*2/*2纯合子个体的ADH活性较ADH1B*1/*2杂合子高,能更快地将乙醇代谢为乙醛[11]。因此,理论上ADH1B*2/*2基因型个体β绝对值应大于ADH1B*1/*2个体。本研究发现的ALDH2*1/*1基因型个体中,ADH1B*2/*2组的β绝对值高于ADH1B*1/*2组,与上述推论一致。然而此发现并不存在于ALDH2*1/*2基因型个体中,推测可能是因为ALDH2*1/*2基因型个体体内乙醛的累积抑制了ADH1B的酶活性[12],对ADH1B*2/*2编码的高活性ADH1B影响更强。尽管ALDH2*1/*2基因型个体中ADH1B组间Tmax、Cmax及β值差异不大,但ADH1B*2/*2组的AUC乙醇却低于ADH1B*1/*2组。推测AUC乙醇值较低的原因在于,整个代谢过程中ADH1B*2/*2基因型组的血乙醇质量浓度均低于ADH1B*1/*2基因型组(图2A),因此进入体循环的乙醇总量较低。
携带ALDH2*2等位基因的个体,其编码的ALDH活性显著降低,进而引起血中乙醛的累积,在既往研究[13-14]中已得到确证,本研究中各基因型组间AUC乙醛的比较结果也支持上述观点。此外,在饮酒过程中,我们观察到ALDH2*1/*2基因型携带者出现明显的脸红、心悸等不适反应,也正是乙醛蓄积产生的毒理作用。
关于ADH1B对血中乙醛浓度的影响,有研究[15]报道,将含rADH-47His突变cDNA的腺病毒载体注射到大鼠,模拟人类ADH1B突变,该大鼠在给予乙醇后能引起动脉血乙醛浓度短时增加,但人体实验[16-17]结论与其并不一致。本研究结果显示,在控制ALDH2基因型后,ADH1B*2/*2纯合子携带者的AUC乙醛与ADH1B*1/*2杂合子差异并无统计学意义。
2.4 饮酒种类对乙醇代谢的影响
根据基因分型结果筛选出的10名基因型相同的志愿者,基因型均为ADH1C*1/*1-ADH1B*2/*2-ALDH2*1/*1,参与白酒、红酒和啤酒3种不同类型酒的饮酒实验,获得 Tmax、Cmax、AUC乙醇、β 和 AUC乙醛值。经随机区组设计方差分析后结果显示,白酒、红酒、啤酒3种类型酒组间上述参数的差异均无统计学意义(P〉0.05,表3)。个体摄取相同剂量不同类型的酒时,乙醇吸收进入体内的速度只有微小差异[18],本研究初步显示,个体摄取相同剂量不同类型的酒时,血乙醇代谢及乙醛蓄积也无差异。
表3 不同饮酒类型各参数分析 (n=10,±s)
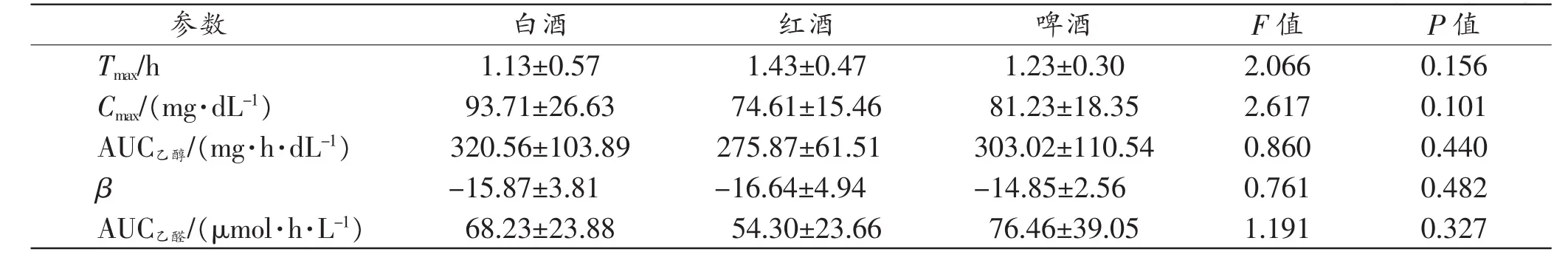
表3 不同饮酒类型各参数分析 (n=10,±s)
参数 白酒 红酒 啤酒 F值 P值Tmax/h 1.13±0.57 1.43±0.47 1.23±0.30 2.066 0.156 Cmax/(mg·dL-1) 93.71±26.63 74.61±15.46 81.23±18.35 2.617 0.101 AUC乙醇/(mg·h·dL-1) 320.56±103.89 275.87±61.51 303.02±110.54 0.860 0.440 β-15.87±3.81 -16.64±4.94 -14.85±2.56 0.761 0.482 AUC乙醛/(μmol·h·L-1) 68.23±23.88 54.30±23.66 76.46±39.05 1.191 0.327
综上,本研究报道了中国汉族人群在较高剂量[19]饮酒时,不同ADH1B和ALDH2基因型个体体内乙醇代谢和乙醛蓄积的情况。另外,还考察了饮酒种类对乙醇代谢的影响,初步发现机体乙醇代谢受相关基因多态性影响较大,基本不受饮酒种类的影响。在司法鉴定实践中解释乙醇相关问题或对血乙醇含量进行回推时,必要时需考虑乙醇代谢酶相关基因的多样性。但是,本研究样本量较少,限制了基因型分组,后期研究中还会增加样本量,涵盖更多基因型,同时考察性别、剂量、饮酒习惯等因素对乙醇代谢的影响。
[1]卓先义,卜俊,向平,等.血中酒精浓度的回推算研究[J].中国法医学杂志,2010,25(5):345-347.
[2]EDENBERG H J.The genetics of alcohol metabolism:role of alcohol dehydrogenase and aldehyde dehydrogenase variants[J].Alcohol Res Health,2007,30(1):5-13.
[3]BOSRON W F,LI T K.Genetic polymorphism of human liver alcohol and aldehyde dehydrogenases,and their relationship to alcohol metabolism and alcoholism[J].Hepatology,1986,6(3):502-510.
[4]CRABB D W, EDENBERG H J, BOSRON W F,et al.Genotypes for aldehyde dehydrogenase deficiency and alcohol sensitivity.The inactive ALDH22allele is dominant[J].J Clin Invest,1989,83(1):314-316.
[5]ENG M Y, LUCZAK S E, WALL T L.ALDH2,ADH1B, and ADH1C genotypes in Asians: a literature review[J].Alcohol Res Health,2007,30(1):22-27.
[6]熊卉,王薇,叶懿,等.ALDH2基因多态性与乙醇代谢及外周乙醛积蓄程度的关系[J].法医学杂志,2014,30(1):31-35.
[7]李冰,沈渔邨,张伯全,等.《酒精使用障碍筛查量表》(AUDIT)的测试[J].中国心理卫生杂志,2003,17(1):1-3.
[8]KANG T S,WOO S W,PARK H J,et al.Comparison of genetic polymorphisms of CYP2E1, ADH2,and ALDH2 genes involved in alcohol metabolism in Koreans and four other ethnic groups[J].J Clin Pharm Ther,2009,34(2):225-230.
[9]WILSON J R,ERWIN V G.Rate of alcohol metabolism; do not “correct” the beta 60 estimate for comparisons among ethnic groups[J].J Stud Alcohol,1983,44(6):1093-1096.
[10]WATSON P E, WATSON I D, BATT R D.Prediction ofblood alcoholconcentrationsin human subjects.Updating the Widmark Equation[J].J Stud Alcohol,1981,42(7):547-556.
[11]DRUESNE-PECOLLO N,TEHARD B,MALLET Y,et al.Alcohol and genetic polymorphisms:effect on risk of alcohol-related cancer[J].Lancet Oncol,2009,10(2):173-180.
[12]CRABB D W,MATSUMOTO M,CHANG D,et al.Overview of the role of alcohol dehydrogenase and aldehyde dehydrogenase and their variants in the genesis of alcohol-related pathology[J].Proc Nutr Soc,2004,63(1):49-63.
[13]WALL T L,PETERSON C M, PETERSON K P, et al.Alcohol metabolism in Asian-American men with genetic polymorphisms of aldehyde dehydrogenase[J].Ann Intern Med,1997,127(5):376-379.
[14]MIZOI Y, YAMAMOTO K, UENO Y, et al.Involvement of genetic polymorphism of alcohol and aldehyde dehydrogenases in individual variation of alcohol metabolism[J].Alcohol Alcohol,1994,29(6):707-710.
[15]RIVERA-MEZA M,QUINTANILLA M E,TAMPIER L,et al.Mechanism of protection against alcoholism by an alcohol dehydrogenase polymorphism:development of an animal model[J].FASEB J,2010,24(1):266-274.
[16]PENG G S, CHEN Y C, WANG M F, et al.ALDH2*2 but not ADH1B*2 is a causative variant gene allele for Asian alcohol flushing after a lowdose challenge:correlation of the pharmacokinetic and pharmacodynamic findings[J].Pharmacogenet Genomics,2014,24(12):607-617.
[17]KANG G,BAE K Y,KIM S W,et al.Effect of the allelic variant of alcohol dehydrogenase ADH1B*2 on ethanol metabolism[J].Alcohol Clin Exp Res,2014,38(6):1502-1509.
[18]CEDERBAUM A I.Alcohol metabolism[J].Clin Liver Dis,2012,16(4):667-685.
[19]MAUREL D B, BOISSEAU N, BENHAMOU C L,et al.Alcohol and bone:review of dose effects and mechanisms[J].Osteoporos Int,2012,23(1):1-16.

