清肠温中方对DSS诱导慢性溃疡性结肠炎模型小鼠Th1/Th2平衡的干预作用*
石 磊 韩亚飞 刘佳丽 丁庞华 孙中美原文静 郭 一 贾博宜 陈晓伟 李军祥△
(1.北京中医药大学,北京 100029;2.北京中医药大学东方医院,北京 100078)
溃疡性结肠炎(UC)是一种好发于结直肠黏膜、黏膜下层的非特异性炎症性疾病,是炎症性肠病的主要类型之一。临床上以腹泻、黏液脓血便、里急后重等肠道表现为主,同时可能伴有营养不良、焦虑抑郁或多系统不同的肠外表现,病情严重者甚至出现威胁生命的情况。UC的发病机制目前尚不明确,多数观点认为是由于环境、感染等因素刺激,引起遗传易感的宿主发生不恰当的免疫炎症反应从而发病[1],而免疫因素在UC的发病中起主导作用,甚至不少学者认为UC属于自身免疫性疾病,其中,T细胞的Th1/Th2亚群平衡失调可能是UC发病的重要机制之一。根据T细胞介导免疫功能及分泌的细胞因子不同,可以将T细胞分为Th1和Th2两个主要的亚群,前者主要分泌IFN-γ、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)等因子介导细胞免疫和炎症反应;后者通过分泌白介素-4(IL-4)、白介素-5(IL-5)和白介素-13(IL-13)等介导体液免疫和抗炎反应[2]。两者在健康个体的体内维持着动态平衡,当一方过度优势等情况致使平衡失调,则会诱发UC的发生。笔者在前期研究中发现清肠温中方可以明显改善UC患者的病情,降低疾病活动指数和修复肠黏膜,并对DSS诱导的急性UC大鼠有一定的治疗作用。因此本实验拟通过葡聚糖硫酸钠(DSS)诱导小鼠慢性UC模型,观察清肠温中方对Th1/Th2平衡的干预作用,为清肠温中方寻找可能的免疫作用靶点。
1 材料与方法
1.1 实验动物 SPF级健康雄性BALB/c小鼠90只,体质量(20±2)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011,饲养于北京中医药大学SPF级动物房,12 h光照/12 h黑夜循环,温度(22±2)℃,湿度 50%~60%,自由饮食饮水。
1.2 试药与仪器 清肠温中浸膏方(黄连6 g,炮姜10 g,三七6 g,木香6 g,炙甘草6 g等)由北京中医药大学中药学院提供;阳性对照药美沙拉嗪缓释颗粒(艾迪莎,国药准字H20143164)购自北京中医药大学东方医院外购药房;葡聚糖硫酸钠(DDS,160110,相对分子质量36000~50000)购自美国MP Bio公司;便潜血试剂盒(中国珠海,BA-0202B)、4%多聚甲醛(SL1830)购自中农博信(北京)科技有限公司;小鼠IL-1β(EK0394)、IL-4(EK0405)、IL-5(EK0408)、IL-6(EK0411)、TNF-α(EK0527)酶联免疫吸附 ELISA 试剂盒均购于武汉博士德生物工程有限公司;抗NF-κB p50(ab28849)抗体购自美国Abcam公司。
1.3 分组与造模 BALB/c小鼠适应性饲养1周,采用随机数字表法将90只小鼠随机分为空白组、模型组、清肠温中方高剂量组(3.2 g浸膏/kg,临床患者2倍用药量)、清肠温中方中剂量组(1.6 g浸膏/kg,临床患者正常用药量)、清肠温中低剂量组(0.8 g浸膏/kg,临床患者0.5倍用药量)和美沙拉嗪组(606.7 mg/kg,临床患者正常用药量)共6组,每组15只,结合文献[3]和临床患者用药量确定给药剂量。采用改良的自由饮用 3%(w/v)DSS 方法复制慢性 UC 模型[4]。所有小鼠进食普通维持饲料,空白组小鼠实验期间均不予干预,其余小鼠自由饮用由蒸馏水配置的3%DSS溶液,溶液每天新鲜配置,共7 d。第8天起改为饮用蒸馏水,共7 d,以上14 d为1个周期,整个模型复制阶段共3个周期,合计42 d。第43天起所有小鼠饮用蒸馏水,同时连续14 d给予相应药物灌胃干预(0.1 mL/10 g),模型组用蒸馏水进行对照灌胃。
1.4 标本采集与检测 1)疾病活动指数(DAI)[5]。实验期间每天记录小鼠体质量,观察一般情况和便质,化验便潜血。体质量下降率:无下降记0分;1%~5%记1分;5%~10%记2分;10%~15%记3分;大于15%记4分。便质:正常0分,稀软便2分;水样便4分;便潜血:阴性0分;阳性2分;肉眼血便4分。2)血清细胞因子含量。实验终点采用眼球取血,将小鼠一侧胡须减去,充分暴露该侧眼球,用眼科镊摘除眼球,收集血液标本,静置 1 h,低温离心机离心 15 min(3000 r/min),收集淡黄色透亮血清,分装后冷冻备用。3)NF-κB p50蛋白表达。在装有碎冰的培养皿上取距肛门4 cm处结肠标本1 cm,于4%多聚甲醛溶液固定,石蜡切片包埋,4 μm切片,抗原修复后采用DAB显色法免疫组化染色观察NF-κB p50蛋白表达。采用平均光密度值(AOD=IntDen/Area)代表 NF-κB p50 蛋白的具体染色程度。
1.5 统计学处理 应用SPSS22.0统计软件。符合正态分布的计量资料用(±s)描述,用单因素方差分析进行检验,方差齐用LSD检验,不齐用T2检验,P<0.05认为差异有统计学意义,P<0.01认为有显著差异。计数资料、等级资料用中位数(四分位数间距)描述,用多个独立样本非参数检验的K-W H检验,P<0.05为有统计学差异,P<0.01为有显著差异。
2 结 果
2.1 各组小鼠DAI评分及一般情况比较 见表1。随着饮用DSS溶液时间的延长,小鼠出现腹泻、黏液脓便、甚至肉眼血便的症状加重,同时伴有体质量逐渐减轻,且症状在饮用药物3 d后明显加重。在造模第1周期内小鼠症状表现明显,病情严重,每组均有死亡现象发生,后2个周期的症状表现较前均有所减轻,死亡数量也较前减少。药物干预后除模型组外,各组小鼠便血、腹泻症状有不同程度减轻,体质量逐渐恢复并增加,实验终点DAI评分结果提示模型组疾病程度明显重于空白组(P<0.01),清肠温中方和美沙拉嗪干预后的评分均有所降低(P<0.05)。
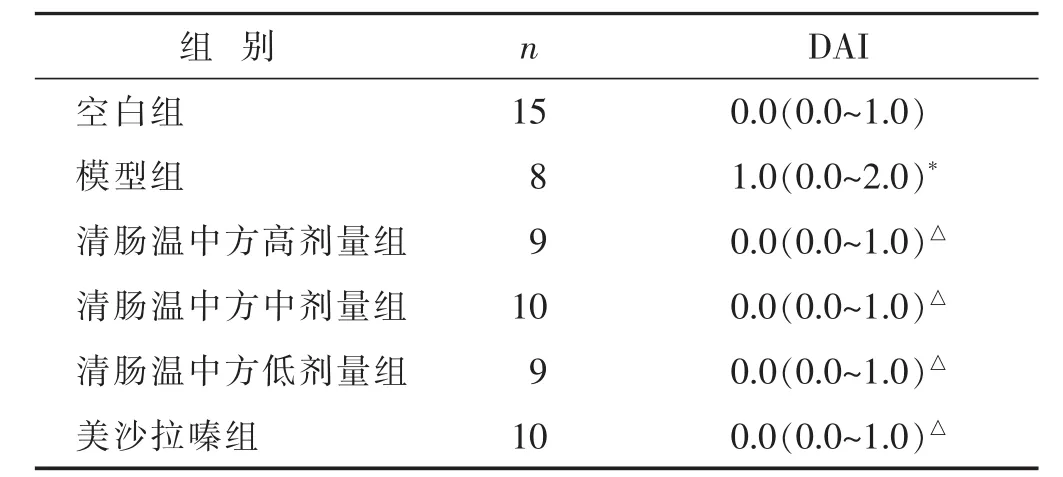
表1 各组DAI评分比较(分)
2.2 各组小鼠血清细胞因子含量比较 见表2。与空白组比较,模型组小鼠血清TNF-α、IL-6和IL-1β明显升高(P<0.01),IL-4和 IL-5明显减少(P<0.01)。药物干预后各组与模型组相比,清肠温中方各剂量和美沙拉嗪均能降低 TNF-α、IL-6 和 IL-1β(P<0.05)并增加IL-4和IL-5(P<0.05),其中以清肠温中方中剂量组和美沙拉嗪组作用最明显。
表2 各组小鼠血清细胞因子含量比较(pg/mL,±s)
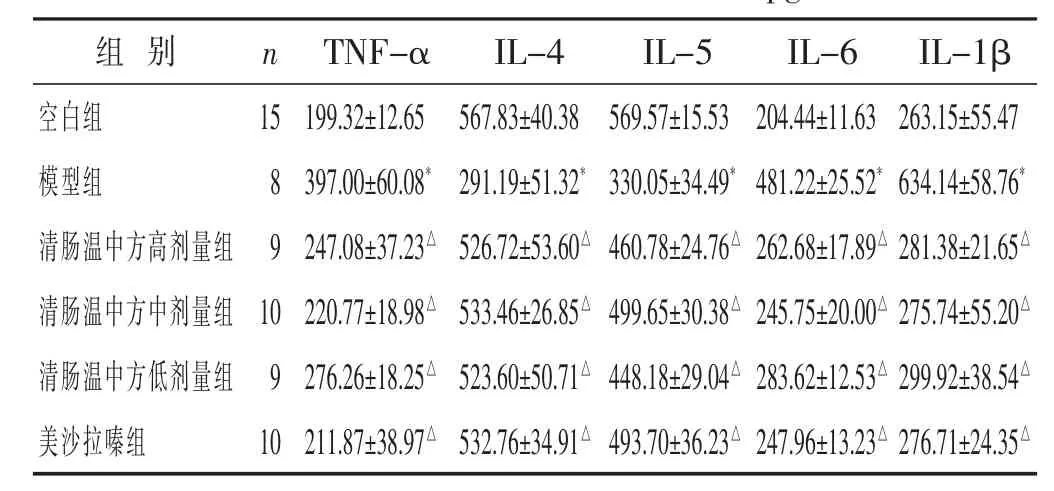
表2 各组小鼠血清细胞因子含量比较(pg/mL,±s)
组 别 n IL-6 IL-1β 204.44±11.63 263.15±55.47 481.22±25.52*634.14±58.76*262.68±17.89△ 281.38±21.65△清肠温中方中剂量组 10 220.77±18.98△ 533.46±26.85△ 499.65±30.38△ 245.75±20.00△ 275.74±55.20△清肠温中方低剂量组 9 276.26±18.25△ 523.60±50.71△ 448.18±29.04△ 283.62±12.53△ 299.92±38.54△美沙拉嗪组 10 211.87±38.97△ 532.76±34.91△ 493.70±36.23△ 247.96±13.23△ 276.71±24.35△空白组 15模型组 8清肠温中方高剂量组 9 TNF-α IL-4 IL-5 199.32±12.65 567.83±40.38 569.57±15.53 397.00±60.08*291.19±51.32*330.05±34.49*247.08±37.23△ 526.72±53.60△ 460.78±24.76△
2.3 各组小鼠NF-κB p50蛋白表达比较 见表3,图1。小鼠结肠组织免疫组化染色后发现,空白组结肠组织表达极少量NF-κB p50蛋白,且表达位置主要位于细胞质;模型组在肠道结构紊乱消失的基础上,与空白组比较表达明显增多(P<0.01),且表达位置主要位于细胞核。药物干预后,与模型组相比,清肠温中方高、中剂量和美沙拉嗪组均能减少NF-κB p50蛋白表达(P<0.05),表达位置在细胞质中为主,其中以中剂量组和美沙拉嗪组的效果最为明显。
表3 各组小鼠NF-κB p50蛋白表达比较(平均光密度值,±s)

表3 各组小鼠NF-κB p50蛋白表达比较(平均光密度值,±s)
组 别 n空白组 15模型组 8清肠温中方高剂量组 9 NF-κB p50 0.29±0.05 0.75±0.05*0.52±0.05△清肠温中方中剂量组 10 0.44±0.03△清肠温中方低剂量组 9 0.60±0.07△美沙拉嗪组 10 0.40±0.06△
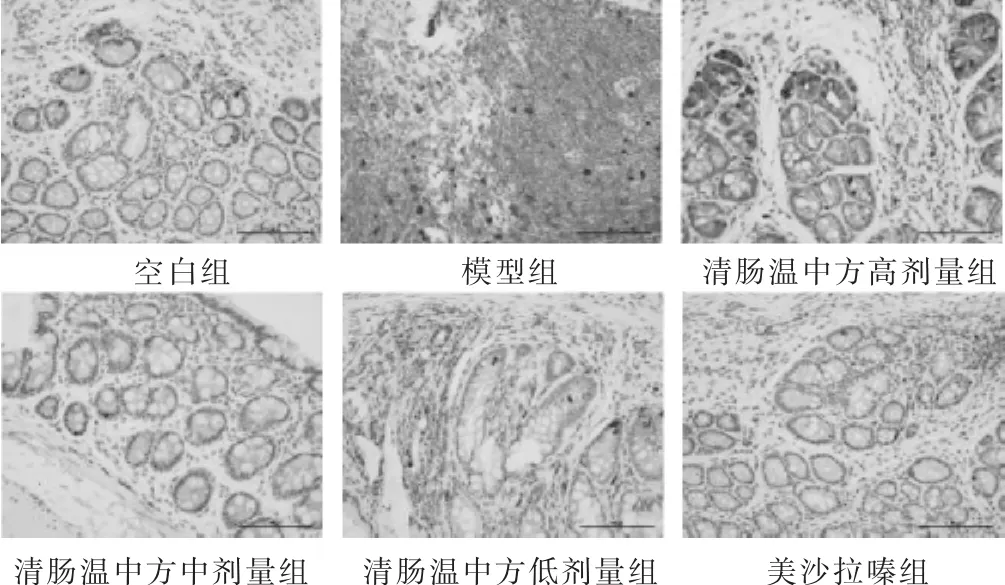
图1 各组NF-κB p50蛋白免疫组化图(DAB染色,200倍)
3 讨 论
本研究采用反复饮用DSS溶液复制慢性UC模型,其中DSS诱导的化学性结肠炎肠上皮损伤与人类UC的表现相似,其机理是溶于水后的硫酸化多糖作为一种化学毒素可以直接作用于肠上皮细胞并产生破坏[6],导致肠腔多种抗原进入肠黏膜,激活黏膜免疫并产生无法控制的炎症级联反应和过度的免疫应答[7]。
人类肠道具有复杂的免疫系统,可以减轻消除病原体的感染,同时保持上皮细胞对食物抗原和非致病菌的耐受性[8]。肠上皮表面的黏液层中含有的大量抗菌物质和分泌性IgA,是肠黏膜免疫的第一道防线;其次,肠上皮细胞及其分泌的抗菌肽、先天性、适应性免疫细胞将共同起到调节黏膜免疫系统功能的作用。肠黏膜免疫细胞特异性的形成了肠道相关淋巴组织(GALT),细菌等抗原在GALT中激活免疫细胞从而发挥免疫效应[9]。适应性免疫针对不同抗原有着强大的特异性,T细胞在UC的发病中起着举足轻重的作用。T细胞有多个不同的细胞亚群,可分泌不同的细胞因子并诱导相应的免疫反应,其中Th1、Th2通过不同的细胞因子相互影响,维持着细胞和体液免疫功能的平衡发挥。有研究指出UC可能是Th1、Th2细胞共同作用而引起的发病[8],因此恢复Th1/Th2平衡在UC的治疗中可能是作用靶点之一。
在接受来自上皮细胞的损伤信号后,树突状细胞驱使幼稚T细胞分化成Th1和Th2不同表型,并分泌关键细胞因子 IFN-γ、TGF-β、IL-4、IL-5 和 IL-13 等,这些不同的细胞因子负责炎症发展、持续的组织损伤和病理改变,包括异常的黏液分泌、纤维化、组织重塑,平滑肌细胞增生和高反应性等[9]。Th1细胞主要分泌TNF-α、IL-6等炎症因子并发挥促炎作用,而肠黏膜组织中的NF-κB受到上游不同因素调控发生激活后入核进行转录,加重炎症级联反应[10]。本实验发现模型组小鼠血清TNF-α、IL-6、IL-1β含量明显升高,肠黏膜中NF-κB p50表达明显增多且大多位于细胞核内,而血清IL-4、IL-5抗炎因子含量明显降低,说明DSS诱导的慢性UC模型中,以Th1为主的免疫应答占主导,Th2细胞相对处于弱势,Th1/Th2处于失衡状态并偏向前者。当采用清肠温中方或美沙拉嗪治疗后,抗炎因子 IL-4、IL-5 有所升高,促炎因子 TNF-α、IL-6、IL-1β较前减少,肠黏膜中NF-κB p50表达减少,并以细胞质中表达为主,说明清肠温中方和美沙拉嗪可以相对提升Th2类细胞亚群,抑制相对亢进的Th1细胞,促进Th1/Th2平衡状态并恢复免疫系统正常功能。本研究发现IL-4、IL-5在治疗后含量明显高于其余炎性因子,考虑与慢性UC模型有关,这也与文献[11]报道UC晚期病程以Th2型免疫反应为主的现象相吻合。
清肠温中方是北京中医药大学东方医院消化科李军祥教授总结多年临床经验而创,他认为UC病位在肠,与脾胃关系密切,病机多属脾阳不足、湿热夹瘀,当以健脾温中、清热化瘀法则治疗,已在临床UC治疗中收获确切疗效。有学者[12-14]提出Th1/Th2失衡是温病湿热证共同的致病机制之一,并通过实验证实了清热祛湿类方药具有不同程度改善Th1/Th2失衡的作用,本研究发现清肠温中方的清热燥湿治法也正具备调节这两类免疫细胞亚群的功效。姚茹冰等[15]发现三七总皂苷可以抑制类风湿关节炎患者外周血Th1分泌的IFN-γ,促进Th2分泌IL-4从而恢复二者平衡。研究发现葛根芩连结肠定位片具有降低家兔血清及结肠组织Th1细胞因子IL-1β和TNF-α并提高Th2细胞因子IL-4、IL-13的表达,调整两类免疫细胞亚群的作用[16]。此外,采用利湿和血汤联合美沙拉嗪治疗UC患者后,可以显著调控多种细胞因子的表达[17],这些都与我们研究发现的清肠温中方通过恢复Th1/Th2平衡从而起到治疗UC的作用一致。
对于慢性UC小鼠,清肠温中方不仅可以降低Th1细胞增加Th2细胞,促使二者平衡的恢复,还能减少NF-κB的激活入核,起到治疗疾病的作用。但Th2细胞的主导优势是否会对UC后期的恢复存在影响作用,清肠温中方能否调控以Th2为主的Th1/Th2失衡,有待进一步的研究。
[1]Eichele DD,Kharbanda KK.Dextran sodium sulfate colitis murine model:An indispensable tool for advancing our understanding of inflammatory bowel diseases pathogenesis[J].World J Gastroenterol,2017,23(33):6016-6029.
[2]张石宇,刘文,郭光伟,等.葛根芩连结肠定位片对湿热内蕴型溃疡性结肠炎家兔模型Thl/Th2细胞因子平衡的影响[J].时珍国医国药,2016,27(10):2387-2391.
[3]罗爽,罗霞,刘琦,等.大黄酸对DSS诱导溃疡性结肠炎小鼠的治疗作用及机制探讨[J].中国实验方剂学杂志,2017,23(11):109-113.
[4]Lianjie Lin,Yan Sun,Dongxu Wang,et al.Celastrol ameliorates ulcerative colitis-related colorectal cancer in mice via suppressing inflammatory responses and epithelial-mesenchymal transition[J].Front Pharmacol,2016.
[5]Mao TY,Shi R,Zhao WH,et al.Qingchang wenzhong decoction ameliorates dextran sulphate sodium-induced ulcerative colitis in rats by downregulating the IP10/CXCR3 Axis-mediated inflammatory response [J].Evid Based Complement AlternatMed,2016.
[6]Randhawa PK,Singh K,Singh N,et al.A review on chemicalinduced inflammatory bowel disease models in rodents[J].Korean J Physiol Pharmacol,2014,18:279-288.
[7]Janice J.Kim,Md.Sharif Shajib,Marcus M.Manocha,et al.Investigating intestinal inflammation in DSS-induced Model of IBD[J].J Vis Exp,2012(60):3678.
[8]Maloy KJ,Powrie F.Intestinal homeostasis and its breakdown in inflammatory bowel disease[J].Nature,2011,474(7351):298-306.
[9]Okumura R,Takeda K.Roles of intestinal epithelial cells in the maintenance of gut homeostasis[J].Experimental&Molecular Medicine,2017,49(5):e338.
[10]彭小青.Th1/Th2细胞炎性因子在大鼠溃疡性结肠炎治疗模型中的表达研究[D].长沙:中南大学,2012.
[11]Jovanovic K,Siebeck M,Gropp R.The route to pathologies in chronic inflammatory diseases characterized by T helper type 2 immune cells[J].Clin Exp Immunol,2014,178(2):201-211.
[12]杨梦凡,蒋丽琴.针灸干预对溃疡性结肠炎动物肠黏膜炎症反应、机体免疫应答平衡的影响[J].海南医学院学报,2017,23(13):1744-1747.
[13]庞艳华,郑长青.Th1/Th2细胞亚群与炎症性肠病的关系[J].世界华人消化杂志,2004,12(8):1922-1924.
[14]李华锋,刘叶,林兴栋.小鼠肝炎病毒温病湿热证模型血清Th1/Th2细胞因子变化研究[J].辽宁中医药大学学报,2012,14(9):57-60.
[15]姚茹冰,高佩芳,赵智明,等.三七总皂苷对类风湿关节炎环瓜氨酸肽抗原特异性T细胞分泌干扰素-γ及白细胞介素-4 的影响[J].医学研究生学报,2010,23(11):1148-1150.
[16]张石宇,刘文,郭光伟,等.葛根芩连结肠定位片对湿热内蕴型溃疡性结肠炎家兔模型Th1/Th2细胞因子平衡的影响[J].时珍国医国药,2016,27(10):2387-2391.
[17]费香勇.利湿和血汤辅助美沙拉嗪治疗溃疡性结肠炎疗效及对生活质量、炎症免疫细胞因子水平的影响[J].中国中医急症,2017,26(6):1097-1099.

