敲低EZH2表达抑制人舌鳞状细胞癌侵袭迁移能力的研究*
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是世界范围内发病率居第6位的恶性肿瘤[1],大部分患者预后不良,5年总体生存率仅50%[2]。大部分HNSCC患者发现时已无完全手术切除机会,与肿瘤的局部侵犯、易发生淋巴结和远处转移密切相关[3-5]。头颈部存在丰富且重要的血管和神经,肿瘤的局部侵犯和淋巴结转移极有可能包绕或黏连血管和神经导致无法手术或者无法根治性切除。在以往的治疗方法中,尽管采用了手术、化疗、放疗和靶向药物等手段,但是HNSCC患者的总体生存率仍未得到明显提高[6-7]。因此为了延长HNSCC患者的生存时间并提高其生存质量,研究HNSCC的临床特点和发生发展机制,特别是其局部侵袭和淋巴结转移的机制,寻找治疗HNSCC的新靶点是当前改善HNSCC疗效的重要突破口。
Zeste同源增强子(enhancer of zeste homolog 2,EZH2)是组成多梳抑制复合物2(polycomb repressor⁃complex2,PRC2)的核心亚基,EZH2的SET区域具有甲基催化酶活性,其经典的表观遗传学调控途径是催化组蛋白H327位点的三甲基化(H3K27me3),促使其下游靶基因表达沉默[8]。miR-200家族是经典的抑制肿瘤侵袭和转移的miRNA,通过促进相关mRNA的降解,抑制基因表达的翻译过程。然而miR-200家族的基因常在肿瘤早期沉默[9-11]。有研究发现EZH2参与调控miR-200b/a/429的表达,而EZH2/miR-200b/a/429又可能是上皮来源肿瘤的靶向指标[12]。本研究对HNSCC中EZH2能否通过调控miR-200b/a/429的表达水平,继而影响肿瘤的侵袭和转移进行研究。
1 材料与方法
1.1 材料
1.1.1 细胞株 人舌鳞癌细胞系SCC15与UM-1购自美国菌种保藏中心(ATCC)。
1.1.2 实验试剂 所有细胞系均使用DMEM/Ham's F-12培养基,并在培养基中加入10%FBS和青霉素100U/mL/链霉素100 U/mL。二甲基亚砜(美国Sigma公司)、白介素-6(美国PeproTech公司)。E-cadherin(美国BD公司)、N-cadherin(美国BD公司)、Vimentin抗体(美国Absci公司)、EZH2抗体(美国Cell Signaling Technology公司)、GAPDH(北京中杉金桥公司)、Matrigel胶(美国BD公司)、TRIzol试剂(美国Invitrogen公司)、cDNA试剂盒(中国凯基公司)、MMP-2和MMP-9(美国Santa Cruz公司)、Alexa Fluor 594-鬼笔环肽(美国Cell Signaling Technology公司)、4,6-二脒基-2-苯基吲哚(美国ThermoFisher Scientific公司)、lipofectamine2000(美国Life Technology公司)。
1.2 方法
1.2.1 细胞培养 所有细胞于37℃恒温、5%CO2的湿润条件下培育。每天观察细胞生长状态,并适时更换培养液。
1.2.2 Transwell实验 24孔板进行Transwell实验。将含5×104/mL个已经处理后的处于对数生长期的SCC15或UM-1细胞的细胞悬液(控制细胞悬液体积200 μL)加入Transwell小室(美国Corning公司)。Transwell小室预先加入Matrigel胶,于24孔板Tran⁃swell小室加入500 μL 20%浓度的FBS培养基。培养24 h后,取出Transwell小室,湿润棉签擦去Transwell小室上方未穿出细胞,避免未穿出细胞干扰。然后用4%多聚甲醛固定10 min,结晶紫染色液染色15 min,用PBS冲洗干净后烘干。使用倒置显微镜观察穿过膜的舌鳞癌细胞。计数并计算平均值,拍照。
1.2.3 划痕实验 为确认Transwell实验的结果,再进行划痕实验。将SCC15或UM-1细胞以3×105/孔铺于6孔板中,待细胞汇合度达80%后,使用10 μL吸头在孔板划约4 mm宽的“十字”,更换无血清的细胞培养液,每隔一定时间观察并记录划痕愈合情况,分析数据。
1.2.4 Real time q-PCR 按照TRIzol试剂说明书提取总RNA,将等量的RNA用cDNA试剂盒逆转录为cDNA。最后通过Real time q-PCR分析miR-200b/a/429表达水平的差别。根据靶基因与内参基因U6的ΔΔCT进行比较,计算相关数据。
1.2.5 Western blot法检测 常规培养对数生长期舌鳞状细胞癌细胞SCC15和UM-1,PBS清洗2遍,裂解离心后收取上清液。根据试剂盒的说明书提取蛋白,测定蛋白浓度。蛋白以95℃加热10 min后,用10%SDSPAGE电泳分离蛋白样本,然后转膜至甲醇激活的PVDF膜(德国Merck Millipore公司)。TBST溶液清洗PVDF膜后,用含5%脱脂牛奶室温条件下封闭2 h。加入E-cadherin、N-cadherin、Vimentin、MMP-2和MMP-9的一抗(1:1 000稀释),4℃孵育过夜。使用带有辣根过氧化物酶的兔或鼠类IgG抗体(美国Santa Cruz公司)作为二抗(1:2 000稀释)。GAPDH作为内参。采集图像,用Image J软件评定靶蛋白的表达水平。
1.2.6 免疫荧光实验 所有处理后的舌鳞癌细胞置于18 mm盖玻片上培育24 h,待细胞完全贴壁,4%多聚甲醛固定,3%BSA封闭后,加入一抗,包括E-cad⁃herin、N-cadherin(1:100稀释)和Vimentin(1:100稀释),4℃孵育过夜。细胞经PBS清洗后,使用Alexa Fluor 488或Alexa Fluor 594二抗孵育(1:500稀释)。为评估应力纤维结构变化,细胞用Alexa Fluor 594-鬼笔环肽(1:500稀释),细胞核用4,6-二脒基-2-苯基吲哚(DAPI)染色,然后在FV-1000激光扫描共聚焦显微镜下观察载玻片。
1.2.7 瞬时转染 SCC15和UM-1细胞系中转染siRNA(20 nM),敲低EZH2。使用lipofectamine2000,根据试剂说明书分别将si-NC和si-EZH2转入SCC15或UM-1细胞6 h后换液,48 h后使用转染过的细胞进行实验。
1.2.8 免疫组织化学检测 将人头颈部鳞癌组织蜡块进行脱蜡处理,PBS液冲洗3遍,滴加封闭液。封闭1 h后,弃去。加入EZH2抗体孵育过夜,PBS冲洗,二抗孵育1 h。光学显微镜下观察显色。细胞着色>5%为EZH2阳性。
1.2.9 组织标本 收集2012年1月至2015年12月天津医科大学肿瘤医院颌面耳鼻喉科手术切除的患者组织标本,共95例。患者资料和临床数据查自电子病历。所有标本用于检测EZH2的表达情况。本研究经过患者或其家属知情同意,所有样本的收集均遵照天津医科大学伦理委员会的人类组织标本使用指南。
1.3 统计学分析
使用SPSS 16.0统计软件进行数据分析。计量资料采用χ2检验,计数资料用±s表示,采用t检验分析。P<0.05为差异具有统计学意义。
2 结果
2.1 Western blot法检测转染si-EZH2后细胞中EZH2及GAPDH表达
Western blot法检测结果显示,两种细胞系中与对照组(si-NC组)比较,小干扰RNA[siRNAs(si#1和si#2)]均能够有效抑制EZH2的表达,差异具有统计学意义(P<0.05),其中si#2敲低EZH2的效果更明显,因此选用si#2进行下一步研究。
2.2 q-PCR法检测转染si-EZH2后miR-200b/a/429表达水平的变化
在SCC15和UM-1细胞系中,敲低EZH2表达组(si-EZH2组)的miR-200b/a/429转录水平明显高于si-NC组,其中miR-429升高的水平最明显。因此说明在舌鳞癌细胞中,EZH2有可能抑制了miR-200b/a/429的表达水平(图1)。

图1 敲低EZH2对miR-200b/a/429的影响
2.3 Transwell实验和划痕实验检测si-EZH2组细胞转移能力的变化
Transwell实验结果显示,在有基质胶和无基质胶的培养皿中,si-EZH2组穿出的细胞数目均明显少于si-NC组(图2A)。表明si-EZH2组舌鳞癌细胞的迁移和侵袭能力下降。同时,划痕实验也显示siEZH2组细胞划痕间距略有减小,而si-NC组明显减小,远大于siEZH2组细胞划痕间距缩小的程度(图2B)。提示抑制EZH2的表达可以使舌鳞癌细胞的侵袭和迁移能力明显降低。

图2 敲低EZH2对HNSCC侵袭和迁移能力的影响
2.4 Western blot法和免疫荧光法检测转染si-EZH2后细胞骨架和EMT相关蛋白水平的改变
Western blot法和免疫荧光检测结果均提示,si-EZH2组的上皮指标E-cadherin表达水平高于si-NC组,而间质指标N-cadherin、Vimentin表达水平低于si-NC组(图3A,3B)。提示si-E2H2组细胞发生了MET样改变。Western blot法检测结果还提示,si-EZH2组的侵袭指标,如MMP-2、MMP-9蛋白表达水平下降(图3A)。免疫荧光实验通过对si-EZH2组细胞骨架蛋白F-actin的染色显示出细胞骨架结构发生变化,细胞运动能力降低(图3C)。提示EZH2参与调控舌鳞癌细胞的转移和侵袭。
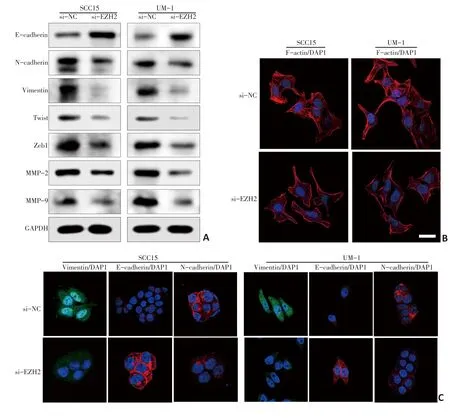
图3 敲低EZH2对EMT相关蛋白及细胞骨架蛋白表达的影响
2.5 HNSCC组织标本中EZH2及miR-200b/a/429的表达
利用免疫组织化学法检测95例HNSCC肿瘤标本中EZH2的表达水平情况(表1)。结果显示,在95例HNSCC组织中有47例EZH2表达阳性(49.47%)。EZH2的表达水平与HNSCC患者的年龄和性别无显著相关性(P=0.34,P=0.19)。有淋巴结转移的EZH2阳性率高于无淋巴结转移的肿瘤组织(P<0.01,图4)。
采用PCR方法分别检测EZH2高表达组和EZH2低表达组的miR-200b/a/429表达情况。EZH2高表达组的miR-200b/a/429表达低于EZH2低表达组,差异具有统计学意义(P<0.05,图5)。因此提示在HNSCC组织标本中再次验证了EZH2能够抑制miR-200b/a/429的表达。

表1 EZH2的表达与95例舌鳞癌患者临床病理特征的关系
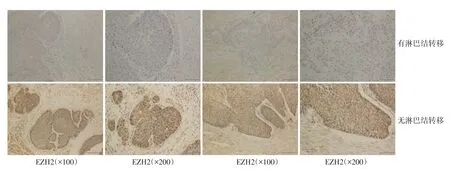
图4 有淋巴结转移与无淋巴结转移的肿瘤组织中EZH2的表达(SP法)

图5 肿瘤组织标本中miR-200b/a/429的表达
3 讨论
本研究前期发现EZH2在HNSCC中存在过表达的情况[13],但是在HNSCC中EZH2如何参与肿瘤进展的调控机制尚不清楚,有待进一步深入研究。EZH2的经典表观遗传学调控途径是催化组蛋白H3K27位点的三甲基化,从而促使其下游靶基因表达沉默[8]。在多数肿瘤中,被EZH2沉默的下游靶基因为抑癌基因,所以EZH2大多起到促进癌症发展的作用,其表达常与肿瘤患者的预后呈负相关[14]。异常高表达的EZH2在上皮和血液等多种类型的肿瘤中常作为不良的预后因子,其中包括前列腺癌[14]、乳腺癌[15]、结直肠癌[16]、肝癌[17]、胶质瘤[18]以及头颈部肿瘤[19]。EZH2能够参与细胞生长和进展的多个过程,如细胞周期、细胞衰老、细胞凋亡、干细胞干性的维持及肿瘤的发生和发展[12,18,20-21]。在不同的肿瘤中发现EZH2参与肿瘤发生发展的多种作用机制,如在胶质瘤中已证实,p21、p16以及NLK可被EZH2直接调控[21-22];EZH2通过激活RAF1 β-catenin信号通路促进乳腺肿瘤启动细胞增殖[23];EZH2作为pRB-E2F信号通路的下游基因对于前列腺癌细胞的增殖和扩增发挥至关重要的作用[24]。本研究利用siRNAs干扰EZH2的表达后发现,舌鳞状细胞癌细胞系的侵袭和迁移能力明显降低,同时还发现miR-200b/a/429的表达增加。提示EZH2可能促进了舌鳞状细胞癌的侵袭和转移过程,而其参与舌鳞状细胞癌进展的方式可能与miR-200b/a/429有关。
miR-200家族包括 miR-200a、miR-200b、miR-200c、miR-141和miR-429,其中miR-200b/a/429位于1号染色体,常在高级别恶性肿瘤中沉默[11]。miR-200b/a/429基因在许多肿瘤中被认为是重要的抑癌基因[25-27]。如在卵巢肿瘤中,miR-200a通过调控氧化应激反应抑制肿瘤的生长[28];miR-200通过抑制Slug的表达从而抑制EMT和前列腺癌的发生[29]。miR-200b/a/429是调控EMT的关键因子,能够抑制肿瘤细胞的侵袭和转移[11,30-34]。miR-200s的甲基化沉默导致了EMT的发生,进而促进肿瘤细胞的生长和侵袭[35-36]。有研究指出,miR-200s是通过调控E-cadherin的转录抑制子ZEB1和ZEB2而影响EMT的发生[37-38]。在体外实验中,通过沉默ZEB1能够减少miR-200c/miR-141 DNA和组蛋白H3K9的甲基化,而染色质的甲基化与miR-200c和E-cadherin的表达增加是同步的,并且miR-200c/miR-141位点染色质重塑也受ZEB1的影响[39]。本研究结果证实,在舌鳞癌细胞中,异常过表达的EZH2能通过抑制miR-200b/a/429的表达,进而促进舌鳞癌的侵袭和转移。虽然本研究统计的95例临床标本来自HNSCC的各个部位,但由于细胞系SCC15和UM-1均来自舌鳞癌,所以HNSCC中其他部位EZH2与miR-200b/a/429的作用需要进一步探究。
由于干扰了EZH2后使miR-200b/a/429的表达上调,提示miR-200b/a/429可能是EZH2下游所对应的调控因子。EZH2/miR-200b/a/429生物轴可能在HNSCC侵袭和转移中存在一定作用。干扰此轴可能影响HNSCC的进展,因此针对EZH2或miR-200b/a/429开发相应的小分子抑制剂或靶向药物具有重要意义,并且存在一定应用前景。
[1] Pulte D,Brenner H.Changes in survival in head and neck cancers in the late 20th and early 21st century:a period analysis[J].Oncologist,2010,15(9):994-1001.
[2] Lam L,Logan RM,Luke C.Epidemiological analysis of tongue cancer in South Australia for the 24-year period,1977-2001[J].Aust Dental J,2006,51(1):16-22.
[3] Liang L,Luo X,Lian Z,et al.Lymph node metastasis in head and neck squamous carcinoma:Efficacy of intravoxel incoherent motion magnetic resonance imaging for the differential diagnosis[J].Eur J Radiol,2017,90:159-165.
[4] Garcia J,Lopez M,Lopez L,et al.Validation of the pathological classification of lymph node metastasis for head and neck tumors according to the 8th edition of the TNM Classification of Malignant Tumors[J].Oral Oncol,2017,70:29-33.
[5] Talmi YP,Takes RP,Alon EE,et al.Prognostic value of lymph node ratio in head and neck squamous cell carcinoma[J].Head Neck,2018[Epub ahead of print]
[6] Strojan P,Vermorken JB,Beitler JJ,et al.Cumulative cisplatin dose in concurrent chemoradiotherapy for head and neck cancer:A systematic review[J].Head Neck,2016,38(Suppl 1):2151-2158.
[7] Haigentz M Jr,Vermorken JB,Forastiere AA,et al.When is chemotherapy in head and neck squamous cell carcinoma not indicated[J]?Eur Arch Otorhinolaryngol,2015,272(4):781-787.
[8] Margueron R,Reinberg D.The polycomb complex PRC2 and its mark in life[J].Nature,2011,469(7330):343-349.
[9] Sun N,Zhang Q,Xu C,et al.Molecular regulation of ovarian cancer cell invasion[J].Tumour Biol,2014,35(11):11359-11366.
[10]Sossey-Alaoui K,Bialkowska K,Plow EF.The miR200 family of microRNAs regulates WAVE3-dependent cancer cell invasion[J].J Biol Chem,2009,284(48):33019-33029.
[11]Xue X,Zhang Y,Zhi Q,et al.MiR200-upregulated Vasohibin 2 promotes the malignant transformation of tumors by inducing epithelial-mesenchymal transition in hepatocellular carcinoma[J].Cell Commun Signal,2014,12:62.
[12]Ning X,Shi Z,Liu X,et al.DNMT1 and EZH2 mediated methylation silences the microRNA-200b/a/429 gene and promotes tumor progression[J].Cancer Lett,2015,359(2):198-205.
[13]Zhou X,Ren Y,Kong L,et al.Targeting EZH2 regulates tumor growth and apoptosis through modulating mitochondria dependent celldeath pathway in HNSCC[J].Oncotarget,2015,6(32):33720-33732.
[14]Abdelrahman AE,Arafa SA,Ahmed RA.Prognostic Value of Twist-1,E-cadherin and EZH2 in Prostate Cancer:An Immunohistochemical Study[J].Turk Patoloji Derg,2017,1(1):198-210.
[15]Wang X,Hu B,Shen H,et al.Clinical and prognostic relevance of EZH2 in breast cancer:A meta-analysis[J].Biomed Pharmacother,2015,75:218-25.
[16]Chen Z,Yang P,Li W,et al.Expression of EZH2 is associated with poor outcome in colorectal cancer[J].Oncology Lett,2018,15(3):2953-2961.
[17]Li S,Sun S,Yu S,et al.Association between EZH2 genetic variants and hepatocellular carcinoma in a Chinese han population[J].Clin Lab,2018,64(1):85-91.
[18]Zhang J,Chen L,Han L,et al.EZH2 is a negative prognostic factor and exhibits pro-oncogenic activity in glioblastoma[J].Cancer Lett,2015,356(2 Pt B):929-936.
[19]Chang JW,Gwak SY,Shim GA,et al.EZH2 is associated with poor prognosis in head-and-neck squamous cell carcinoma via regulating the epithelial-to-mesenchymal transition and chemosensitivity[J].Oral Oncol,2016,52:66-74.
[20]Zhang K,Sun X,Zhou X,et al.Long non-coding RNA HOTAIR promotes glioblastoma cell cycle progression in an EZH2 dependent manner[J].Oncotarget,2015,6(1):537-546.
[21]Zhou X,Ren Y,Zhang J,et al.HOTAIR is a therapeutic target in glioblastoma[J].Oncotarget,2015,6(10):8353-8365.
[22]Liu Z,Sun M,Lu K,et al.The long noncoding RNA HOTAIR contributes to cisplatin resistance of human lung adenocarcinoma cells via downregualtion of p21(WAF1/CIP1)expression[J].PloS One,2013,8(10):e77293.
[23]Chang CJ,Yang JY,Xia W,et al.EZH2 promotes expansion of breast tumor initiating cells through activation of RAF1-beta-catenin signaling[J].Cancer Cell,2011,19(1):86-100.
[24]Bracken AP,Pasini D,Capra M,et al.EZH2 is downstream of the pRBE2F pathway,essential for proliferation and amplified in cancer[J].EMBO J,2003,22(20):5323-5335.
[25]Tsouko E,Wang J,Frigo DE,et al.miR-200a inhibits migration of triple-negative breast cancer cells through direct repression of the EPHA2 oncogene[J].Carcinogenesis,2015,36(9):1051-1060.
[26]Wang J,Yang X,Ruan B,et al.Overexpression of miR-200a suppresses epithelial-mesenchymal transition of liver cancer stem cells[J].Tumour Biol,2015,36(4):2447-2456.
[27]Ming J,Zhou Y,Du J,et al.Identification of miR-200a as a novel suppressor of connexin43inbreast cancer cells[J].Biosci Rep,2015,35(5):251.
[28]Mateescu B,Batista L,Cardon M,et al.miR-141 and miR-200a act on ovarian tumorigenesis by controlling oxidative stress response[J].Nat Med,2011,17(12):1627-1635.
[29]Liu YN,Yin JJ,Abou-Kheir W,et al.miR-1 and miR-200 inhibit EMT via Slug-dependent and tumorigenesis via Slug-independent mechanisms[J].Oncogene,2013,32(3):296-306.
[30]Chen J,Wang L,Matyunina LV,et al.Overexpression of miR-429 induces mesenchymal-to-epithelial transition(MET)in metastatic ovarian cancer cells[J].Gynecol Oncol,2011,121(1):200-205.
[31]Yuan D,Xia H,Zhang Y,et al.P-Akt/miR200 signaling regulates epithelial-mesenchymal transition,migration and invasion in circulating gastric tumor cells[J].Int J Oncol,2014,45(6):2430-2438.
[32]Xiao P,Liu W,Zhou H.miR-200b inhibits migration and invasion in nonsmall cell lung cancer cells via targeting FSCN1[J].Mol Med Rep,2016,14(2):1835-1840.
[33]Holzner S,Senfter D,Stadler S,et al.Colorectal cancer cell-derived microRNA200 modulates the resistance of adjacent blood endothelial barriers in vitro[J].Oncol Rep,2016,36(5):3065-3071.
[34]Izumchenko E,Chang X,Michailidi C,et al.The TGFbeta-miR200-MIG6 pathway orchestrates the EMT-associated kinase switch that induces resistance to EGFR inhibitors[J].Cancer Res,2014,74(14):3995-4005.
[35]Enkhbaatar Z,Terashima M,Oktyabri D,et al.KDM5B histone demethylase controls epithelial-mesenchymal transition of cancer cells by regulating the expression of the microRNA-200 family[J].Cell Cycle,2013,12(13):2100-2112.
[36]Davalos V,Moutinho C,Villanueva A,et al.Dynamic epigenetic regulation of the microRNA-200 family mediates epithelial and mesenchymal transitions in human tumorigenesis[J].Oncogene,2012,31(16):2062-2074.
[37]Park SM,Gaur AB,Lengyel E,et al.The miR-200 family determines the epithelial phenotype of cancer cells by targeting the E-cadherin repressors ZEB1 and ZEB2[J].Genes Dev,2008,22(7):894-907.
[38]Gregory PA,Bert AG,Paterson EL,et al.The miR-200 family and miR-205 regulate epithelial to mesenchymal transition by targeting ZEB1 and SIP1[J].Nat Cell Biol,2008,10(5):593-601.
[39]Damiano V,Brisotto G,Borgna S,et al.Epigenetic silencing of miR-200c in breast cancer is associated with aggressiveness and is modulated by ZEB1[J].Genes Chromosomes Cancer,2017,56(2):147-158.

