菌落总数测试卡用凝胶培养基和显色剂的优化
郭登峰GUO Deng- 王羚佳 - 舒晓梦 - 杨 潇 张 伟 张广峰 -
(1. 西华大学食品与生物工程学院,四川 成都 610039;2. 成都瑞琦科技实业股份有限公司,四川 成都 610041)
菌落总数是反映食品被微生物污染状况和新鲜程度的重要指标[1]。目前菌落总数快速检测方法包括显色培养基法、ATP 生物荧光法、微热量法、阻抗法、近红外光谱技术和快速检测卡片法等[2-4]。快速检测卡片(下文统一称为检测卡)与传统的微生物培养平板检测相比,因其省略了培养基制作、消毒环节,使得劳动强度大幅减轻;还具有体积小、便于携带储存、检测周期短、操作简便等优点[5-6],从而被运用于快速检测的领域,极大地简化了对微生物总数检测的程序。
从1955年德国学者FJ. Forg发明了快速检测大肠菌群的纸片法以来[7],检测卡已经得到了长足的发展。目前菌落检测卡主要分为滤纸、无纺布和冷水溶性凝胶3种类型[8]。其中滤纸和无纺布虽然成本低廉,但是由于孔隙大,保水性差,不利于菌体生长,导致菌落计数不准确。与前两者相比,冷水溶性凝胶却有着稳定性好、透明度高、易挑菌、菌落计数准确等优点[9-10][11]9-14。而在国内外应用最为广泛的是美国3M公司的PetrifilmTM菌落总数检测卡,由于具有较高的可靠性,曾被纳入中国国家标准[12],但是昂贵的价格,也限制了其在中国一般实验室和企业的大规模使用。因此研究具有自主知识产权的冷水溶性凝胶菌落检测卡片,对于降低检测卡的使用成本,促进微生物指标检测的广泛开展,提升食品安全具有重要意义。
本研究主要通过对常见的冷水溶性凝胶剂[卡拉胶、黄原胶、瓜尔胶、刺槐豆角、聚丙烯酸钠、羧甲基纤维素(CMC)]进行筛选组合、探索凝胶剂配方及其与培养基混合比例、优化显色剂的添加量等来提升水冷凝胶测试卡的使用性能,为新型菌落总数检测卡的研发提供数据参考。
1 材料与方法
1.1 试验材料与仪器
2,3,5-三苯基氯化四氮唑(TTC):AR级,上海馨晟试化工科技有限公司;
胰蛋白胨、酵母提取物:AR级,西班牙OXOID公司;
氯化钠、瓜尔胶、卡拉胶、黄原胶、CMC、聚丙烯酸钠:AR级,成都科龙化工试剂厂;
乙醇:AR级,国药集团化学试剂有限公司;
全自动高温蒸汽灭菌锅:G154DWS型,致微(厦门)仪器有限公司;
电热恒温隔水式培养箱:SGSP-02型,黄石市恒丰医疗器械有限公司;
混合型球磨仪:MM400型,德国RETSCH(莱驰)公司;
万分之一电子天平:TB-214型,美国DENVER INSTRUMENT(丹佛仪器)公司;
紫外可见分光光度计:UV2400型,上海舜宇恒平科学仪器有限公司;
pH仪:MP511型,上海三信公司;
质构仪:TA·XT2i型,英国SMS公司。
1.2 试验菌种
大肠杆菌(LE392)、岅崎肠杆菌(ATCC51329)、福氏志贺菌(CMCC51252)、金黄色葡萄球菌(ASI1861)、沙门菌(ASI1859)、铜绿假单胞菌(CICC10204)、粪链球菌(CMCC32220):西华大大学食品安全实验室保存。
1.3 方法
1.3.1 菌种活化与菌悬液的制备 将各菌种分别于LB培养基中震荡培养2 h活化,并涂布于LB平板上并于37 ℃倒置培养12 h,挑取单菌落转入LB液体培养基中继续培养4 h,将各菌种菌液等比例混合后稀释103倍,待用。
1.3.2 测试卡凝胶培养基粉的制备 LB培养基(胰蛋白胨10 g、酵母提取物5 g、氯化钠10 g充分混合)与凝胶粉按一定比例充分混合后,经超微粉碎1 min,并用紫外线进行杀菌待用。
1.3.3 测试片法 将制备好的测试卡凝胶培养基粉黏附在上下层透明塑料卡上。吸取1 mL 新鲜制备的菌液,翻开测试片上层,均匀滴于测试片中央,小心盖上上层膜,轻轻压平使样液充满测试片,静置5 min,待凝胶固化后于37 ℃培养24 h,计数红色菌落[13-14]。
1.3.4 凝胶的吸水率、保水率测定 称取1.00 g胶粉置于烧杯中,加入500.00 g蒸馏水混匀,放置5 min使其充分溶胀成胶,用100目筛过滤,精密称定滤液重量。吸水率按式(1)计算:
(1)
式中:
A——吸水率,%;
M1——加入蒸馏水质量,g;
M2——滤出蒸馏水质量,g;
M0——称取的凝胶粉水质量,g。
称取1.00 g胶粉置于洁净烧杯中,加入500.00 g蒸馏水混匀,放置5 min使其充分溶胀成胶,弃去多余水分,再精密称取凝胶重量,将其置于37 ℃恒温培养箱中,分别放置8,24 h 后精密称定重量。按式(2)计算保水率。
(2)
式中:
C——保水率,%;
M1——放置不同时间后的凝胶质量,g;
M0——溶胀成凝胶后的质量,g。
1.3.5 水扩散速度与成胶性评价 在透明塑料卡上绘制一个直径10 cm的圆,将成胶剂黏附在透明塑料卡上,向圆心滴入1 mL的蒸馏水并开始计时,水扩散至圆形边缘时停止计时,滴入水后静置5 min,观察是否凝固形成凝胶。
1.3.6 凝胶物性分析 凝胶剂制成厚度为15 mm的凝胶,按照ISO 9665方法测试胶体物性。即在质构仪上选用P/0.5R柱状探头,以压缩模式检测,测前速度1.0 mm/s,测试速度1.0 mm/s,测后速度1.0 mm/s,刺入深度10 mm,数据采集速率400 pps;触发力 2 g。以刺入过程中测得的最大力量为凝胶强度,以达到最大力量时的刺入距离表征凝胶弹性。在穿刺中力量和距离越大,表明凝胶越有韧性和弹性。
1.3.7 凝胶剂组成优化 将根据吸水率、保水率及成胶情况优选出的凝胶进行两两组合,评价其水扩散速度和成胶性。选择扩散速度和成胶性好的凝胶组合,并进一步进行物性比较,以筛选出最优的凝胶剂组成。
1.3.8 凝胶与培养基的比例优化 将优化过的混合凝胶粉与培养基分别按1∶1,1∶2,2∶1的质量比混匀,加入蒸馏水制凝胶,在37 ℃下培养0,12,24 h后,参考吴许文[11]33的方法测定其pH,在37 ℃下培养24 h后测定凝胶物性,并参考吴许文[11]35的方法在500 nm下测其透光度。 选择可在37 ℃ 恒温条件下pH稳定、凝胶强度合适、透光率好、可稳定凝固、成胶无气泡无褶皱黏附,菌落生长正常、分布均匀、清晰可辨的培养基凝胶组合。
1.3.9 TTC加入量的优化 根据相关文献[15-17],TTC在培养基中浓度超过0.100 mg/mL时抑菌较明显,低于0.020 mg/mL 时显色作用不明显。因此选择TTC实际浓度0.020,0.025,0.030,0.035,0.040 mg/mL进行TTC加入量优化。试验中,先配制浓度为0.040,0.050,0.060,0.070,0.080 mg/mL 的TTC溶液,灭菌后分别与稀释105倍的菌液按1∶1体积比混合后,接种于测试卡上并于37 ℃培养24 h 后计数观察。选择显色明显、易于计数且对微生物无抑制作用的TTC浓度。
1.3.10 测试卡片法与倾注培养法对比 将混合菌液依次稀释103,104,105,106倍,分别采用测试卡片法与倾注培养法(按GB/T 4789.2—2016执行)进行检测,比较二者菌落总数的检测结果。
2 结果与讨论
2.1 冷水溶凝胶的基本性能
凝胶吸水率与保水率的优良将直接影响到测试卡的测试效果。吸水率优良的凝胶可以使水快速地在测试卡上扩散,不仅缩短操作时间,还能保证菌落扩散均匀[18]。保水率优良的凝胶将有效地保持测试卡上的水分不流失蒸发,从而为测试卡上的微生物提供一个稳定合适的生长环境。
从凝胶剂吸水率和保水率试验结果可知(表1),各凝胶吸水率大小顺序为:聚丙烯酸钠>黄原胶>CMC>瓜尔胶>卡拉胶。其中聚丙烯酸钠的吸水率太大,并且吸湿性极强,暴露在空气中时很容易结块黏连,不适合单独用于测试卡的制作[19]。对各凝胶培养8 h后,凝胶保水率差别较小;24 h后,保水率发生显著变化,各凝胶之间的差别也较明显,各凝胶保水率大小顺序为:聚丙烯酸钠>瓜尔胶>CMC>黄原胶>卡拉胶。
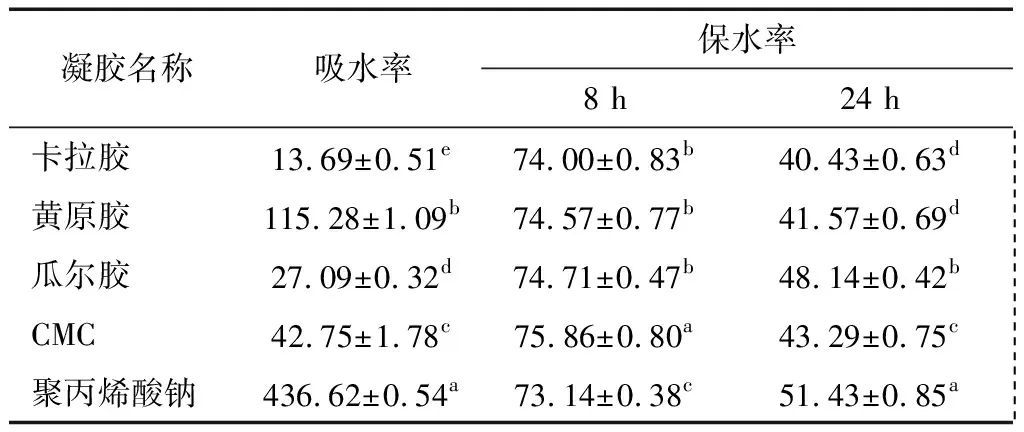
表1 凝胶剂的吸水率与保水率†Table 1 Water absorption and water retention of gels (n=3) %
† 同列不同字母表示差异显著(P<0.05)。
由表2可知,卡拉胶、聚丙烯酸钠、瓜尔胶均可以快速吸水,使水在胶粉内快速扩散;其中以卡拉胶扩散速度最快,瓜尔胶次之,聚丙烯酸钠最慢。但在黄原胶与CMC中水扩散极为缓慢。CMC、聚丙烯酸钠、黄原胶可完全凝固成胶,但黄原胶凝固后气泡较多;卡拉胶、瓜尔胶未能完全凝固,成流动状态。此外各凝胶剂中黄原胶成本最高、卡拉胶和瓜尔胶次之、CMC与聚丙烯酸钠最低。

表2 凝胶剂的水扩散速度和成胶情况Table 2 Gel water diffusion speed and gel conditions
凝胶剂基本性能试验的结果表明,选用以上任何单一凝胶剂均不能满足菌落总数测试卡用冷水溶性凝胶的要求。综合考虑各凝胶剂的吸水率、保水率、水扩散速度、成胶状况和成本,需将凝胶进行组合优化。
2.2 凝胶组合优化
从表3可知,由于水不易在黄原胶胶粉内扩散,故需在黄原胶中加入卡拉胶以增加其水扩散性,但加入卡拉胶后不能形成可凝固的凝胶;将聚丙烯酸钠分别与CMC、瓜尔胶进行混合,但混合后扩散速率较慢且极易吸潮聚团,不能成胶;只有卡拉胶与CMC、瓜尔胶混合时具有较好的水扩散速度和成胶性。
比较卡拉胶与CMC、瓜尔胶组合的凝胶物性发现(表4),卡拉胶与CMC组合的凝胶物性显著好于卡拉胶与瓜尔胶组合,且卡拉胶与CMC组合的成本更为经济,综合考虑选取卡拉胶与CMC按2∶1的质量比混合为宜。
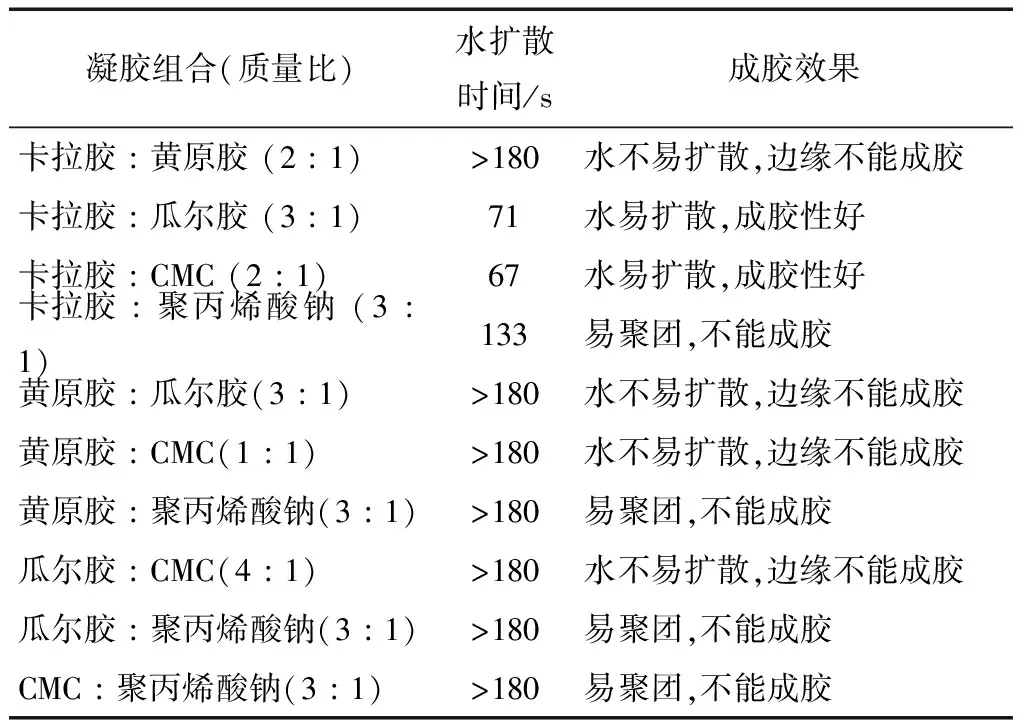
表3 不同凝胶组合的水扩散速度和成胶情况Table 3 Gel combination water diffusion speed and gel combination conditions

表4 不同凝胶组合的物性比较†Table 4 Gel composition properties comparison (n=3)
† 同列不同字母表示差异显著(P<0.05)。
2.3 培养基与凝胶的比例优化
培养基与凝胶的混合比例将直接影响到菌落检测的效果。适合的比例才能使其在加水后迅速溶解形成凝胶培养基,满足微生物正常生长代谢的需求,并起到承载微生物的作用。混合凝胶粉与培养基分别按1∶2,1∶1,2∶1的质量比混匀制成培养基凝胶。由表5可知,在37 ℃下不同时间点的pH基本保持稳定并成中性,表明培养温度、混合比例和培养时间的改变对pH影响不大。
而在37 ℃恒温培养24 h后,按照上述混合比例制作的培养基凝胶的物性、透光度、成胶效果和菌落生长状况均有较大的差异(表6),其中随着混合胶粉比例的增加,培养基凝胶物性指标和透光度都相应地提高,以质量比2∶1制备的培养基凝胶在物性指标和透光度上显著优于其他2组。此外虽然制作的培养基凝胶均能在5 min内凝固成胶,但在37 ℃ 下培养24 h后,以1∶1,1∶2质量比制备的培养基凝胶出现了部分融化,严重影响菌落生长。而以2∶1质量比制备的培养基凝胶仍然保持凝固状态,整体透明度好且菌落生长正常、分布均匀易于计数。因此,以混合凝胶粉与培养基按质量比2∶1混合为最优。
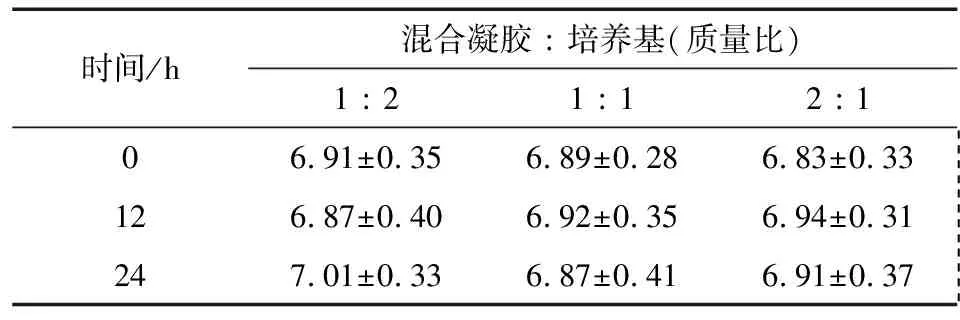
表5 37 ℃恒温培养期间凝胶的pHTable 5 pH of gel during cultivation (n=3)
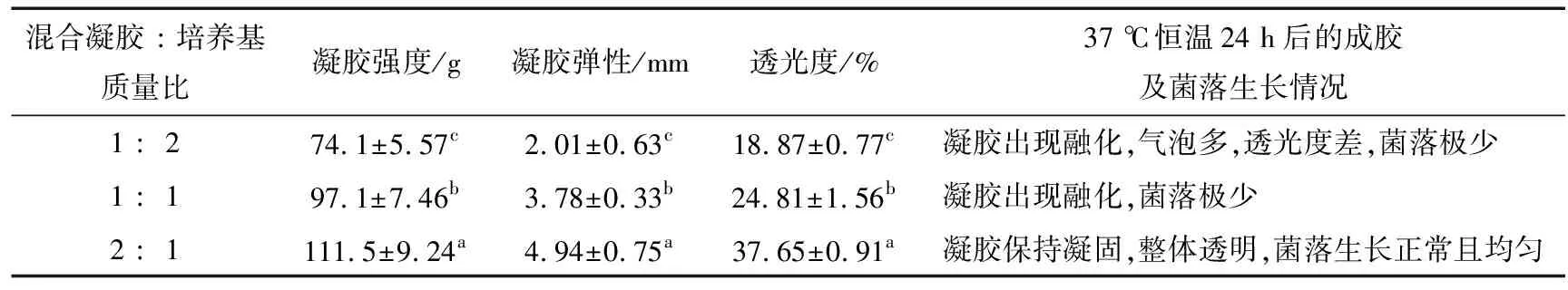
表6 不同比例凝胶的物理特性及菌落生长情况†Table 6 Physical properties of different proportions of gels and colony growth (n=3)
† 同列不同字母表示差异显著(P<0.05)。
2.4 TTC的含量优化
TTC对菌落的显色相对于其他显色剂更为灵敏准确,而且在常温下它与菌落形成的颜色在空气中十分稳定,可以保存较长时间,方便计数。但其浓度对微生物生长却有显著影响,需要对其使用浓度进行优化[20]。
如表7所示,当TTC浓度在0.025 mg/mL以下时,菌落生长分布均匀且与对照组无显著差异;但TTC浓度超过0.030 mg/mL 时,菌落数量显著低于对照组,表明微生物的生长受到抑制。而当TTC浓度为0.025 mg/mL时对菌落的染色比0.020 mg/mL更加清晰可辩,暴露在空气中也更加稳定。因此,以TTC在培养基中实际浓度0.025 mg/mL为最优加入量。

表7 TTC浓度对菌落总数的影响†Table 7 Total number of colonies at different concentrations of TTC (n=3)
† 同行不同字母表示差异显著(P<0.05)。
2.5 与平板法的检测比较
采用最优条件的测试卡片法与倾注培养法进行对比,发现二者在菌落生长的形态上无明显差异。由表8可知,2种方法在各稀释浓度上的菌落计数结果并无显著差异。

表8 2种不同方法的菌落数Table 8 Number of colonies in two different ways (n=3) CFU/mL
3 结论
采用卡拉胶和CMC在2∶1的质量比下制成混合凝胶剂,再与培养基粉以2∶1的质量比混合制成的凝胶培养基用于制备菌落总数测试卡片具有较好的效果,在TTC浓度为0.025 mg/mL时,菌落显色效果最佳且不会对细菌生长产生抑制作用。在该条件下采用测试卡片法与倾注培养法对微生物菌落总数的检测结果无显著差异。
[1] 姚景慧, 崔生辉, 付萍, 等. 菌落总数检测纸片的比较试验[J]. 中国食品卫生杂志, 2000(3): 76-77.
[2] 程金权, 胡继贵. 食品中菌落总数快速检测研究进展[J]. 食品与发酵科技, 2014, 50(6): 1-5.
[3] 熊海燕. 菌落总数检测技术研究进展[J]. 粮食与油脂, 2010(4): 42-44.
[4] HAWRONSKYJ Jane-marie, HOLAH John. ATP: a universal hygiene monitor[J]. Trends in Food Science & Technology, 1997, 8(3): 79-84.
[5] 孙永. 食品卫生微生物快速测试卡的研制[D]. 武汉: 中国科学院武汉病毒研究所, 2007: 15-21.
[6] SCHOELLER N P, INGHAM S C. Comparison of the Baird-Parker agar and 3M TM Petrifilm TM rapid S. aureus count plate methods for detection and enumeration of Staphylococcus aureus[J]. Food Microbiology, 2001, 18(6): 581-587.
[7] 孙永. 微生物快速测定卡凝胶剂性能初步研究[J]. 中国卫生检验杂志, 2007, 17(3): 419-421.
[8] 王静. 以冷水溶性凝胶为载体的细菌快速检测纸片的凝胶剂优化[J]. 卫生研究, 2012, 41(2): 300-302.
[9] WILLIAMS M G, HESSELROTH K E, RAJAGOPAL R. Device for propagation and storage of microorganisms: US, 6649406[P]. 2003-11-18.
[10] 王少鹏, 刘艳丽, 冯冲, 等. 食品添加剂聚丙烯酸钠的合成工艺研究[J]. 安徽农业科学, 2011, 39(12): 7 095-7 096.
[11] 吴许文. 食品卫生微生物培养基冷水可凝胶HKG的研究和应用[D]. 武汉: 中国科学院武汉病毒研究所, 2009.
[12] 中华人民共和国卫生部, 中国国家标准化委员会. GB/T 4789.2—2008食品卫生微生物学检验 菌落总数测定[S]. 北京: 中国标准出版社, 2009: 11-21.
[13] 陈晓珑, 董煜, 陈灿映, 等. 大肠菌群测试片中冷水可凝凝固剂初步研究[J]. 河南工业大学学报: 自然科学版, 2013, 34(1): 77-81.
[14] 吴许文, 吴清平, 张淑红, 等. 细菌测试片的冷水可凝凝固剂初步研究和应用[J]. 微生物学通报, 2009, 36(11): 1 783-1 788.
[15] 王晓文, 张俊伟. TTC应用于食品菌落总数测定的研究[J]. 辽宁大学学报: 自然科学版, 2011, 38(1): 86-89.
[16] 曹杨. 纸片法测定细菌总数——TTC显色浓度试验[J]. 江苏食品与发酵, 2008(4): 39-40.
[17] 刘睿哲. 食品菌落总数测定中TTC做显色剂的探索[J]. 产业与科技论坛, 2011, 10(20): 64-65.
[18] 贾振宇, 崔英德, 黎新明, 等. 聚丙烯酸钠高吸水性树脂的改性研究进展[J]. 化工进展, 2004, 23(5): 468-471.
[19] 王静, 陈萍, 任常菲. 以冷水溶性凝胶为载体的细菌快速检测纸片的凝胶剂优化[J]. 卫生研究, 2012, 41(2): 300-302.
[20] 廖茂彬, 陈向标, 赖明河. 食品中菌落总数的国标法测定注意事项及微生物快速测试卡法检测[J]. 中国食品与营养, 2013, 19(7): 16-18.

