新疆哈萨克族奶酪产脂肪酶酵母菌的筛选及产酶条件优化
刘 飞U Fei 郑晓吉, -, 李宝坤 - 史学伟 - 董 娟 李开雄 - 诸葛斌-
(1. 石河子大学食品学院,新疆 石河子 832003;2. 江南大学生物工程学院,江苏 无锡 214122)
脂肪酶是一类非常重要的水解酶,在食品工业上应用非常广泛,能将甘油三酯水解成甘油二酯、甘油一酯、脂肪酸和丙三醇,通过催化非水介质中的酯化反应、相互酯化反应和转酯作用,增加食品的风味与香味[1]。目前工业脂肪酶主要从微生物中获取[2],这种方法的原料资源丰富,生产不受自然环境影响,可大量生产且周期短,生产成本低,经济又实用[3]。在自然界中约有65个属的微生物产脂肪酶,其中有28个属来源于细菌,4个属来源于放线菌,10个属来源酵母菌,其它23个属来源于真菌[4]。现已工业化应用的脂肪酶产生菌主要有芽孢杆菌(Bacillus)、大肠杆菌工程菌[5]、无色杆菌(AchromoBacter)、假单细胞菌(Pseudomonas)和伯克霍尔德氏菌属(Burkholderia)[6]。微生物脂肪酶发现于20世纪初,中国在此方面的研究起步较晚,最早投入生产的产脂肪酶菌株是1967年由中科院微生物所筛选到的解假丝酵母AS2.1203,最早的科研报道为施巧琴[7]、黄建中[8]、吴松刚[9]等对碱性脂肪酶的筛选及应用研究。现今对产脂肪酶微生物的研究越来越多,吴厚军等[10]对华根酶(Rhizopus5chinensis)定向改造使其在巴斯德毕赤酵母(Pichiapastoris)中表达突变酶D190V,使该酶的热稳定性得以提高;Fang等[11]研究了细毛嗜热霉脂肪酶(TLL)基因在P.pastorisGS115菌株中的表达。目前,对新疆哈萨克族奶酪样品中产脂肪酶酵母菌筛选并应用于奶制品风味改善方面研究较少。
新疆哈萨克族奶酪营养丰富,均为靠经验手工制作,奶酪中奶臭味等特殊风味不能被广泛的消费者所接受,奶酪制品风味物质形成机制不明晰、风味品质不稳定等已成为产品标准化生产的瓶颈。脂肪酶在奶酪中能降解脂肪为游离脂肪酸,并将其分解成乙酯、丙酮等呈味物质[12],能提高奶酪熟化过程中的风味、增加香气。因此本研究以新疆不同地域的哈萨克族奶酪为研究对象,分离筛选出产脂肪酶酵母菌,并对其产酶条件进行优化,旨在为传统自然发酵奶酪实施微生物控制、风味强化和品质提升提供理论参考依据。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 样品的采集
奶酪样品主要采集于北疆哈萨克族聚居地区:和布克赛尔(S)、伊宁(Y)、昭苏(Z)、木垒(L)、吉木乃(N)、巴里坤(B)、阿勒泰(A)、可可托海(K)、那拉提(T)。每地采集5块奶酪,用保鲜袋封装后贴上标签放入-4 ℃的车载冰箱内保藏,18 h内运回实验室,在4 ℃下冷藏。
1.1.2 主要试剂与设备
高速离心机:TGRL-16M型,上海上天精密仪器有限公司;
摇床:ZD-3型,天津顺吉科技有限公司;
恒温培养箱:LRH-250F型,上海善志仪器设备有限公司;
光学显微镜:XSP-10C型,陕西天平仪器设备有限公司;
电磁搅拌器:85-2A型,金培市城东新璃仪器厂;
pH计:PHS-3E型,上海科晓科学仪器有限公司;
紫外分光光度计:UV1800型,上海奥析科学仪器有限公司;
PCR扩增仪:TC-512型,英国Techne公司;
立式电热压力蒸汽灭菌锅:LD2X-30KA型,上海申安医疗器械厂;
对硝基苯酚丁酸酯:分析纯,无锡中坤生化科技有限公司;
罗丹明B:分析纯,湖北广奥生物科技有限公司;
橄榄油乳化液:化学纯,国药集团化学试剂有限公司。
1.1.3 培养基
富集培养基:酵母浸粉6 g,KH2PO41 g,Na2HPO42 g,NaCl 0.5 g,MgSO4·7H2O 1 g,橄榄油10 mL/L,pH 6.0,水1 000 mL;
发酵(YPD)培养基:葡萄糖10 g,胰蛋白胨10 g,酵母浸粉5 g,KH2PO46 g,K2HPO42 g,MgSO4·7H2O 1 g、橄榄油乳化液120 mL/L,水1 000 mL;
LB斜面培养基:蛋白胨10 g,酵母浸粉5 g,氯化钠10 g,琼脂粉20 g,水1 000 mL;
分离培养基:按文献[13]制备;
罗丹明B培养基:按文献[14]制备。
1.2 方法
1.2.1 菌种的富集 将块状的奶酪样品用研钵捣、碾粉碎,使碎小颗粒直径<0.5 mm。称取5 g样品,溶入盛有50 mL无菌水的锥形瓶内,摇匀后置于35 ℃、180 r/min的摇床上振荡6 h,待瓶内的溶液静置分层,取5 mL上清液加入到盛有50 mL液体富集培养基的锥形瓶中,再置于35 ℃、175 r/min 的摇床内振荡培养24 h,进行富集培养。
1.2.2 初筛 配制分离培养基,在121 ℃下灭菌20 min,用移液枪移取1 mL富集后的菌液加到装有9 mL无菌水的试管中,稀释为10-1。再取6支装有9 mL无菌水的试管,分别稀释至10-2,10-3,10-4,10-5,10-6,10-7,移取200 μL不同浓度的菌液加入到分离培养基平板中。涂布均匀后放入35 ℃的培养箱中,培养48 h。将生长状况良好的菌株纯化后,采用牛津杯法接种到罗丹明B培养基中,35 ℃下培养48 h,在紫外灯照射下观察水解圈,将水解圈直径较大且有橙色荧光圈的菌落挑出来,-20 ℃下冷藏保存于LB斜面培养基中,待复筛测酶活时使用。
1.2.3 复筛 将初筛中水解圈直径较大单菌落转接到20 mL 液体富集培养基中,在30 ℃、160 r/min摇床中培养1 d,用移液枪吸取活化后的菌液(106CFU/mL)2 mL转接到20 mL发酵培养基中,在30 ℃的摇床中培养48 h,取5 mL 培养液于离心管中,于5 000 r/min离心10 min,取上层清液用于对硝基苯酚法测定酶活,按酶活力大小筛选出产脂肪酶能力较强的菌株。
1.2.4 菌种鉴定
(1) PCR扩增及测序:参考文献[15]的方法提取菌株总DNA。PCR扩增26S rDNA D1/D2区基因:采用酵母菌通用引物NL1(5′-GCA TAT CAA TAA GCG GAG GAA AAG-3′)和NL4(5′-TCC TCC GTC TAT TGA TAT GC-3′)[16]对26S rDNA D1/D2区基因片段进行PCR扩增。
扩增条件:95 ℃预变性5 min,94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸30 s,1 min循环36次,72 ℃延伸10 min。将扩增后的PCR产物经过1.2%琼脂糖凝胶电泳确认扩增效果和片段大小,电压为100 V,使用Marker 1进行标注。PCR产物用EZ-10 column纯化后送往上海生工生物科技有限公司进行测序。
(2) 菌悬液的制备:将筛选出的产脂肪酶菌株接种到装有50 mL液体分离培养基的锥形瓶中,在摇床上培养12 h,以4 000 r/min离心30 s。将上层清液弃去,用无菌生理盐水洗涤沉淀菌体2~3次,震荡30 min。用平板活菌计数法将菌悬液浓度调整为106CFU/mL。
(3) 酶活力测定:酶活力的大小或酶的反应速度,通常用酶在反应过程中底物的减少量或产物的增加量来表示。由于不同链长的对硝基苯酚酯类水解时,吸光值在410 nm处会发生变化,所以使用分光光度计测定酶反应过程中反应物或产物吸光值的变化,进而对脂肪酶活力的大小进行定量。根据文献[12]的方法进行脂肪酶活力的测定,以吸光度值为横坐标(X)、p-NP总量为纵坐标(Y)绘制标准曲线,并计算出相关线性方程:Y=0.410 9X+0.001 2(R2=0.999 7)。酶活按式(1)计算:
(1)
式中:
M—— 酶活,U/mL;
n—— 酶液的稀释倍数;
a、b—— p-NP 标准曲线公式中的系数;
A——反应后OD410 nm下吸光度值;
A0——初始OD410 nm下吸光度值。
1.2.5 温度对菌株产酶的影响 在pH 7.0、接种量2%条件下,分别设置不同温度26,28,30,32,34,36 ℃,吸取1 mL离心后的菌悬液接种到装有50 mL发酵培养基的150 mL锥形瓶中,在175 r/min摇床上培养12 h后,测定菌株产脂肪酶活力。
1.2.6 pH对菌株产酶的影响 在30 ℃、接种量2%条件下,分别调节pH值为5.5,6.0,6.5,7.0,7.5,8.0,8.5。吸取1 mL 菌悬液(106CFU/mL)接种到装有50 mL发酵培养基的150 mL 锥形瓶中,在175 r/min的摇床上培养12 h后,测定不同pH值下菌株产脂肪酶活力。
1.2.7 接种量对菌株产酶的影响 接种量的大小直接影响菌株的发酵速率。在30 ℃、pH 7.0条件下,分别吸取1.0%,1.5%,2.0%,2.5%,3.0%,3.5%,4.0%菌悬液接种到装有50 mL 发酵培养基的150 mL锥形瓶中,在175 r/min的摇床上培养12 h后,测定不同接种量下菌株产脂肪酶活力。
2 结果与讨论
2.1 产酶酵母菌菌株鉴定
2.1.1 产酶酵母菌菌株的筛选 在酵母菌进行富集培养、初筛、纯化复筛后,得到4株产脂肪酶能力较强的酵母菌见表1,编号分别为Y-2、Z-5、S-6、N-5,产脂肪酶能力见图1,菌株Z-5的水解光圈最大,其酶活力也最大。并对这4株酶活最高的菌株进行了生理生化分析、分子鉴定及后续的产酶条件优化。
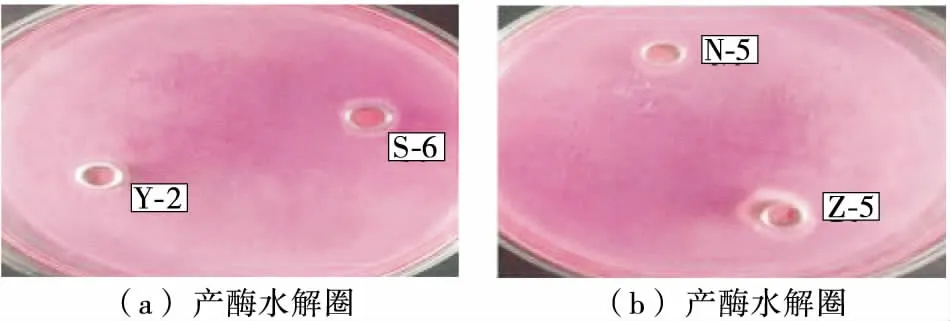
图1 产酶酵母菌菌株的筛选结果Figure 1 Enzymatic abilities results of the yeast isolates
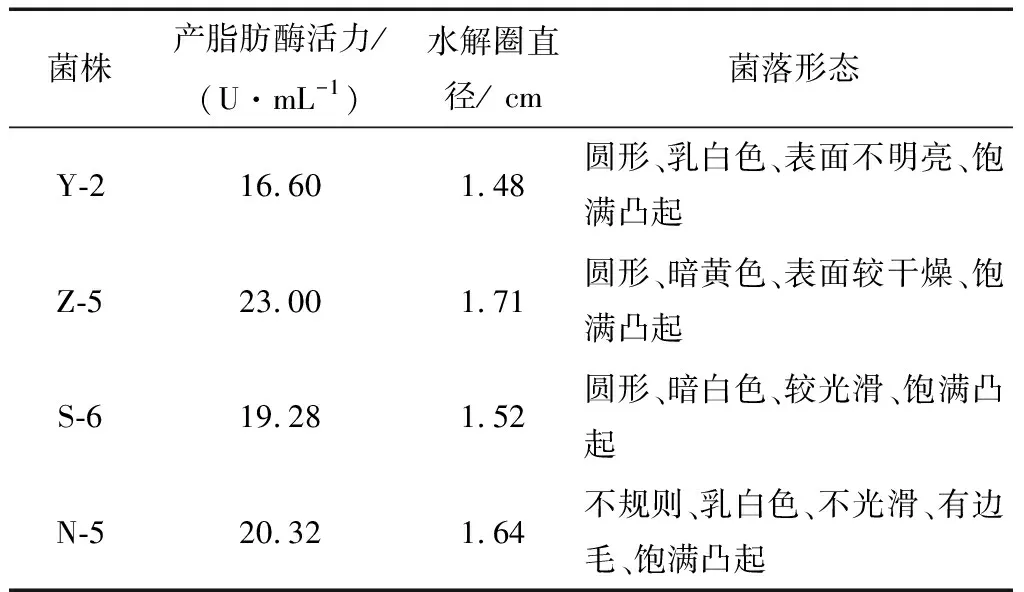
表1 菌株筛选结果Table 1 Strain screening results
2.1.2 26S rDNA测序及产酶特性 对这4株酵母菌株的26S rDNA基因序列进行测定后在Blast中对比,结果见表2,使用MEGA 5软件中的Neighour-Joining法构建系统发育树[17-18],见图2。发现Y-2、Z-5这2株菌种都属于Kl.marxianus,N-5属于Kl.lactis,S-6则属于P.kudriavzevii。
2.1.3 酶活测定 标准曲线的绘制见图3。通过测定酵母菌在培养基内发酵液中的胞外酶,来确定酶活力的大小。分别将4株酵母菌接种到发酵培养基中,在pH 7.0、接种量2.0%、装液量50 mL/150 mL、培养温度30 ℃、摇床转速175 r/min、培养时间12 h,将410 nm处的吸光值代入式(1),得出各菌株的产脂肪酶的活力:Y-2酶活16.60 U/mL,S-6酶活19.28 U/mL,N-5酶活20.32 U/mL,Z-5酶活23.00 U/mL。
2.2 温度对菌株产酶的影响
在不同温度下Z-5菌株产脂肪酶活力的变化见图4。当温度为27~30 ℃时,菌株的生长代谢反应速率持续加快,不断消耗培养基内的养分进行产酶,菌株的产脂肪酶能力随着温度升高逐渐增大。在温度达到30 ℃时,菌株的产酶能力达到最大,累积产酶量最多,此时的脂肪酶也达到最适存活温度,所以酶活力达到最高峰值,为23.65 U/mL;当温度大于30 ℃时,由于温度过高会使酶变性失活,且培养基内养分被消耗过多,菌株产酶能力逐渐下降,导致总体酶活力开始下降。酶活力随着温度的升高而不断降低,当温度达到36 ℃ 时酶活力下降到最低。由此可知,当发酵温度为30 ℃,Z-5菌株的产酶能力最佳,且产出的酶能够保持最高的活力。
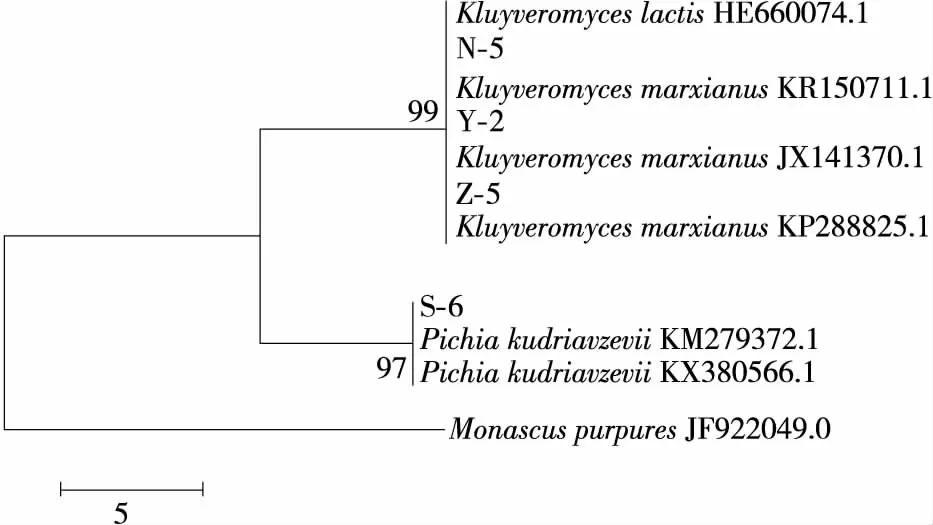
图2 基于26S rDNA序列的系统发育树Figure 2 Phylogenetic tree based on 26S rDNA sequence

表2 26S rDNA测序结果Table 2 26S sequencing of rDNA
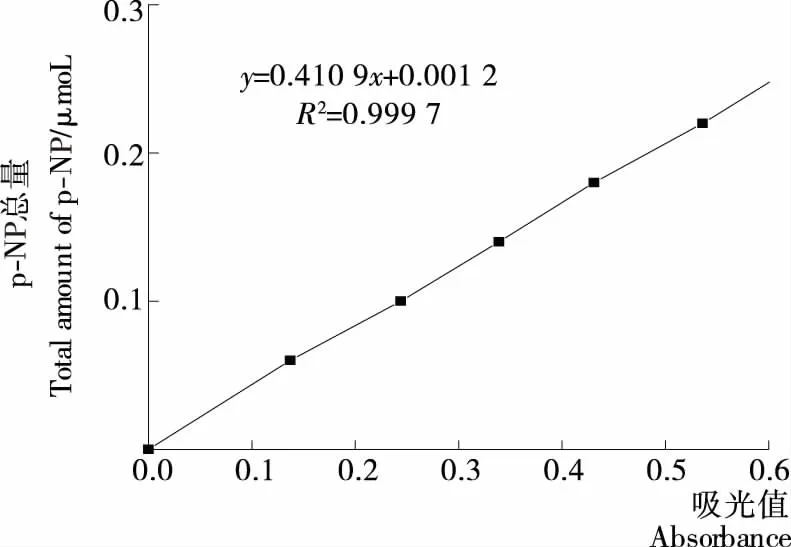
图3 标准曲线Figure 3 Standard curve line
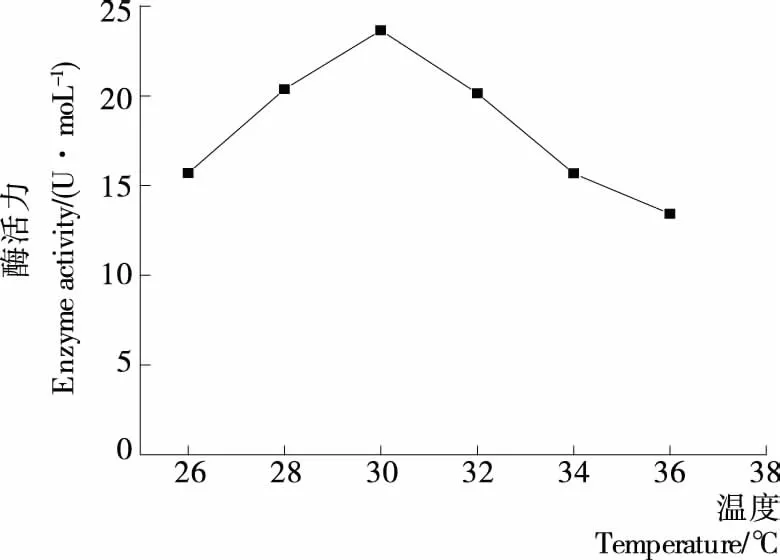
图4 温度对产酶的影响Figure 4 Effect of temperature on enzyme production
2.3 pH对菌株产酶的影响
pH的改变能影响酶活性中心上必须基团的解离程度,同时也可以影响底物和辅酶的解离程度,从而影响酶分子对底物分子的结合和催化。pH过高或过低都会是酶变性失活,只有在最适的pH下,酶、底物和辅酶的解离状态,才最适宜它们相互结合,并发生催化作用,从而使酶的反应速度达到最大值。不同pH值下Z-5菌株产脂肪酶活力的变化情况见图5,当发酵培养基的初始pH为5.5~7.5时,菌株的酶活力与pH呈正相关,产脂肪酶的活力随pH的上升而增加。在pH为7.5时,产酶能力最强,酶活力最高(23.76 U/mL);pH为7.5~8.0时呈缓慢下降趋势,超过8.0之后迅速下降。因此,Z-5菌株的产酶最佳pH值为7.5。
2.4 接种量对菌株产酶的影响
接种量对Z-5菌株产脂肪酶活力的影响见图6。接种量主要影响酶的催化速率,在1.0%~2.5%时,随着接种量的梯度式增加,菌株数量不断增多,能够充分利用培养基内充足的养分,使菌株的生长代谢加快,是产酶效率的加速上升期,此时酶活力值迅速增加。当接种量为2.5%时,培养基内的养分与菌株数量达到均衡饱和状态,产酶效率最快,产酶量最多,酶活最大,为25.99 U/mL;当接种量超过2.5%时,再增加接种量时菌株的产酶活力并无增加,反而呈平缓下降的趋势,是因为此时培养基内的养分供给不足,影响产酶速率。因此,得出Z-5菌株产脂肪酶的最佳接种量为2.5%。
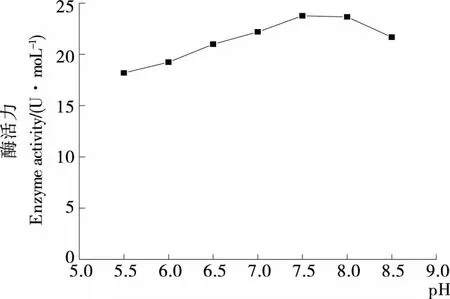
图5 pH对产酶的影响Figure 5 Effect of pH on enzyme production
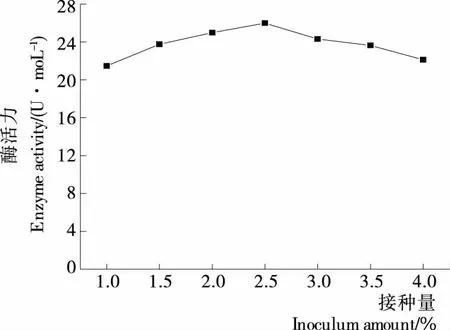
图6 接种量对产酶的影响Figure 6 Effect of inoculation amount on enzyme production
3 结论
从新疆地区采集的哈萨克族特色奶酪中得到100多株菌种,经筛选后得到4株产脂肪酶酵母菌(Y-2、S-6、Z-5、N-5)。对这4株酵母菌进行26S rDNA测序,发现Y-2、Z-5、N-5都属于K.marxianus,其中N-5为K.lactis,S-6则属于P.kudriavzevii。对4株菌进行产脂肪酶酶活测定,发现Z-5菌株酶活力最强,为23.00 U/mL,以Z-5菌株为样本,对其产酶条件进行单因素优化试验,当温度达到30 ℃、pH 值7.5、接种量2.5% 时,为最优产酶条件,其酶活性最高为25.99 U/mL,与胡珺[19]、黎小军[20]等优化的产脂肪酶菌种结果相近,优化较成功。K.marxianusZ-5可以初步作为风味酵母菌,进一步研究其酶学性质以及模拟奶酪发酵,探究其对奶酪风味的改善,可为改善新疆哈萨克族奶酪风味提供理论依据。
[1] 曹茜, 冯凤琴. 微生物脂肪酶的研究进展及其在食品中的应用[J]. 中国食品学报, 2013, 13(10): 137-141.
[2] ZHANG Tong, WU Zhen-fang, CHEN Hui, et al. Progress in strategies for sequence diversity library creation for directed evolution[J]. African Journal of Biotechnology, 2011, 9(54): 9 277-9 285.
[3] 张晶晶, 刘金峰, 牟伯中, 等. 产脂肪酶菌株筛选及柠檬酸杆菌产酶条件优化[J]. 微生物学杂志, 2015, 35(2): 85-89.
[4] 赵春雷, 闫丽娟, 谢振荣, 等. 一株耐热脂肪酶产生菌的筛选及酶学性质研究[J]. 生物技术通报, 2010(2): 184-188.
[5] MO Qiu-run, LIU Ai-li, GUO Hai-lun, et al. A novel thermostable and organic solvent-tolerant lipase from Xanthomonas oryzae pv. oryzae YB103: screening, purification and characterization[J]. Extremophiles, 2016, 20(2): 157-165.
[6] GUPTA N, SAHAI V, GUPTA R. Alkaline lipase from a novel strain Burkholderia multivorans: Statistical medium optimization and production in a bioreactor[J]. Process Biochemistry, 2007, 42(4): 518-526.
[7] 施巧琴, 陈若莹, 许晴怡, 等. 醋酸钙不动杆菌产生的耐热碱性脂肪酶的研究[J]. 微生物学报, 1992, 32(6): 425-431.
[8] 黄建忠, 施巧琴, 郑毅, 等. 中温碱性脂肪酶的研究Ⅰ:高产菌扩展青霉PE868的选育[J]. 工业微生物, 1995, 25(3): 1-5.
[9] 吴松刚, 谢新东, 黄建忠, 等. 类产碱假单胞菌耐热碱性脂肪酶的研究[J]. 微生物学报, 1997, 37(1): 32-39.
[10] 吴厚军, 喻晓蔚, 沙冲, 等. D190V点突变提高华根霉Rhizopus chinensis CCTCCM201021脂肪酶的最适温度和热稳定性[J]. 微生物学通报, 2013, 40(11): 1 955-1 961.
[11] FANG Zhong-gang, XU Li, PAN Du-jie, et al. Enhanced production of Thermomyces lanuginosus lipase in Pichia pastoris via genetic and fermentation strate-gies[J]. Journal of Industrial MicroBiology & Biotechnology, 2014, 41(10): 1 541-1 551.
[12] 孙宏丹, 孟秀香, 贾莉, 等. 微生物脂肪酶及其相关研究进展[J]. 大连医科大学学报, 2001, 23(4): 292-295.
[13] 董娟. 冰川低温酯酶产生菌的选育、基因克隆表达及在奶味香基制备中的应用[D]. 无锡: 江南大学, 2016: 10-15.
[14] KIM E K, JANG W H, KO J H, et al. Lipase and its modulator fromPseudomonassp. strain KFCC10818:proline-to-glutamine substitution at position 112 induces formation of enzymatically active lipase in the absence ofthe modulator[J]. Journal of Bacteriology, 2001, 183(20): 5 937-5 941.
[15] OGINO H, HIROSHIMA S, HIROSE S, et al. Cloning, expression and char-acterization of a lipase gene(lip3)fromPseudomonasaeruginosaLST-03[J]. Mol Gen Genomics, 2004, 271: 189-196.
[16] LARBIDAOUADI K, BENATTOUCHE Z, ABBOUNI B. Sc-reening selection identification production and optimization of bacterial lipase isolated from industrial rejection of gas station[J]. Research Journal of Biotechnology, 2015, 10(4): 21-25.
[17] 苏二正, 吴向萍, 高蓓, 等. 短小芽孢杆菌脂肪酶基因的克隆、表达及酶学性质研究[J]. 生物技术报, 2014(4): 132-138.
[18] ZENG Cheng, ZHAO Rong-bin, WEN Xue-fang, et al. Screening and identification of a Bacillus amyloliquefaciens strain for aqueous enzymatic extraction of medium-chain triglycerides[J]. Food Control, 2017, 78: 24-32.
[19] 胡珺, 杜新凯, 王常高. 产脂肪酶菌株的筛选鉴定及产酶条件优化[J]. 中国酿造, 2016, 35(11): 39-43.
[20] 黎小军, 谢莲萍, 刘建宏. 产脂肪酶菌株的筛选、鉴定与产酶条件优化[J]. 江西师范大学学报, 2014, 38(1): 14-17.

