水稻籽粒中镉的来源
喻华,上官宇先,涂仕华,秦鱼生,陈琨,陈道全,刘前聪
水稻籽粒中镉的来源
喻华1,3,上官宇先1,3,涂仕华1,秦鱼生1,3,陈琨1,3,陈道全2,刘前聪2
(1四川省农业科学院土壤肥料研究所,成都 610066;2四川省广汉市农业技术推广站,四川广汉 618300;3农业部南方坡耕地植物营养与农业环境科学观测实验站,成都 610066)
【目的】深入探讨水稻籽粒中镉(Cd)的来源及其与生长环境中Cd供应强度的关系,为稻米Cd污染防控选用恰当的农艺措施和实施时间提供科学依据。【方法】在水稻齐穗期,从Cd污染稻田选取长势一致的水稻植株,分别移入含不同Cd浓度(0、0.2、0.5 mg·L-1)的营养液盆钵中培养,成熟期分别收获各器官测定生物产量和Cd含量;在大田自然条件下生长的水稻分别在齐穗期、灌浆期、腊熟期和成熟期采集长势均匀一致的植株样本测定生物产量和Cd含量。【结果】在营养液中不含Cd(Cd 0处理)的条件下,籽粒中累积的Cd主要来自于根系和茎秆在齐穗前累积的Cd。在齐穗后的生长环境中存在较低有效镉的情况下(即Cd污染稻田自然生长的植株),籽粒中的Cd则同时来自水稻齐穗前各器官累积的Cd和根系从土壤吸收与直接运输的Cd;水稻叶片和谷壳是水稻齐穗后向籽粒净转移Cd的器官,茎秆和根系既是籽粒Cd的源,也是Cd的净累积器官。而在生长介质有效镉含量丰富的情况下(即Cd培养试验处理中的Cd 0.2和Cd 0.5处理),籽粒中的Cd则主要来自生长介质,少部分来自水稻各器官的转移。【结论】籽粒中的Cd来自齐穗前各器官储存Cd的转移和土壤/介质中Cd的吸收和直接运输,土壤/介质中的可利用Cd含量越高,籽粒含Cd量也越高;只有当土壤/介质中不存在可利用Cd时,水稻各器官中储存的Cd才是籽粒中Cd的唯一来源;水稻各器官中,茎秆和根系是体内Cd的主要储存和输出场所。结合水稻生长早期降Cd措施的基础上,在水稻抽穗-成熟期采取恰当的农艺措施降低土壤中Cd的有效性以及根系吸收和向籽粒的直接运输量,就能有效降低稻米中的Cd含量。
水稻籽粒;镉;来源;污染
0 引言
【研究意义】镉(Cd)是生物毒性最强的重金属之一[1]。一旦土壤受到Cd污染,就很难消除,只能在各种形态之间相互转化、迁移或富集[2]。当植物体内的Cd浓度增加到某一数值,植物就会受到毒害,造成细胞膜通透性增加,细胞被破坏,呼吸作用和光合作用受到影响,从而影响植物的生长[3-7]。土壤中的Cd由于具有较强的化学活性而易被植物吸收。在植物收获器官中的Cd经过食物链的传递进入人体,在人体组织器官中累积,使其受不同程度的损伤,包括致癌、突变、致畸、动脉硬化等毒性作用,危害人类健康[8-10]。【前人研究进展】水稻品质优劣直接关系着人类的健康。FUJIMAKI等[11]利用107Cd同位素的研究表明,水稻灌浆期从土壤中吸收的Cd仅需半天时间就被运送到籽粒,韧皮部运输起到关键作用;而KASHIWAGI等[12]的研究则认为,水稻籽粒中的Cd主要来自抽穗前累积在叶片和茎秆中的Cd,在抽穗后被转运到籽粒中,而抽穗后从根运送到茎秆和穗部的Cd直接进入气生器官(除糙米以外地上部器官),而不影响糙米中Cd的累积。【本研究切入点】国内外科学工作者在Cd污染水稻生理生化毒害机理方面取得了一定的进展[13-18],对水稻籽粒中累积Cd的来源与吸收机理研究较多[19-21]。但由于条件不同,结果不一致。进入水稻籽粒中的Cd是由地上部分转移而来,还是从土壤中吸收直接运送而来,或者两者皆有,现有研究报道较少。【拟解决的关键问题】本研究探讨水稻灌浆后籽粒中Cd的来源,为水稻Cd污染防控选用恰当的农艺措施和实施时间提供科学依据。
1 材料与方法
1.1 试验材料
供试作物:水稻,品种为Ⅱ优838,由四川省原子核应用技术研究所选育。
水稻采样田的位置和与试验研究的相关土壤性质:试验用水稻种植在广汉市连山镇锦花村。土壤为老冲积黄壤与紫色土坡积物混合物发育而成的水稻土。土壤pH 7.1,有机质34.4 g·kg-1,速效氮64.45 mg·kg-1,速效磷19.7 mg·kg-1,速效钾98 mg·kg-1,全镉0.68 mg·kg-1,有效镉0.12 mg kg-1,属于Cd污染土壤。水培试验于2015年5月在四川省农业科学院土壤肥料研究所盆栽场进行。
1.2 试验设计
水培试验:设3个Cd浓度处理,分别为0、0.2和0.5 mg·L-1,重复3次。试验用营养液采用国际水稻研究所常规营养液配方[22]。其中,氮、磷、钾浓度分别为100、30、150 mg·L-1,Cd用分析纯CdCl2,在水稻植入时加入营养液。水培盆钵为陶瓷盆(D20 cm×H26 cm),每盆加营养液5 L。在水稻齐穗期,从广汉市Cd污染稻田取长势一致的水稻植株12窝,带回后用自来水冲洗根部,去除泥污。3窝直接用于水稻齐穗期植株Cd含量分析,然后把9窝分别移入已备好的盛有营养液含3个Cd浓度处理的盆钵中,每个处理1窝,重复3次;培养至成熟期,收获不同处理植株样本作分析用。
田间试验:从水稻齐穗期开始至成熟期,在籽粒形成过程中每隔9 d从同一稻田随机取长势一致的水稻植株3窝,连续取样4次,分别是8月1 日(齐穗期);8月10日(灌浆期);8月19日(腊熟期);8月28日(成熟期)。每次取样后,洗净泥土,装入尼龙网袋中,晾干后置于烘箱于105℃杀青30 min,65℃下干燥,分析不同器官中Cd含量。
1.3 测定项目与方法
水稻样品分为根、叶片、茎、谷壳和糙米5部分收集,分别称重。样品经磨碎过40目尼龙筛,测定其Cd含量。采用HNO3-HClO4湿法消煮,同时消煮空白和标准样品(GBW10010)进行质量控制和结果校正,用石墨炉原子吸收光谱仪(novAA400-德国耶拿)测定Cd含量[23]。水稻植株Cd吸收量=植株生物量×植株Cd浓度。
1.4 数据处理
采用Microsoft Excel和DPSv6.55进行有关数据的计算和统计检验。
2 结果
2.1 不同取样时间水稻器官干重的变化
从水稻齐穗期至成熟期,田间样品的籽粒干重不断增加,在成熟期达到最大值,为35.98 g/ plant(表1)。在此期间,水稻茎秆、叶和根的重量变化趋势与籽粒相反,为不断减少。其中茎秆的重量减少最为显著,从齐穗期至腊熟期其重量差异达到显著水平。而谷壳在不同时期的变化不大,基本保持稳定。这些结果表明,齐穗前累积在这些器官(主要是茎和叶)中的光合产物在齐穗后源源不断地向籽粒运输,而其重量不断减轻。
在水培样中,添加浓度为0.2和0.5 mg·L-1的Cd后其糙米、谷壳、茎秆、叶、根重量比CK下降,但差异不显著。除Cd 0.5处理的茎秆重比Cd 0.2处理高0.57 g/plant外,Cd 0.5处理的其他4个组织器官的干重都略低于Cd 0.2处理。0.2和0.5 mg·L-1的浓度对水稻各器官生长的影响不大,可能是因为水稻移至营养液时已至齐穗期,各器官的生长已基本完成,对Cd毒性的敏感性降低之故。
2.2 齐穗后稻谷籽粒中Cd累积与来源
表2表明,在田间条件下,籽粒中Cd浓度随生长趋于成熟期而不断降低,而累积量却增加。浓度降低主要是由于籽粒充实期间淀粉的累积速度大于Cd 的累积速度,产生稀释效应,这一效应在齐穗后的前9—18 d,即腊熟期最为明显(-21.85%);而Cd累积高峰期也处于齐穗后9—18 d(+145.92%),腊熟期后淀粉的累积速率降低。
在水培试验中,水稻籽粒中的Cd浓度和累积量随培养液Cd浓度的增加而显著增加。与Cd 0处理相比较,强制加入速效外源Cd后使稻米中Cd的吸收量成倍增加,Cd 0.2和Cd 0.5处理分别增加了688.97%和916.11%,说明介质中可利用Cd的含量高低对稻米Cd累积的重要作用。在田间自然生长条件下,水稻籽粒的Cd含量和累积量都远远小于水培试验的加Cd处理。产生这种差异的原因可能是田间土壤中的有效镉含量在水稻生长后期很低(试验开始时土壤有效镉仅为0.12 mg·kg-1),特别是在根区;而水培试验中的有效镉浓度为0.2—0.5 mg·L-1,并且都是水溶性镉。因此,无论是Cd的供应强度还是容量,水培试验都要远高于田间土壤,自然水培试验就更加有利于水稻对Cd的吸收和累积。

表1 不同取样时间的水稻器官干重
*同列不同小写字母表示< 0.05 水平上差异显著。下同
Different letters after the means in the same column indicate significant difference at< 0.05. The same as below
2.3 水稻其他器官中Cd的累积情况
水稻齐穗-成熟期其他器官中的Cd浓度和累积量变化情况如表3所示。在田间条件下,水稻茎秆中的Cd浓度随生育进程不断上升,而累积量却在齐穗期后上升,腊熟期略有下降,成熟期又有所上升。这说明水稻灌浆-蜡熟期茎秆中光合产物向籽粒的转移率高于Cd,才导致Cd浓度升高和Cd累积量基本不变。齐穗-灌浆期茎秆中的累积的Cd从10.32 µg/plant上升到16.83 µg/plant,而根系中Cd的累积量未见等量降低,说明茎秆在向籽粒转移Cd的同时,还接受来自根系和土壤Cd补充,特别是土壤;腊熟期后茎秆中的Cd停止向籽粒转移。水稻叶片中的Cd浓度和累积量从齐穗期至成熟期一直处于下降趋势,其中灌浆期的下降最快,分别比齐穗期下降了8.55%和19.25%,表明累积在叶片的Cd在齐穗后持续向籽粒中转移。谷壳中的Cd也出现类似的趋势。因而,水稻叶片和谷壳在齐穗期前为Cd的库,而在齐穗后变成了籽粒Cd的源;而茎秆和根系起到库、源并重的角色,特别是灌浆-腊熟期,成熟时Cd基本停止转移。
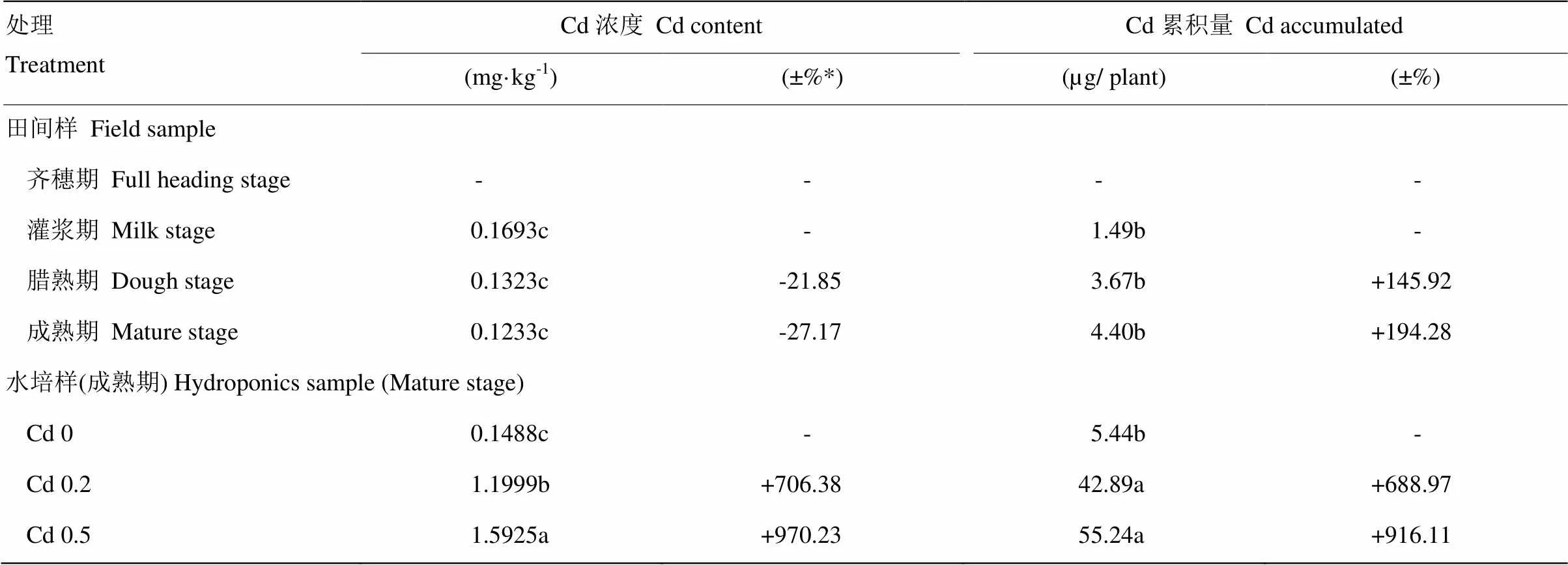
表2 不同处理对齐穗后稻谷籽粒中Cd浓度和累积量的影响
*田间样Cd浓度与Cd累积量的±%是与灌浆期相比较,而水培样(成熟期) Cd浓度与Cd累积量的±%是与Cd 0处理相比较 The increase or decrease percentages (±%) in Cd concentrations and accumulation in the rice samples were compared with those taken from the paddy field at fully heading stage, but in the pot hydroponic experiment they were compared with the treatment Cd 0

表3 水稻齐穗-成熟期其他器官中Cd的分布
在不同Cd浓度的水培试验中,水稻所有器官中的Cd都随处理Cd浓度增加而增加,其中水稻茎秆和根系是水稻储存Cd的两大主要器官,其次是叶片,谷壳中储存的Cd量非常小。因此,当介质中不存在Cd的情况下,即水培试验的Cd 0处理,水稻齐穗后籽粒中累积的Cd主要来自于水稻根和茎,其次是叶片。当介质中存在较高浓度的有效镉(即Cd 0.2和Cd 0.5处理)时,水稻在齐穗期后会大量吸收Cd,并将其运送到水稻籽粒中。该结果表明,控制土壤溶液中有效镉的浓度是降低水稻吸收Cd的关键,特别是在齐穗-成熟期。
2.4 水稻不同器官中Cd的分布
水稻吸收的Cd在不同器官中的分配比例见表4。不难看出水稻根系和茎秆所含的Cd比例最大,在田间样品中二者之和大于86%;在水培样中两个施入外源Cd处理的二者之和大于82%。Cd 0处理的茎秆和根Cd吸收量之和约占65%,糙米和叶片之和占33%。这表明介质中的有效镉含量高低会影响Cd在水稻各器官中的分配比例。当培养介质中有效镉含量较低时(即田间情况),根是水稻Cd的第一大贮存器官。而当介质中有效镉含量较高时(水培试验的Cd 0.2和Cd 0.5处理),水稻茎秆则变为第一储存器官。当介质中的Cd含量为0时(水培试验的Cd 0处理),茎秆为Cd的主要储存器官,并出现糙米中Cd的比例高于任何其他处理的情况。这就解释了为什么在介质中不含Cd(水培试验的Cd 0处理)的情况下成熟期籽粒的Cd浓度和累积量反而高于田间样。产生这种现象的原因可能是因为水培试验的营养和其他生长条件(通透性好,不含有还原性有毒有害物质等)优于田间,有利于光合产物和Cd向籽粒转移,因而籽粒产量和秸秆产量都高于田间样。
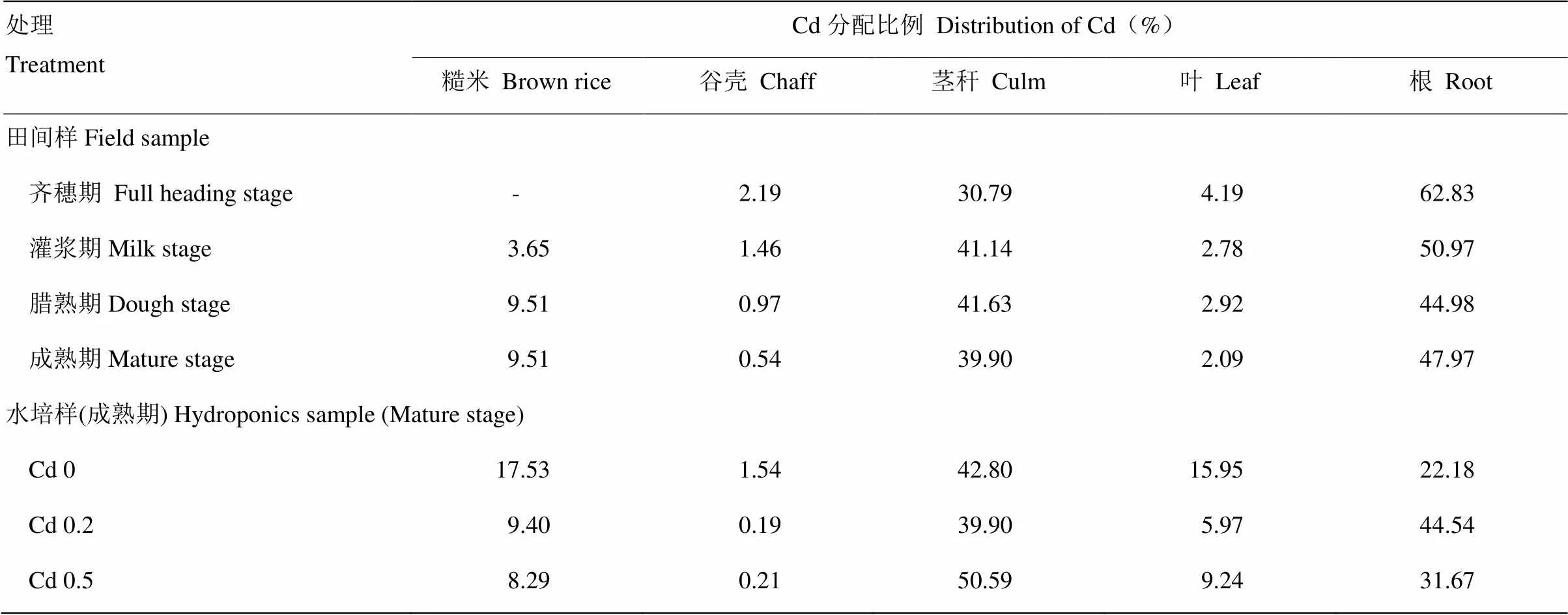
表4 不同采样时间水稻不同器官中Cd的分配比例
3 讨论
3.1 稻谷籽粒中Cd的来源
在田间条件下从土壤吸收并直接运送到籽粒中的Cd量显著少于外源Cd培养条件下从介质中吸收的Cd。有研究认为,Cd是受植物体内的锌铁转运蛋白zip基因调控[24],通过根部吸收进入体内。但这种基因并不是调控Cd吸收的专一基因,而是同时调控Cd和Zn的吸收[25]。被吸收的Cd通过其他重金属转运蛋白卸入木质部,随后迅速被运送到地上部[26]。但是也有研究表明,Cd还有其他的通道进入植物体内,即与OsHMA2转运蛋白相关的木质部装载机制[19]。
本试验结果表明,在水稻生长后期,水稻籽粒中的Cd来源于两个途径,一个是来自于土壤中的有效镉,另一个是其他器官中的Cd也会向籽粒中转运,这两种途径同时存在。但在水稻齐穗后土壤/介质中有效镉含量丰富的情况下,前者是主要途径;而在水稻抽穗后土壤中的有效镉含量很低的情况下,两个途径同时存在;当介质中不存在可利用Cd的情况下,后者成为唯一途径。这就很好地解释了FUJIMAKI等[11]和KASHIWAGI等[12]相互矛盾的研究结果。水稻籽粒中的Cd并不是来源于单一途径,谁主谁辅要视具体情况而定。FUJIMAKI等的107Cd同位素研究结果,即在水稻灌浆期,水稻从土壤中吸收的Cd被运送到籽粒;KASHIWAGI等的研究结论表明也可以来自于抽穗前水稻其他器官积累的Cd。KASHIWAGI等发现被转移到水稻籽粒中的Cd主要来自抽穗前累积在叶片和茎秆中的Cd,对籽粒Cd的富集起主要作用,抽穗后从根运送到茎秆和穗部的Cd直接进入气生器官,不影响糙米中Cd的累积。
FENG等[27]的研究表明,水稻的根和节是Cd进入水稻地上部分的主要障碍,这两个部位的Cd含量最高,当外界有效镉含量较低时,进入水稻体内的大部分Cd被固定在这两个部位,这时水稻其他器官中Cd的再转运成为籽粒中Cd的主要来源。
3.2 水稻Cd的运移特征
从水稻各器官中Cd的累积情况可以得出,叶片是向籽粒净转移Cd的主要器官。叶片衰老期Cd通过韧皮部向籽粒转移是Cd再分配的主要过程[28]。而茎秆和根系则始终为Cd的主要累积器官或库[20]。水稻茎上的节和维管束系统的复杂相互连接能延缓重金属在水稻节中的流动[11],是重金属在水稻叶片、上部茎秆和籽粒中的重新分配的通道[29]。李正翔[30]的研究表明水稻中Cd在不同器官中的再分配与基因型有关,茎秆在部分基因型水稻中Cd的再分配过程中仅仅起到了通道作用,并无储藏再分配的作用。
当水稻齐穗后土壤/介质中存在可利用Cd时,茎秆在向籽粒转移Cd的同时也接受来自根系Cd的补充;而根系在向茎秆转移Cd的同时也接受来自土壤/介质Cd的补充,形成一个动态运移系统。根系对Cd的吸收和运输速度很快,在根系接受Cd处理1 h后便进入木质部汁液和地上组织[31], 穗颈和韧皮部是Cd进入籽粒的路径[32]。在韧皮部汁液中,Cd 与一个未知的13 kDa蛋白和巯基化合物结合[33-34]。由于水稻茎节会阻止Cd的运输,根系在吸收107Cd后1 h到达水稻茎基部和基部分蘖节中,7 h后才到达籽粒,但36 h后仍未测到Cd进入叶片[11]。因此,水稻在抽穗-成熟期吸收的Cd有较大比例滞留在各节间,通过节间的Cd会被优先运送到籽粒。
4 结论
本试验结果明确了水稻齐穗后籽粒中Cd的来源及其与培养介质中Cd供应强度的关系。籽粒中的Cd来自各器官在齐穗前储存Cd的转移和土壤/介质中Cd的吸收和直接运输。在水稻齐穗后生长介质中不存在可利用Cd的情况下,籽粒中累积的Cd则主要来自于根系和茎秆在齐穗前累积的Cd。在田间情况下,水稻齐穗后土壤中有效镉含量较低,籽粒中的Cd同时来自于土壤和水稻体内在齐穗前累积的Cd,而叶片和谷壳是两个向籽粒净转移Cd的器官。而水稻齐穗后土壤/长介质中有效镉含量较丰富的情况下,籽粒中的Cd则主要来自土壤/生长介质,由根系吸收后直接运送到籽粒,由茎、叶等其他器官转移到籽粒中的Cd所占比例很小。水稻茎秆和根系是水稻Cd的两大主要储运器官。水稻抽穗-成熟期,是水稻Cd污染防控的关键时期,采取恰当的农艺措施降低土壤中Cd的有效性以及根系吸收和向籽粒的直接运输量,是实现水稻安全生产的关键。
[1] RINALDI M, MICALI A, MARINI H, ADAMO E B, PUZZOLO D, PISANI A, TRICHILO V, ALTAVILLA D, SQUADRITO F, MINUTOLI L. Cadmium, organ toxicity and therapeutic approaches. A review on brain, kidney and testis damage., 2017, 24 (1): 1-15.
[2] KHAN M A, KHAN S, KHAN A, ALAM M. Soil contamination with cadmium, consequences and remediation using organic amendments.2017, 6(9): 1591-1605.
[3] HOBBELEN P H F, KOOLHAAS J E, VAN GESTEL C A M. Bioaccumulation of heavy metals in the earthworms Lumbricus rubellus and Aporrectoden caliginosa in relation to total and available metal concentrations in field soil., 2006, 144(2): 639-646.
[4] KIRKHAM M B. Cadmium in plant on polluted soils: Effects of soil factors, hyperaccumulation, and amendments., 2006, 137(1/2): 19-32.
[5] 李子芳, 刘惠芬, 熊肖霞, 刘卉生. 镉胁迫对小麦种子萌发幼苗生长及生理生化特性的影响. 农业环境科学学报, 2005, 24(增刊): 17-20.
LI Z F, LIU H F, XIONG X X, LIU H S. Effect of cadmium on seed germination, seedling development and physiological and biochemical characteristics of wheat., 2005, 24(suppl.):17-20. (in Chinese)
[6] 杜晓, 申晓辉. 镉胁迫对珊瑚树和地中海荚蒾生理生化指标的影响. 生态学杂志, 2010, 29(5): 899-904.
DU X, SHEN X H. Effects of cadmium stress on physiological and biochemical indices of Viburnum odoratissimum and V. Tinus seedlings., 2010, 29(5): 899-904. (in Chinese)
[7] TALANOVA V V, TITOV A F, BOEVA N P. Effect of increasing concentration of heavy metals on the growth of barley and wheat seedlings., 2001, 48(1): 119-123.
[8] WATERS RS, BRYDEN NA, PATTERSON KY, VEILLON C, ANDERSON RA. EDTA chelation effects on urinary losses of cadmium, calcium, chromium, cobalt, copper, magnesium, and zinc., 2001, 83: 207-221.
[9] 崔岩山, 陈晓晨. 土壤中镉的生物可给性及其对人体的健康风险评估. 环境科学, 2010, 31(2): 403-407.
CUI Y S, CHEN X C. Bioaccessibility of soil cadmium and its health risk assessment., 2010, 31(2): 403-407. (in Chinese)
[10] 詹杰, 胡德奇, 柳承希, 魏树和, 张静生. 镉对血管内皮细胞损伤及其致动脉硬化的毒理学机制. 生态毒理学报, 2012, 7(6): 633-638.
ZHAN J, HU D Q, LIU C X, WEI S H,ZHANG J S. Damage of cadmium to vascular endothelial cells and its toxicity mechanism in atherosclerosis., 2012, 7(6): 633-638. (in Chinese)
[11] FUJIMAKI S, SUZUI N, ISHIOKA NS, KAWACHI N, ITO S, CHINO M, NAKAMURA S. Tracing cadmium from culture to spikelet: noninvasive imaging and quantitative characterization of absorption, transport, and accumulation of cadmium in an intact rice plant., 2010, 152(4):1796-1806.
[12] KASHIWAGI T, SHINDOH K, HIROTSU N, ISHIMARU K. Evidence for separate translocation pathways in determining cadmium accumulation in grain and aerial plant in rice., 2009, 9: 8.doi: 10.1186/1471-2229-9-8.
[13] 田艳芬, 史锟. 镉对水稻等作物的毒害作用. 垦殖与稻作, 2003(5): 26-28.
TIAN Y F, SHI K. Poisonous effects on rice and vegetables by cadmium., 2003(5): 26-28. (in Chinese)
[14] LI H, LUO N, LI Y W, CAI Q Y, LI H Y, MO C H, WONG M H. Cadmium in rice: Transport mechanisms, influencing factors, and minimizing measures., 2017, 224: 622-630.
[15] XIAO L, GUAN D S, PEART M R, CHEN Y J, LI Q Q, DAI J. The influence of bioavailable heavy metals and microbial parameters of soil on the metal accumulation in rice grain., 2017, 185: 868-878.
[16] 张锡洲, 张洪江, 李廷轩. 水稻镉耐性差异及镉低积累种质资源的筛选. 中国生态农业学报, 2013, 21(11): 1434-1440.
ZHANG X Z, ZHANG H J, Li T X. Differences in Cd-tolerance of rice and screening for Cd low-accumulation rice germplasm resources., 2013, 21(11): 1434 -1440. (in Chinese)
[17] 安志装, 王校常, 严蔚东. 镉硫交互处理对水稻吸收累积镉及其蛋白巯基含量的影响. 土壤学报, 2004, 41(5): 728-734.
AN Z Z, WANG X C, YAN W D. Effect of sulfate and cadmium interaction on cadmium accumulation and content of nonprotein thiols in rice seedling., 2004, 41(5): 728-734. (in Chinese)
[18] 肖清铁, 戎红, 周丽英. 水稻叶片对镉胁迫响应的蛋白质差异表达. 应用生态学报, 2011, 22(4): 1013-1019.
XIAO Q T, RONG H, ZHOU L Y. Differential expression of proteins inleaves in response to cadmium stress., 2011, 22(4): 1013-1019. (in Chinese)
[19] FONTANILI L, LANCILLI C, SUZUI N, DENDENA B,YIN Y G, FERRI A, ISHII S, KAWACHI N, LUCCHINI G, FUJIMAKI S, SACCHI G A, NOCITO F F. Kinetic analysis of zinc/cadmium reciprocal competitions suggests a possible Zn-insensitive pathway for root-to-shoot cadmium translocation in rice., 2016, 9(1): 16.
[20] ZHANG Z C, YU Q, DU H Y, AI W L, YAO X, DAVID G, MENDOZA-CÓZATL, QIU B S. Enhanced cadmium efflux and root-to-shoot translocation are conserved in the hyperaccumulator Sedum alfredii (Crassulaceae family)., 2016, 590(12): 1757.
[21] GAO L, CHANG J D, CHEN R J, LI H B, LU H F, TAO L X, XIONG J. Comparison on cellular mechanisms of iron and cadmium accumulation in rice: prospects for cultivating Fe-rich but Cd-free rice., 2016, 9(1): 39.
[22] 蒋德安, 朱诚. 植物生理学实验指导. 成都: 成都科技大学出版社, 1999.
JIANG D A, ZHU C.. Chengdu: Chengdu University of Science and Technology Press, 1999. (in Chinese)
[23] 鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2000.
BAO S D.. Beijing: ChinaAgriculture Press, 2000. (in Chinese)
[24] KOBAYASHI N I, TANOI K, HIROSE A, NAKANISHI T M. Characterization of rapid intervascular transport of cadmium in rice stem by radioisotope imaging., 2013, 64(2): 507-517.
[25] MENDOZA-CÓZATL D G, JOBE T O, HAUSER F, SCHROEDER J I. Long-distance transport, vacuolar sequestration, tolerance, and transcriptional responses induced by cadmium and arsenic.2011, 14(5): 554-562.
[26] YONEYAMA T, ISHIKAWA S, FUJIMAKI S. Route and regulation of zinc, cadmium, and iron transport in rice plants (L.) during vegetative growth and grain filling: metal transporters, metal speciation, grain Cd reduction and Zn and Fe biofortification., 2015, 16(8): 19111-19129.
[27] FENG X M, HAN L, CHAO D Y, LIU Y, ZHANG Y J, WANG R G, GUO J K, FENG R W,XU Y M, DING Y Z, HUANG B Y, ZHANG G L. Ionomic and transcriptomic analysis provides new insight into the distribution and transport of cadmium and arsenic in rice., 2017, 6: 246-256.
[28] YAN Y F, DOUGHWAN C, DOSOON K, BYUNWOO L. Absorption, translocation, and remobilization of cadmium supplied at different growth stages of rice., 2010, 13(2): 113-119.
[29] CHONAN N. STEM. In: Matsuo T, Hosikawa K(eds.) Science of the rice plant: morphology., 1993:187-221.
[30] 李正翔. 不同基因型水稻剑叶中镉向籽粒再分配差异性研究[D]. 北京: 中国农业科学院, 2014.
LI Z X. Effects of cultivar on cadmium redistributed from blade leaf to grains[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese)
[31] URAGUCHI S, MORI S, KURAMATA M, KAWASAKI A, ARAO T, ISHIKAWA S. Root-toshoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice., 2009, 60: 2677-2688. doi:10. 1093/jxb/erp119.
[32] TANAKA K, FUJIMAKI S, FUJIWARA T, YONEYAMA T, HAYASHI H. Quantitative estimation of the contribution of the phloem in cadmium transport to grains in rice plants (L.)., 2007, 53: 72-77. doi: 10.1111/j. 1747-0765. 2007.00116.x.
[33] DAVID G. MENDOZA-CÓZATL, TIMOTHY O. JOBE, FELIX HAUSER, AND JULIAN I. SCHROEDER., 2011, 14(5): 554-562. doi:10.1016/j.pbi.2011.07.004.
[34] KATO M, ISHIKAWA S, INAGAKI K, CHIBA K, HAYASHI H, YANAGISAWA S, YONEYAMA T. Possible chemical forms of cadmium and varietal differences in cadmium concentrations in the phloem sap of rice plants (Oryza sativa L.)., 2010, 56: 839-847. doi:10.1111/j.1747-0765.2010.00514.x.
(责任编辑 李云霞)
Sources of Cadmium Accumulated in Rice Grain
YU Hua1,3, SHANGGUAN YuXian1,3, TU ShiHua1, QIN YuSheng1,3, CHEN Kun1,3, CHEN DaoQuan2, LIU QianCong2
(1Soil and Fertilizer Institute, Sichuan Academy of Agricultural Sciences, Chengdu 610066;2Guanghan Agro-Tech Extension Station, Guanghan 618300, Sichuan;3Monitoring and Experimental Station of Plant Nutrition and Agro-Environment for Sloping Land in South Region, Ministry of Agriculture, Chengdu 610066)
【Objective】The objective of this study aimed to understand the sources of cadmium accumulated in the rice grain and to offer scientific support and best timing of agronomic measures to secure safety rice production. 【Method】The study involved a pot hydroponic experiment with three Cdconcentrations of 0, 0.2 and 0.5 mg·L-1by transplanting uniform rice plants at fully heading stage from a field with Cd contamination. Besides, the rice in the same field were also observed. The rice samples from hydroponic culture were harvested at maturity and those from the field were sampled at full heading stage, milk stage, dough stage and maturity. Dry weight and tissue Cd contents were analyzed for all the samples. 【Result】The results showed that Cd accumulated in the rice grain was mainly transferred from the root and culm where Cd was stored before full heading in the Cd 0 treatment of the hydroponic culture. When available Cd was low in the soil (i.e., the treatment with rice kept growing in the paddy field), Cd accumulated in the rice grain was from both plant tissues stored Cd before heading and soil Cd uptake by rice after heading. The leaf and chaff appeared as net sources for Cd transferred to the rice grain, while the culm and root behaved as both pools for Cd accumulation and sources to the grain. When the rice grew in relatively high Cd content media (i.e., Cd 0.2 and Cd 0.5 treatments), Cd accumulated in the rice grain was mainly from direct uptake of Cd by the plant and small portions from different rice organs. 【Conclusion】The Cd accumulated in the grain is transferred from different rice organs before heading stage and from direct uptake from soil/medium; the higher the available Cd in soil/medium, the higher Cd accumulated in the grain; only when there is no available Cd in the soil/medium, the Cd stored in different rice organs becomes the sole source of grain Cd. The culm and root are the two major locations for Cd storage and output in the rice plant. Heading to maturity stages are crucial to control Cd accumulation in rice grain and thus, are key period to secure production of safety rice if proper measures are taken to reduce available Cd in the growth medium as well as its uptake by direct root uptake and transport to the grain.
rice grain; cadmium; origin; contamination
10.3864/j.issn.0578-1752.2018.10.013
2017-06-30;
2017-11-17
国家科技支撑计划课题(2015BAD05B01)、四川省科技支撑计划(2017SZ0188、2015NZ0108)、四川省农业科学院公益性项目(2016GYSH-024)、四川省财政创新能力提升工程(2017QNJJ-014,2017LWJJ-008)、国家公益性行业(农业)科研专项(201503118-11)
喻华,E-mail:348017117@qq.com。通信作者涂仕华,Tel:028-84549289;E-mail:shtu2015@126.com

