LLE-UPLC-FLD法测定橄榄油中 羟基酪醇和酪醇的含量
王 强,王 锴,黄梅桂,谢跃杰,邓朝芳,王仲明,熊政委,王 波
(1.重庆第二师范学院生物与化学工程学院,重庆 400067;2.重庆第二师范学院脂质资源与儿童日化品协同创新中心,重庆 400067;3.南京林业大学轻工与食品学院,江苏南京 210037;4.甘肃出入境检验检疫局检验检疫综合技术中心,甘肃兰州 730020)
橄榄油是指以油橄榄鲜果为原料制取的油脂(不包含溶剂浸提或重酯化过程获得的油脂),并且不得掺杂其他种类的油脂[1-3]。我国GB 23347-2009《橄榄油、油橄榄果渣油》中规定橄榄油分三类:初榨橄榄油(virgin olive oil,VOO),精炼橄榄油(refined olive oil,ROO)和混合橄榄油(blended olive oil)[4];其中,初榨橄榄油具有最高的品质和营养价值。但是,部分商人受经济利益驱使,目前最普遍的橄榄油掺伪方式是VOO中掺入ROO,而对于橄榄油掺伪的鉴别,主要基于脂肪酸组成的传统分析方法日益受到挑战,近年来更多的研究则基于橄榄油中微量标记物的检测[1,5-8]。
羟基酪醇(Hydroxytyrosol)和酪醇(Tyrosol)均为苯乙醇类的衍生物,是植物体内复杂的次生代谢产物[9-10]。相关研究表明,羟基酪醇和酪醇不仅具有抗癌、抗菌、抗病毒等功能,还能够预防肿瘤,保护细胞免受氧化伤害等多种生物活性[11-13]。随着初榨橄榄油货架期的增加,酪醇和羟基酪醇的含量递减;而精炼橄榄油中含有极少量或不含有羟基酪醇和酪醇,鉴于此,羟基酪醇和酪醇可作为评价橄榄油品质的及真伪鉴别的重要指标之一[1,6]。
近年对羟基酪醇和酪醇生物功能活性及其制备工艺方面的报道较多[14-17],对于其含量的检测鲜有报道。现有报道的检测方法多为高效液相色谱法[18-19],液相色谱串联质谱法[20],气相色谱串联质谱法[21]等,对于色谱质谱法,因为仪器的价格昂贵,在国内还未被普遍使用;高效液相色谱方法,较多的仅使用紫外检测器对其进行检测,特异性不强,样品中的杂质对目标物的干扰较大,定量不准确,分析时间长,不能用于橄榄油中微量羟基酪醇及酪醇的同时测定。本研究采用超高效液相色谱串联荧光检测器同时测定橄榄油中微量羟基酪醇及酪醇的含量,并在10 min内实现了目标物的分离。实验表明,本方法灵敏度高、重复性好,为橄榄油中羟基酪醇和酪醇的定性与定量检测提供了一种高效可行的色谱检测方法。
1 材料与方法
1.1 材料与仪器
羟基酪醇、酪醇 纯度≥98%,美国SIGMA公司;甲醇、乙腈、异丙醇、正己烷 德国Merck公司;其余试剂 均为分析纯。
超高效液相色谱仪 美国Waters公司,配有Empower 2数据处理系统及荧光检测器;3K30冷冻离心机 美国SIGMA公司;MS3涡旋仪 德国IKA公司;100~1000 μL、1.0~5.0 mL移液枪 美国Thermo Electron公司。
1.2 实验方法
1.2.1 超高效液相色谱条件 色谱柱为UPLC BEH C18(50 mm×1.0 mm,1.7 μm);流动相:A为0.2%(v/v)甲酸乙腈,B为0.2%(v/v)甲酸水;流速0.15 mL/min;进样量:2.0 μL;柱温35 ℃;激发波长为300 nm,发射波长为350 nm;梯度洗脱:流动相A,初始5%,0.0~5.0 min流动相A比例由5%变为8%,5.0~8.0 min流动相A由8%变为80%,8.0~9.0 min流动相A比例回到5%,平衡2.0 min。
1.2.2 标准溶液配制 标准贮备液:称取羟基酪醇和酪醇适量,用0.2%(v/v)甲酸乙腈溶液溶解并定容至100 mL,配制成分别含羟基酪醇和酪醇为106和132 mg/L的标准储备液,4 ℃下冷藏待用。
1.2.3 样品处理 准确称取橄榄油样品1.00 g于15 mL离心管中,加入无水乙醇2.0 mL,涡旋1.0 min,超声提取1.0 min后,置于冷冻离心机中,待离心机温度稳定于4.0 ℃时,14000 r/min冷冻离心10 min,取上层溶液1.0 mL,氮气吹近干,再用0.2%(v/v)甲酸乙腈溶液定容至1.0 mL,0.22 μm微孔滤膜过滤后经超高效液相色谱分析,外标法定量。
1.2.4 提取条件的优化
1.2.4.1 提取溶剂的选择 取同一橄榄油样品(样品编号:C1)4份各1.00 g,置于15 mL离心管中,分别加入正己烷、乙腈、甲醇和乙醇溶液各2.0 mL;其余步骤及提取条件均按照“1.2.3 样品处理”操作;样品进样后以羟基酪醇和酪醇的提取率为指标,分别按确定的色谱条件进样检测。
1.2.4.2 定容溶剂的选择 取同一橄榄油样品(样品编号:C1)2份各1.00 g,置于15 mL离心管中,按照“1.2.3 样品处理”步骤及提取条件操作;样品定容时分别使用乙腈和0.2%(v/v)甲酸乙腈溶液定容至1.0 mL,按确定的色谱条件进样检测。
1.2.4.3 提取方式的选择 取同一橄榄油样品(样品编号:C1)4份各1.00 g,置于15 mL离心管中,分别通过四种提取方式(直接提取、涡旋提取、超声提取以及涡旋和超声提取)分别对橄榄油样品进行提取,其余步骤及提取条件均按照“1.2.3样品处理”操作;样品进样后以羟基酪醇和酪醇的提取率为指标,按确定的色谱条件进样检测。
1.2.4.4 离心温度的选择 取同一橄榄油样品(样品编号:C1)3份各1.00 g,置于15 mL离心管中,按照“1.2.3 样品处理”步骤及提取条件操作,离心时分别在4、10 ℃及室温(25 ℃)下对样品进行离心,然后观察橄榄油样品的乳化程度,确定最佳离心温度。
1.2.5 流动相的选择 乙腈-水系统和乙腈-甲酸系统都是在C18柱中应用最为广泛的流动相,其中流动相pH的高低直接影响到羟基酪醇和酪醇的分子状态及在色谱柱上的分离效果。鉴于此,取同一橄榄油样品(样品编号:C1)1.00 g,置于15 mL离心管中,按照“1.2.3 样品处理”步骤及提取条件操作,样品分析时,分别以乙腈和0.2%(v/v)甲酸乙腈为流动相,通过羟基酪醇和酪醇的保留时间、峰形以及样品中与杂质的分离效果为指标,确定最佳流动相。
2 结果与分析
2.1 提取溶剂的选择
由表1可以看出,当使用正己烷作为提取溶剂时,橄榄油完全溶解于正己烷中,
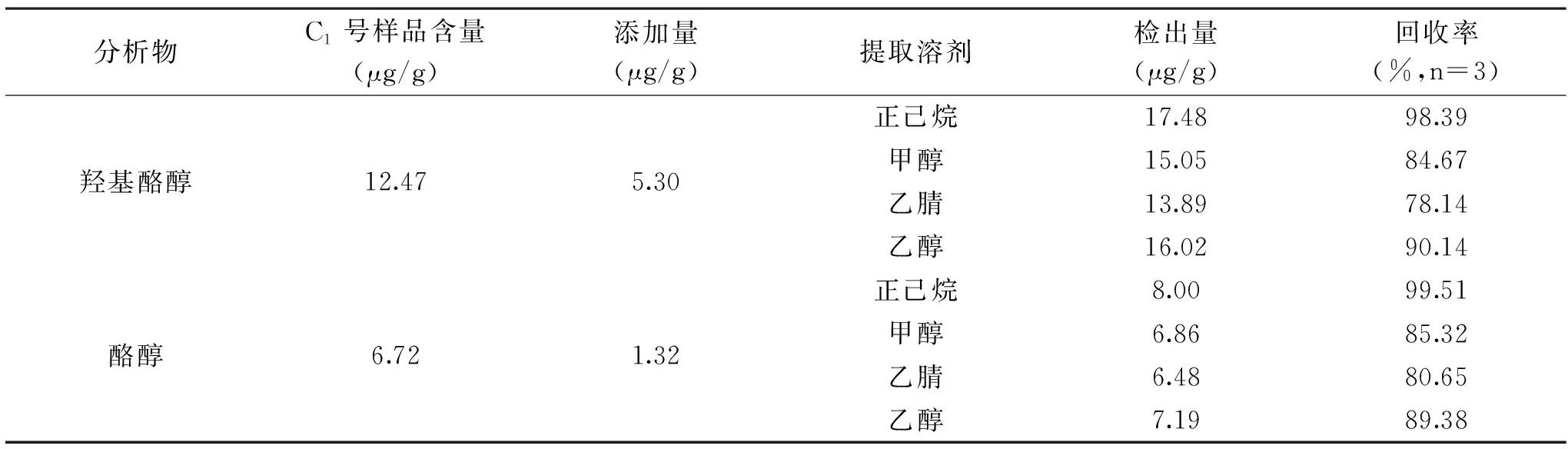
表1 不同提取溶剂对羟基酪醇和酪醇回收率的影响Table 1 Effects of different extraction solvents on the recovery of hydroxytyrosol and tyrosol
羟基酪醇和酪醇的提取率均达到98.39%以上;当使用甲醇、乙腈或乙醇作为样品提取溶剂时,乙醇对羟基酪醇和酪醇的提取率优于乙腈或甲醇;但是样品进样后,因为正己烷和流动相极性的不兼容导致羟基酪醇和酪醇的色谱峰形变形,保留时间改变,见图1;因此,选择乙醇作为最佳的提取溶剂。
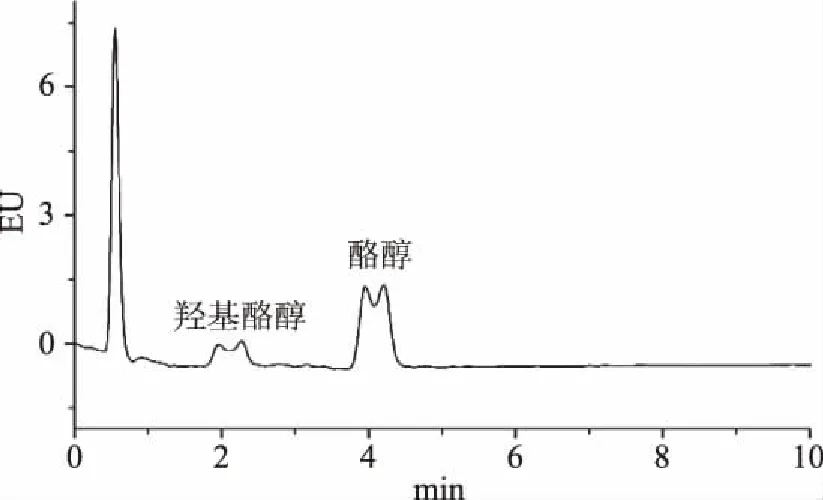
图1 提取溶剂为正己烷时的标准色谱图Fig.1 Standard chromatogram of extracting solvent as n-hexane
2.2 定容溶剂的选择
当使用乙腈溶液作为定容溶剂时,橄榄油样品经色谱分析发现酪醇和羟基酪醇拖尾较为严重,见图2;使用0.2%(v/v)甲酸乙腈溶液作为定容溶剂时,峰形尖锐,拖尾现象得到明显的改善;因此,选择0.2%(v/v)甲酸乙腈溶液作为定容溶剂。
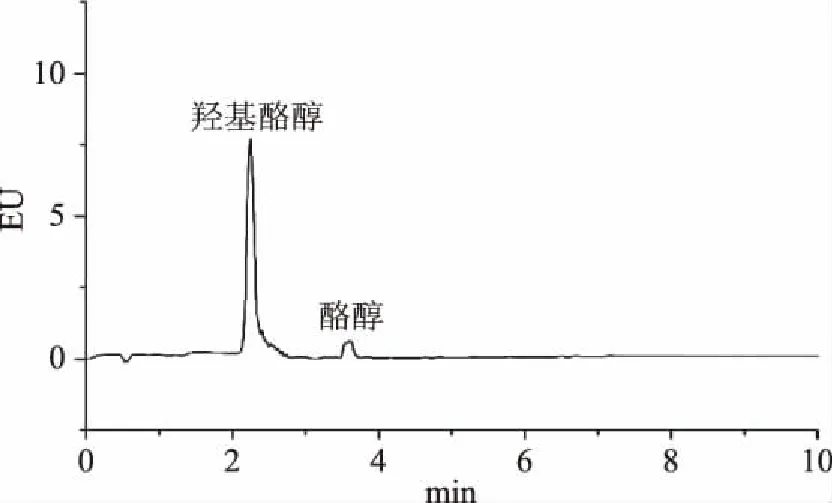
图2 溶剂为乙腈时的标准色谱图Fig.2 Standard chromatogram of solvent as acetonitrile
2.3 提取方式的选择
当橄榄油样品不进行涡旋和超声提取时,酪醇和羟基酪醇的提取率较低;仅使用涡旋或超声提取方式时,回收率有明显的提高;当同时使用涡旋和超声两种提取方式时,羟基酪醇和酪醇的提取率可达到最大,见表2;需要注意的是,当涡旋时间和超声时间超过1.0 min后,提取溶液乳化现象严重,鉴于此,确定实验中提取方式为涡旋和超声提取,且涡旋和超声提取时间分别为1.0 min。
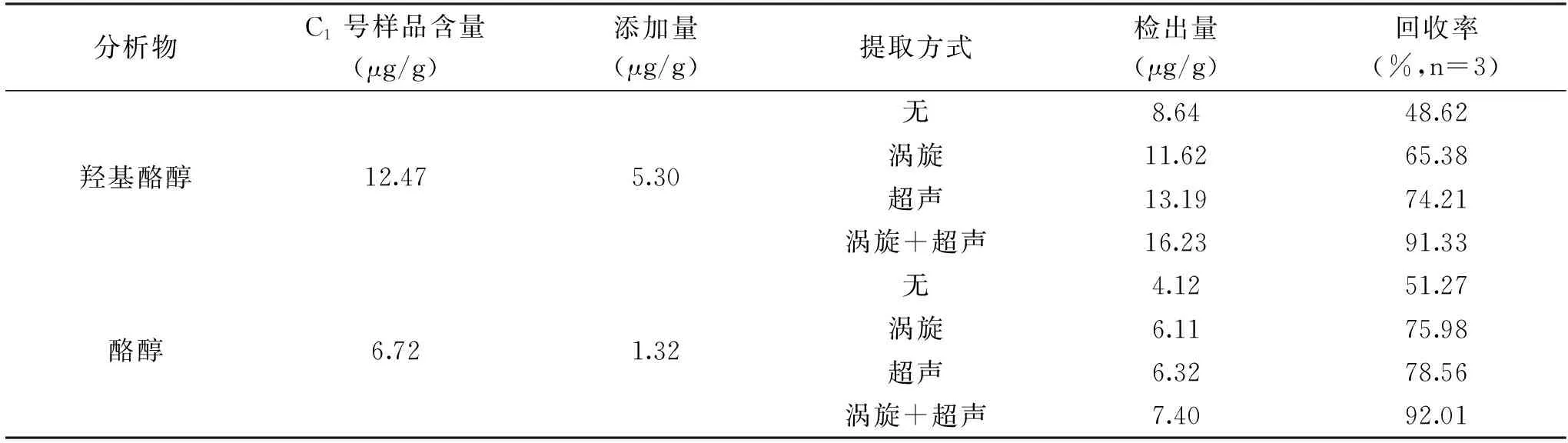
表2 不同提取方式对羟基酪醇和酪醇回收率的影响Table 2 Effects of different extraction methods on the recovery of hydroxytyrosol and tyrosol
2.4 离心温度的选择
离心时样品的温度直接影响到样品和提取溶液的分层,当离心时的温度为10.0 ℃和常温(25 ℃)时,样品仍有较大的乳化现象,分层不明显;当离心时的温度为4.0 ℃时提取效果最好,溶液分层明显,乳化现象较小。故确定实验中离心时的温度选择为4.0 ℃。
2.5 流动相的优化
由于在样品的分离分析过程中,流动相的合适与否直接影响着目标物的峰形、灵敏度及分离度。当选用乙腈为流动相时,酪醇和羟基酪醇的保留较弱;此外,在橄榄油样品分析过程中,因为羟基酪醇较弱的保留使得与样品中某一杂质重合,无法对其准确定量,见图3;而选用0.2%(v/v)甲酸乙腈做流动相时,酪醇和羟基酪醇的色谱峰形尖锐,并且无拖尾现象,保留时间增加,在样品分析过程中,橄榄油样品中的某一杂质与羟基酪醇完全分离;因此,本实验选用0.2%(v/v)甲酸乙腈溶液做为流动相。
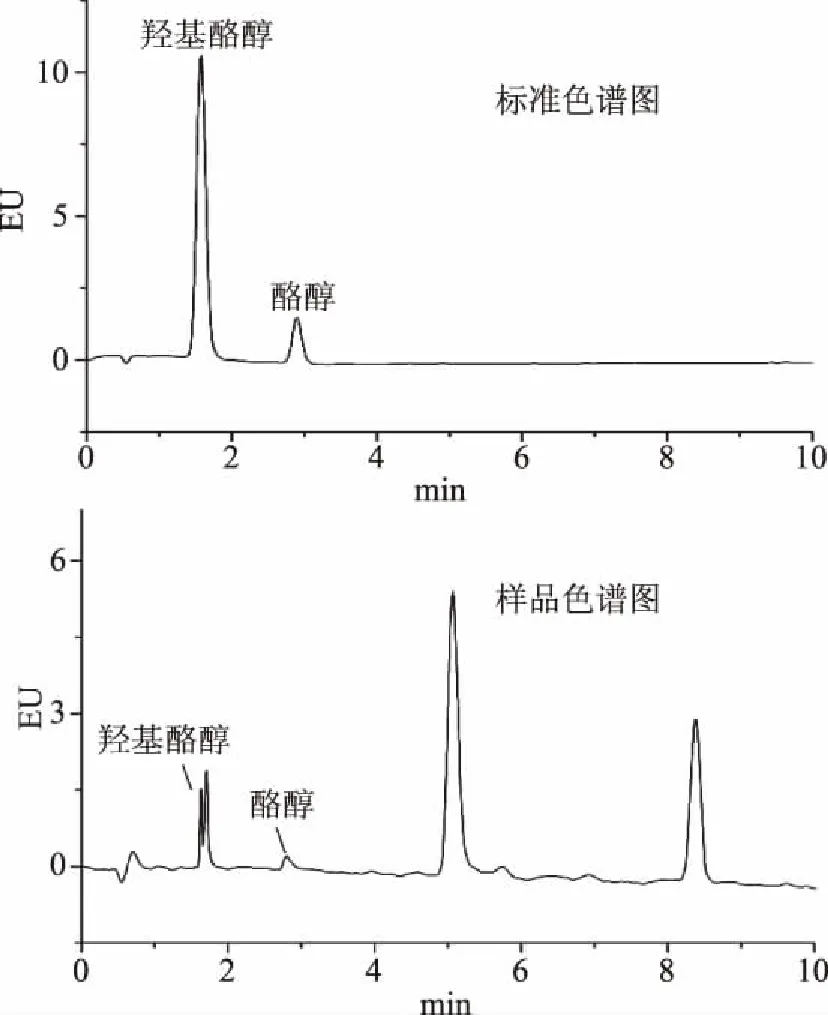
图3 流动相为乙腈时的标准及样品色谱图Fig.3 Standard and sample chromatogram of mobile phase as acetonitrile
2.6 方法学考察
2.6.1 稳定性实验 取C1号橄榄油样品,按照“1.2.3”处理样品,按照“1.2.1”所述色谱条件,在室温条件下,分别经0、4、12、24、48 h进样分析可知,橄榄油样品中羟基酪醇和酪醇在4 h后开始降解,在24 h内降解超过35%,见图4,故在样品处理完成后需在12 h内进行分析。
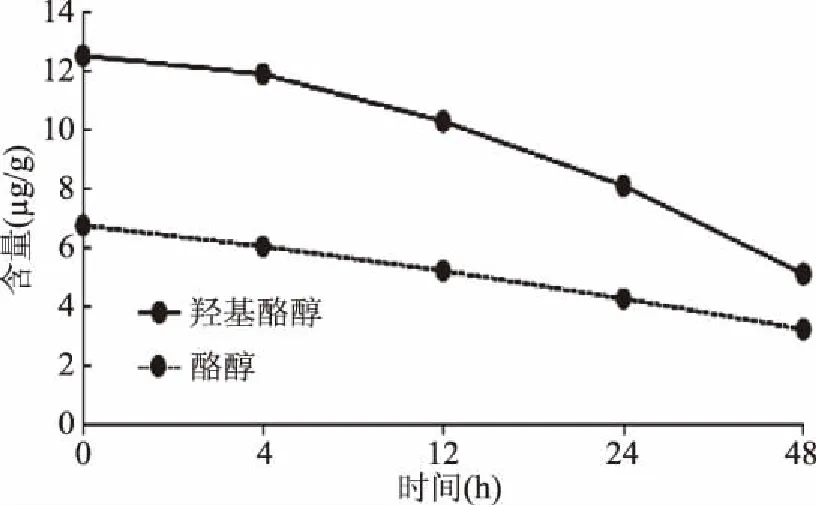
图4 不同时间羟基酪醇和酪醇的降解曲线Fig.4 The degradation curve of the hydroxytyrosol and tyrosol at different times
2.6.2 专属性实验 取所得样品溶液(样品编号:C1)、混合标准溶液、阴性供试品溶液,按“1.2.1”所述的色谱条件进样分析,将阴性样品、混合标准溶液和样品的色谱图进行比较,阴性样品在羟基酪醇和酪醇出峰位置无干扰,表明该方法测定方法专属性好。
2.6.3 线性范围及定量限 分别精密量取羟基酪醇和酪醇的对照品溶液0.10、0.50、1.00、5.00、10.00和50.00 mL,置于100 mL棕色容量瓶中,用0.2%(v/v)甲酸乙腈溶液定容至刻度,得到质量浓度范围在0.13~66.0 μg/g的系列溶液。按照“1.2.1”所述色谱条件,每个浓度依次进样2.0 μL,以浓度(μg/g)为横坐标,以峰面积(A)为纵坐标,进行线性回归,结果见表3,由表3可见,酪醇和羟基酪醇在一定范围内线性关系良好。

表3 羟基酪醇和酪醇线性范围及定量限Table 3 Linear range and quantitative limits of hydroxytyrosol and tyrosol
2.6.4 精密度实验 分别对仪器精密度进行考察;按照“1.2.1”所述色谱条件,对羟基酪醇和酪醇标准溶液重复进样6次,日内精密度的RSD范围在0.57%~0.83%之间;日间精密度是经连续三天的重复进样,其RSD范围在0.72%~0.93%之间,可以看出所使用的分析仪器具有较好的日间和日内精密度,能够满足羟基酪醇和酪醇的检测要求。
2.6.5 重复性实验 准确称取同一橄榄油样品6份(样品编号:C1),按照“1.2.3”进行样品处理,“1.2.1”所述色谱条件进样分析,通过计算羟基酪醇和酪醇的含量及RSD,见表4,由表4可以看出,6份同一橄榄油样品(样品编号:C1)中羟基酪醇和酪醇含量的RSD分别为2.58%和4.73%。表明方法重复性较好。
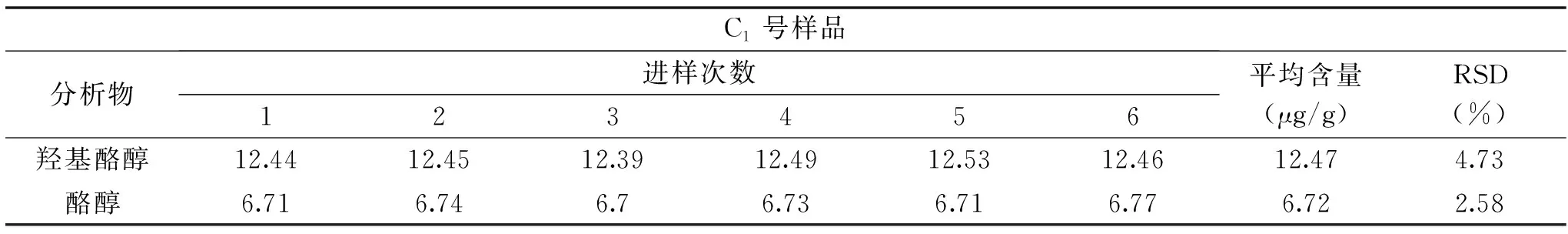
表4 橄榄油样品中羟基酪醇和酪醇化合物的含量Table 4 The contents of hydroxytyrosol and tyrosol in olive oil samples
2.6.6 加标回收率实验 准确称取6份同一橄榄油样品(样品编号:C1)1.00 g,每2份样品为一组,每组分别准确加入高、中、低三种不同浓度的混合标准溶液,按“1.2.3”进行样品处理,按“1.2.1”所述的色谱条件进样分析,由结果可知,羟基酪醇和酪醇的加标回收率范围分别在94.14%~102.17%之间,结果见表5,结果表明本实验方法回收率较好,数据准确可靠。
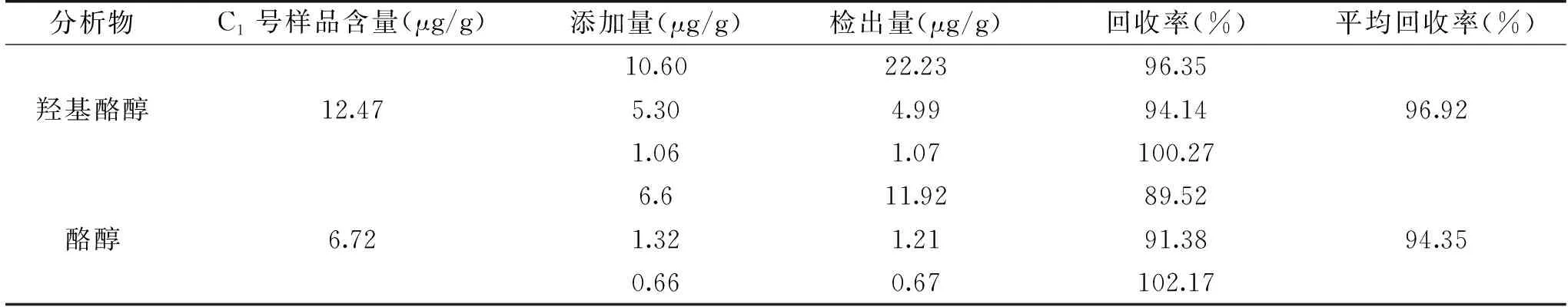
表5 橄榄油样品中羟基酪醇和酪醇的回收率Table 5 The recovery of hydroxytyrosol and tyrosol in olive oil samples
2.7 实际样品的测定
取所收集的20批次橄榄油样品,准确称取1.00 g,按“1.2.3”进行样品处理,按“1.2.1”所述的色谱条件进样分析,重复3次,计算羟基酪醇和酪醇的含量,结果见表6;羟基酪醇和酪醇标准混合溶液色谱图及部分橄榄油样品色谱图见图5~图8。
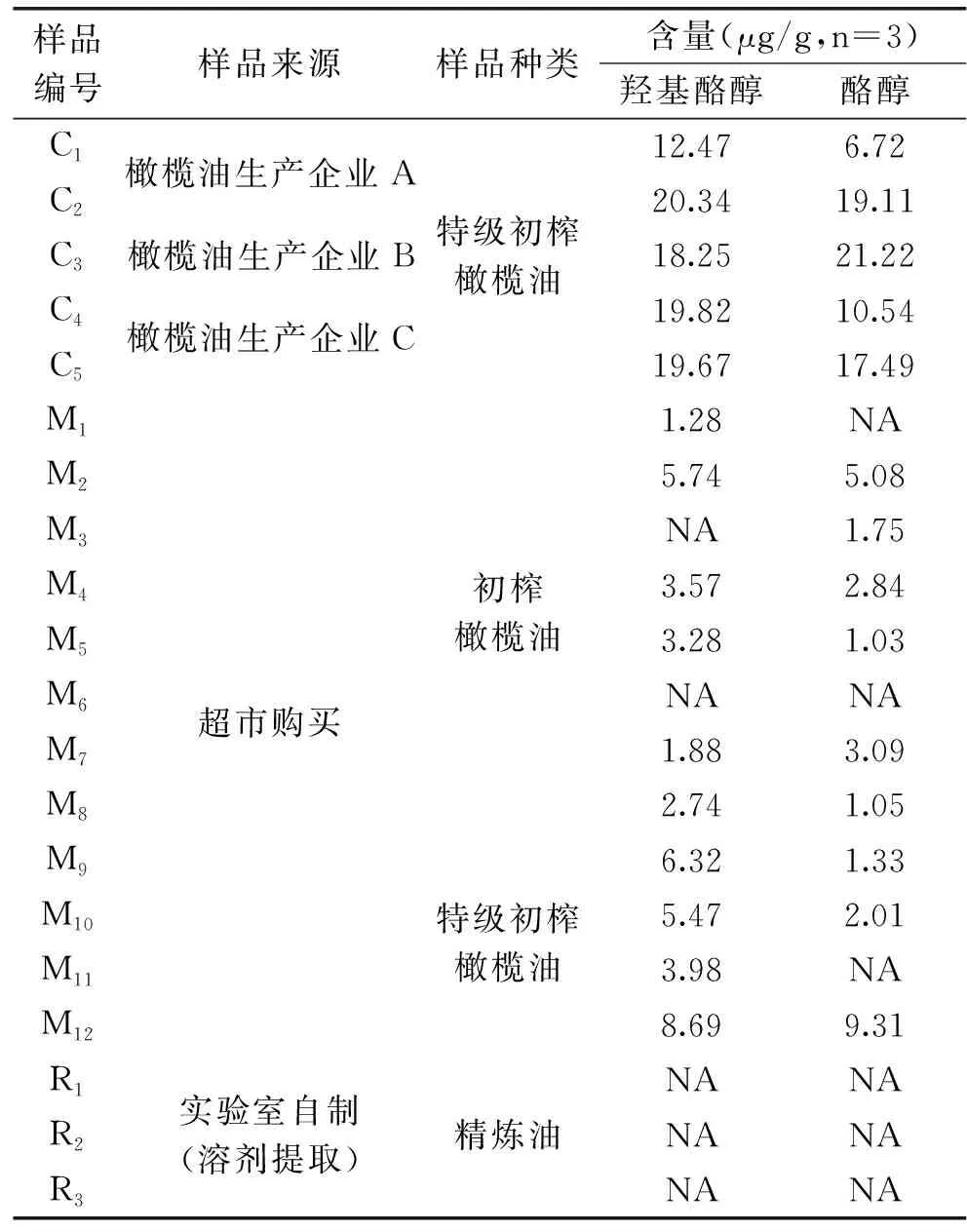
表6 20批橄榄油样品中羟基酪醇和酪醇的含量Table 6 Contents of hydroxytyrosol and tyrosol in 20 batches of olive oil samples
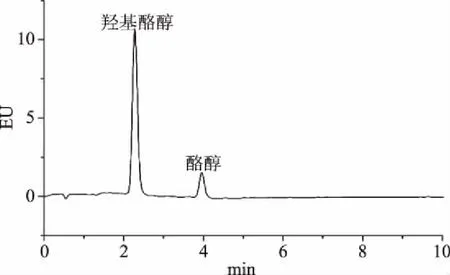
图5 羟基酪醇和酪醇标准色谱图Fig.5 Chromatography of the hydroxytyrosol and tyrosol standards

图6 橄榄油样品(样品编号:C1)色谱图Fig.6 Chromatography of the olive sample(No:C1)
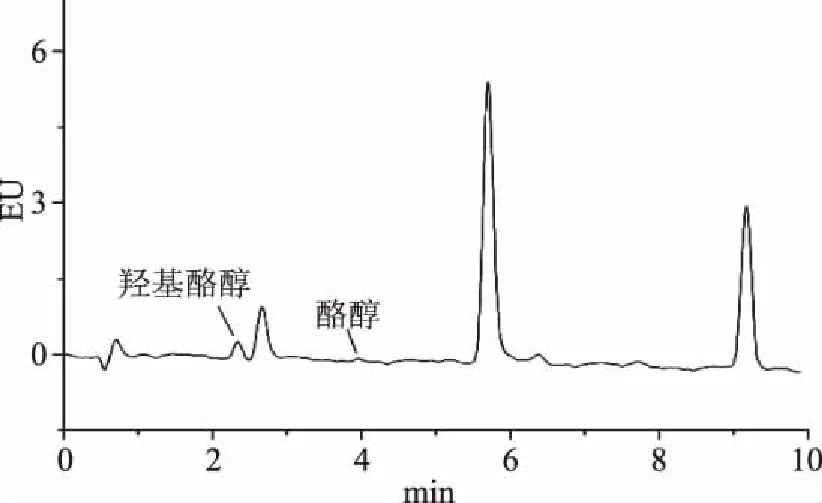
图7 橄榄油样品(样品编号:M4)色谱图Fig.7 The chromatography of the olive sample(No:M4)
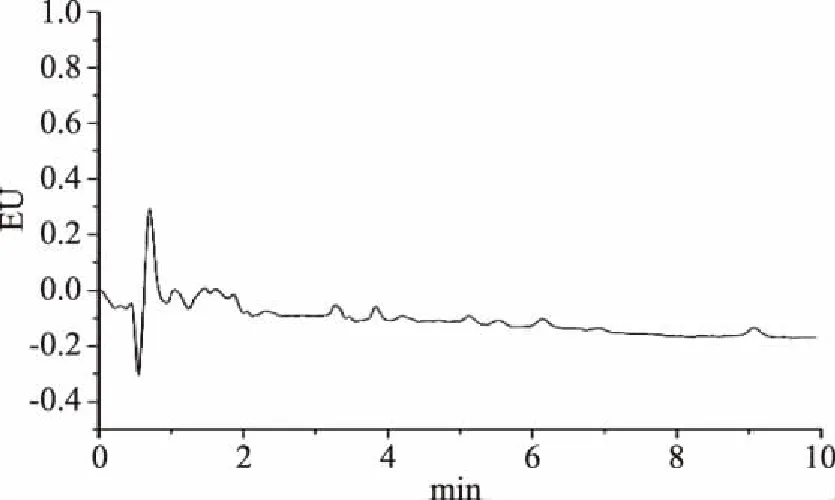
图8 橄榄油样品(样品编号:R2)色谱图Fig.8 The chromatography of the olive sample(No:R2)
由表6可以看出,经橄榄油企业直接抽取的样品,羟基酪醇和酪醇的含量均较高,羟基酪醇含量范围在20.34~12.47 μg/g,酪醇含量范围在21.22~6.72 μg/g;而经超市购买的橄榄油样品,经分离分析,羟基酪醇和酪醇的含量范围较大,有部分样品(M3和M6)甚至并未检测出目标物,其原因可能是因为橄榄油样品在超市的储存条件不佳以及货架期不同所导致的;实验室自制精炼油,并未检出羟基酪醇和酪醇,由此可以推断橄榄油中羟基酪醇和酪醇的含量反映了橄榄油自身的品质及质量,这为橄榄油的掺伪鉴别提供了一定的思路。本实验所建立的最佳色谱分析方法对20批不同来源的橄榄油中羟基酪醇和酪醇的含量进行测定,结果含量差异较大,这可能是由于橄榄果的品种、产地、种植方式、气候和橄榄油的生产工艺等因素导致。
3 结论
本实验采用超高效液相色谱法同时测定了橄榄油中的微量羟基酪醇和酪醇。通过方法学考察,该方法灵敏度高,重现性、稳定性较好,完成一次分析仅10 min;荧光检测器的特异性使得样品中杂质对目标物的干扰程度大大降低,羟基酪醇和酪醇含量的检测更加准确,可用于橄榄油中微量羟基酪醇和酪醇含量的高通量测定,该方法将为橄榄油的掺伪及质量控制提供参考和技术支持。
[1]张欣,于瑞祥,方晓明,等. 橄榄油掺假检测技术的研究进展[J]. 中国油脂,2013,38(3):67-71.
[2]王毅谦,曹文忠,杨雪芬. 液体黄金—橄榄油[J]. 中国检验检疫,2008(7):62-63.
[3]段军义. 橄榄油的价值与利用[J]. 农产品加工,2009(4):30-31.
[4]国家质量监督检验检疫总局. GB 23347-2009 橄榄油、油
橄榄果渣油[S]. 北京:中国标准出版社,2009.
[5]林远辉,高蓓,李玉玉,等. 橄榄油掺假鉴别技术研究进展[J]. 食品科学,2013,34(5):279-283.
[6]张欣,杨瑞钰,陈迪,等. 豆甾二烯用于特级初榨橄榄油掺假检测的研究[J]. 食品工业科技,2014,35(18):80-83.
[7]黄飞,奉夏平,唐丽娜,等. 橄榄油掺伪的气相色谱质谱鉴别方法研究[J]. 食品工业科技,2014,35(18):54-58.
[8]方晓明,张欣,冯春野,等. 油脂同步荧光光谱检测及橄榄油掺假鉴别[J]. 中国粮油学报,2015,30(9):112-118.
[9]王红亮,史慧贤,姜申德. 羟基酪醇的研究进展[J]. 化工进展,2010,29(6):1133-1137.
[10]张书新,武宇超. 羟基酪醇的研究进展[J]. 中国卫生产业,2016,13(19):59-61.
[11]刘威振,张兴,陈新建,等. 羟基酪醇药理作用研究进展[J]. 广东药学院学报,2012,28(6):684-688.
[12]王芳,邬树伟. 羟基酪醇的作用机制及研究进展[J]. 食品工业科技,2010,31(8):358-359.
[13]张燕琴,曹健. 新型天然活性物质羟基酪醇的研究进展[J]. 成都医学院学报,2016,11(2):270-272.
[14]金元宝,党建章,代建国,等. 羟基酪醇分离纯化方法研究进展[J]. 食品科技,2011(7):174-177.
[15]叶建中,王成章,陈虹霞,等. 油橄榄叶中羟基酪醇含量及提取工艺研究[J]. 林产化学与工业,2011,31(1):63-67.
[16]党建章,金元宝,毛友枚,等. 大孔树脂分离纯化羟基酪醇工艺研究[J]. 中成药,2012,34(9):1811-1813.
[17]卜文文,刘常金,田仕夫. 盐酸法和β-葡萄糖苷酶法水解橄榄叶提取物制备羟基酪醇的比较[J]. 食品工业科技,2011,32(7):228-232.
[18]叶建中,王成章,陈虹霞,等. 油橄榄叶中羟基酪醇的含量变化规律研究[J]. 林产化学与工业,2011,31(2):69-74.
[19]张亮,曹欢,孙佳琳,等. HPLC测定紫丁香叶中羟基酪醇含量[J]. 中医药学报,2014(3):55-57.
[20]徐保鑫,李转梅,张学兰,等. 女贞子中橄榄苦苷与羟基酪醇在大鼠血浆中的药动学差异[J]. 中成药,2017,39(7):1387-1390.
[21]苏光灿,何兴莉,邓龙,等. 凉山州引进油橄榄品种初榨油品质分析[J]. 现代农业科技,2016(24):262-263.

