黄颡鱼免疫球蛋白单克隆抗体的制备与特性
徐 洋, 蔺凌云, 尹文林, 姚嘉赟, 潘晓艺, 袁雪梅, 沈锦玉
(农业部淡水渔业健康养殖重点实验室/浙江省鱼类健康与营养重点实验室/浙江省淡水水产研究所,浙江湖州 313001)
黄颡鱼(PelteobagrusfulvidracoRichardson)别称昂刺、黄姑子、黄腊丁等,隶属于鲇形目(Siluriformes)鲿科(Bagridae)黄颡鱼属(PelteobagrusBleeker)[1],因其肉质细嫩、营养丰富、经济价值高等特点,成为我国重要的养殖经济鱼类[2-3]。随着黄颡鱼养殖规模的扩大、养殖密度的提高、养殖环境的恶化及养殖管理的相对滞后,黄颡鱼疾病的暴发日益频繁,已成为制约黄颡鱼养殖业健康发展的主要因素。要实现对病害的有效防治,必须借助渔用疫苗等免疫技术进行预防[4]。近30年来,国内外学者针对黄颡鱼的分类、生物学特性、人工繁殖和养殖方式等做了大量研究工作[5-6],但有关黄颡鱼免疫学的研究还处于起步阶段。现有文献探讨了几种纯化蛋白的技术在黄颡鱼血清免疫球蛋白(IgM)纯化中运用的可行性[7],研究了IgM抗原刺激后的表达规律及在转录水平及蛋白水平的个体发育[8],检测了黄颡鱼IgM重链基因在各组织中的表达情况以及经免疫刺激后的变化规律[9],但尚未见黄颡鱼免疫球蛋白单克隆抗体研制和应用的报道。因此,我们开展了黄颡鱼血清IgM单克隆抗体的研究,试图将单克隆抗体运用于黄颡鱼体液免疫应答规律、病原诊断和疫苗开发应用等的研究。
1 材料与方法
1.1 材料
健康黄颡鱼,购自浙江省湖州市东林镇保丰黄颡鱼养殖场,体质量(500±10) g;6~8周龄雌性BALB/c小鼠,购自浙江大学医学院实验动物中心;小鼠的骨髓瘤细胞SP2/0由扬州大学农业部重点实验室惠赠。
1.2 主要试剂
RPMI-1640和胎牛血清,购自博士德生物工程有限公司;DMSO、HT、HAT和PEG4000,购自Sigma公司;TMB显色液和辣根过氧化物酶标记羊抗鼠IgG,购自上海碧云天生物技术有限公司;Mouse Monoclonal Antibody Isotyping Kit,购自Roche公司;Protein A HP柱,购自GE公司;其他生化试剂均为国产分析纯试剂。
1.3 黄颡鱼免疫球蛋白的提取
取健康黄颡鱼尾静脉采血,室温静置1 h,4 ℃过夜,次日4 000 r/min离心15 min,取上清液。血清加等体积生理盐水稀释后,缓慢加入pH值为7.0的饱和硫酸铵至30%饱和度,4 ℃静置过夜,10 000 r/min离心30 min,取上清继续加入饱和硫酸铵至最终饱和度为50%,同上处理,收集沉淀溶解于0.02 mol/L PBS(pH值7.4),再经PBS 4 ℃透析脱盐,获得黄颡鱼免疫球蛋白粗提液,-80 ℃保存备用。取黄颡鱼免疫球蛋白粗提液1.0 mL,与HiTrap Protein A HP柱4 ℃结合3~4 h;用0.02 mol/L pH值为7.4 PBS以1.0~1.5 mL/min流速洗脱未结合蛋白至D280 nm<0.01;用0.1 mol/L pH值为3.0柠檬酸以1.0~1.5 mL/min流速洗脱结合蛋白,以200 μL/管收集洗脱峰,合并洗脱峰,用0.02 mol/L pH值为7.4 PBS 4 ℃ 透析过夜,-20 ℃保存备用;同时进行SDS-PAGE电泳分析。
1.4 BALB/c小鼠的免疫
取50 μg纯化的黄颡鱼血清免疫球蛋白与等体积弗氏完全佐剂充分乳化,背部皮下多点及腹腔注射BALB/c小鼠,首免后14、28 d各用等量抗原与弗氏不完全佐剂混合进行免疫,融合前3 d腹腔加强免疫1次。
1.5 细胞融合
细胞融合按常规方法[10],取免疫小鼠的脾细胞与SP2/0细胞混合于融合管内,PEG-4000处理使细胞融合,将融合细胞加入装有饲养细胞的96孔板,置37 ℃、5% CO2培养箱培养。
1.6 阳性杂交瘤的筛选与腹水制备
待融合细胞生长到培养孔面积的1/10时,取培养上清用间接ELISA法进行筛选,用纯化的黄颡鱼血清免疫球蛋白作为包被抗原,2 μg/mL,100 μL/孔,4 ℃过夜包被;10%小牛血清于37 ℃封闭3 h,用PBST洗涤3次,5 min/次;加入杂交瘤上清37 ℃孵育1 h,以SP2/0上清作为阴性对照,阳性对照为免疫血清;同上洗涤3次,加入1 ∶1 000辣根过氧化物酶标记的羊抗鼠IgG 37 ℃孵育1 h,100 μL/孔;同上洗涤3次孔加入TMB显色液,100 μL/孔,于暗处反应30 min,加入2 mol/L硫酸溶液终止反应,50 μL/孔,读取D450 nm值。经复测仍为强阳性的克隆用有限稀释法进行亚克隆,克隆化至阳性率达100%,即可定株并冻存;杂交瘤细胞株经冻存、复苏后取5×106对数生长期细胞腹腔接种BALB/c小鼠,10~14 d 后采集腹水,离心收集上清,-20 ℃保存备用。
1.7 单抗特性鉴定
1.7.1 亚级份测定 按Mouse Monoclonal Antibody Isotyping Kit说明书进行。
1.7.2 腹水ELISA效价的测定 以2 μg/mL纯化的黄颡鱼免疫球蛋白包被酶标板,4 ℃过夜,封闭后加腹水抗体,腹水稀释度为1 ∶103~1 ∶(2.187×106),100 μL/孔,其余步骤同“1.6”节。
1.7.3 western-blot分析 黄颡鱼免疫球蛋白经SDS-PAGE后,采用Bio-red微型电转移系统进行电转移,恒压 15 V,转移45 min。转印完毕后NC膜用脱脂奶粉封闭1 h,PBST洗涤后与1 ∶1 000的腹水结合1 h,洗涤后与1 ∶1 000的辣根过氧化物酶标记的羊抗鼠 IgG结合1 h,洗涤后DAB显色,拍照记录。
1.7.4 单抗灵敏度测定 纯化黄颡鱼免疫球蛋白起始浓度为2 μg/mL倍比稀释至10 ng/mL,100 μL/孔,4 ℃包被过夜,封闭后加入1 ∶1 000腹水抗体,100 μL/孔,其余步骤同“1.6”节。
1.7.5 单抗特异性测定 收集黄颡鱼、鲇鱼、鳗鲡、鲫鱼、草鱼、鳊鱼、鲈鱼、鳜鱼和白鱼等淡水鱼血清作为待检抗原,各种血清1 ∶1 000稀释后包被酶标板,一抗加1 ∶1 000腹水抗体,其余步骤同“1.6”节。
2 结果与分析
2.1 免疫原的制备与检验
按“1.3”节中所述的过程制备抗原,用核酸蛋白仪测定提纯的抗原浓度为1 mg/mL。由图1可知,SDS-PAGE凝胶电泳图谱上可以看到2条清晰的蛋白带,分别代表黄颡鱼Ig的重链和轻链。计算和分析结果表明,黄颡鱼血清IgM重链和轻链的分子量分别为73、30 ku。
2.2 细胞融合与筛选
经过筛选最终获得能稳定分泌抗体的杂交瘤细胞2株,分别命名为B10-C3和F6-F2。
2.3 单抗效价与特性分析
由表1可知,2株单抗均为IgG2a亚类;腹水抗体效价为1 ∶(7.29×105)。由图1可知,2株单抗能与转印后的黄颡鱼血清IgM发生反应,都是识别的重链区;单抗F6-F2对纯化的黄颡鱼免疫球蛋白的检测灵敏度为20 ng,单抗B10-C3对纯化的黄颡鱼免疫球蛋白的检测灵敏度为39 ng。
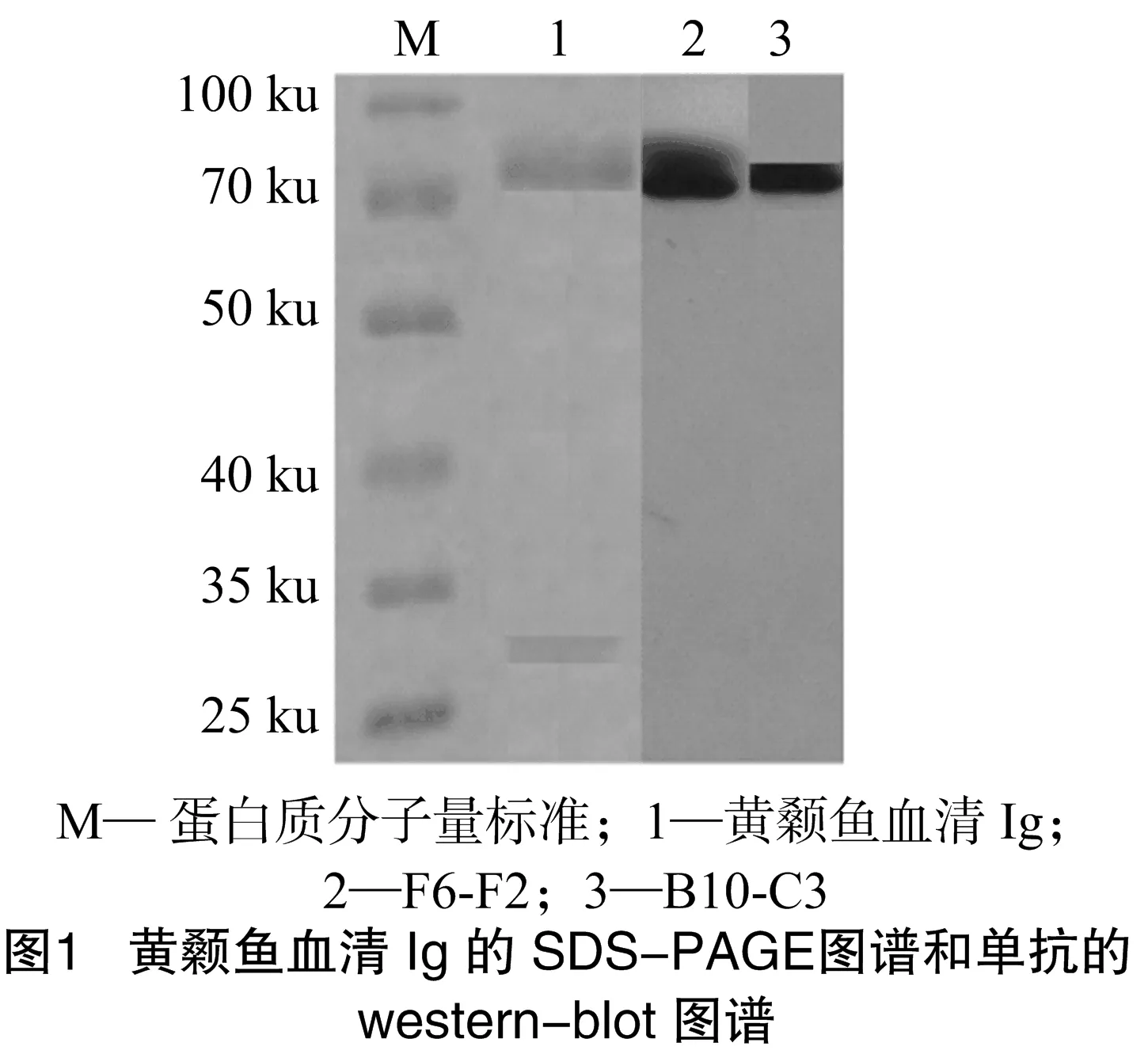

表1 单抗特性分析
2.4 单抗特异性测定
由表2可知,F6-F2和B10-C3仅与黄颡鱼血清发生反应,与被试的其他血清均无任何交叉反应。

表2 单克隆抗体的特异性
注:“++”表示强阳性反应;“+”表示阳性反应;“-”表示阴性反应。
3 讨论
要实现对黄颡鱼病害的有效防治,推动黄颡鱼养殖业健康发展,必须借助免疫技术进行疾病预防,而免疫防治的效果受诸多因素影响,要达到理想的免疫防治效果,需考虑黄颡鱼自身免疫系统组成特点及免疫应答规律[11]。IgM是鱼类体液免疫应答的重要组成部分,利用单克隆抗体研究鱼类IgM是最常用的方法之一[12]。近20年来,国内外学者对鱼类免疫球蛋白的单抗开展大量研究工作,制备了部分淡水鱼[13-16]及海水鱼类[17-21]血清IgM的单克隆抗体。本研究通过Protein A亲和层析纯化黄颡鱼血清免疫球蛋白,进而制备了2株抗黄颡鱼免疫球蛋白单克隆抗体B10-C3和F6-F2。根据SDS-PAGE的结果推测黄颡鱼免疫球蛋白的重链和轻链分别为73、30 ku,与黄艳青等利用MBP亲和层析纯化黄颡鱼血清IgM的分子量结果[22]相一致。
从单抗特异性试验的结果可看出,这2株单抗高度特异,本研究共选取包括黄颡鱼在内的9种不同鱼血清进行测试,2株单抗仅与黄颡鱼发生特异性反应,与其他8种鱼血清都无交叉反应,其中包括和黄颡鱼同为鲇形目的鲇鱼。这一现象说明了鲇形目不同属之间的血清Ig相似度较低。从单抗的灵敏度测定结果可知,单抗F6-F2对纯化的黄颡鱼IgM检测灵敏度为20 ng,与欧洲鳗、南方鲇和鳜[23-25]等免疫球蛋白单抗的灵敏度进行比较,单抗F6-F2的灵敏度极高,今后可成为黄颡鱼病原诊断和血清学调查的重要工具。
Western-Blot分析结果表明,2株单抗呈阳性反应,都识别于黄颡鱼IgM的重链区,没有获得抗轻链的单抗。目前已报道的鱼IgM的单抗大部分可以识别鱼的IgM重链,仅少量可以抗轻链[26],这与鱼血清IgM分子的结构有关,由于其重链恒定区的氨基酸序列多且结构复杂,可提供多个抗原表位;而轻链上免疫表位少。
综上所述,黄颡鱼IgM单克隆抗体的制备有助于深入分析黄颡鱼免疫球蛋白结构与功能,该单抗可广泛应用于黄颡鱼免疫应答水平监测和疫苗免疫效果的评价,为黄颡鱼免疫学深层次研究奠定基础。
:
[1]王升明. 黄颡鱼的生物学特性与繁殖技术[J]. 农技服务,2010,27(3):373,418.
[2]万松良,黄永涛,刘 敏,等. 瓦氏黄颡鱼的含肉率及营养成分分析[J]. 水利渔业,2008,28(3):59-61.
[3]祁保霞,白凤珍,马国杰. 黄颡鱼生物学特性及池塘养殖技术[J]. 内蒙古民族大学学报(自然科学版),2009,24(1):72-74.
[4]刘秀梵 .单克隆抗体在农业上的应用[M]. 合肥:安徽科学技术出版社,1994:56-89.
[5]王令玲,仇潜如,邹世平,等. 黄颡鱼生物学特点及其繁殖和饲养[J]. 淡水渔业,1989(6):23-24,31.
[6]王卫民. 黄颡鱼的规模入工繁殖试验[J]. 水产科学,1999,18(3):9-12.
[7]黄艳青. 黄颡鱼基础免疫的研究[D]. 武汉:华中农业大学,2003:15-22.
[8]李春涛. 黄颡鱼IgM分子及其表达研究[D]. 重庆:西南大学,2012:45-50.
[9]叶仕根,费阳春,李 强,等. 黄颡鱼免疫球蛋白M基因的克隆与组织表达分析[J]. 大连海洋大学学报,2013,28(6):515-521.
[10]陶义训. 免疫学及免疫学检验[M]. 北京:人民卫生出版社,1997.
[11]杨廷彬,尹学念. 实用免疫学[M]. 长春:长春出版社,1994:401-407.
[12]Cartwright G A,Chen D,Hanna P J,et al. Immunodiagnosis of virulent-strains of aeromonas-hydrophila associated with epizootic ulcerative syndrome(eus) using a monoclonal-antibody[J]. Journal of Fish Diseases,1994,17(2):123-133.
[13]Lobb C J,Clem L W. Fish lymphocytes differ in the expression of surface immunoglobulin[J]. Developmental and Comparative Immunology,1982,6(3):473-479.
[14]Secombes C J,van Groningen J J,Egberts E. Separation of lymphocyte subpopulations in carpCyprinuscarpioL. by monoclonal antibodies:immunohistochemical studies[J]. Immunology,1983,48(1):165-175.
[15]Sánchez C P,Lopez-fierro L,Zapata A,et al. Characterization of monoclonal antibodies against heavy and light chains of trout immunoglobulins[J]. Fish & Shellfish Immunology,1993,3(4):237-251.
[16]Al-Harbi A H. Truax R,thune R L.production and characterization of monoclonal antibodies against tilapia oreochromis niloticusimmunoglobulin[J]. Aquaculture,2000,188:219-227.
[17]Magnadótttir B. Kristjánsdóttir H,Gudmundsdótttir S. Characterisation of monoclonal antibodies to separate epitopes on salmon IgM heavy chain[J]. Fish & Shellfish Immunology,1996,6(3):185-198.
[18]Bang J D,Kim J W,Lee S D,et al. Humoralimmune response of flounder toEdwardsiellatarda:the presence of various sizes of immunoglobulins in flounder[J]. Diseases of Aquatic Organisms,1996,26(3):197-203.
[19]Romestand B,Breuil G,Bourmaud C F,et al. Development and characterization of monoclonal antibodies against sea bass immunoglobulinsDicentrarchuslabraxLinaeus,1758[J]. Fish & Shellfish Immunology,1995,5(5):347-357.
[20]Scapigliati G,Romano N,Picchietti S,et al. Monoclonal antibodies against sea bassDicentrarchuslabrax(L.) immunoglobulins:immunolocalization of immunoglobulin-bearing cells and applicability in immunoassays[J]. Fish & Shellfish Immunology,1996,6(5):383-401.
[21]dos Santos N M S,Taverne N,Taverne-Thiele A J,et al. Characterisation of monoclonal antibodies specific for sea bass(DicentrarchuslabraxL.)IgM indicates the existence of B cell subpopulations[J]. Fish & Shellfish Immunology,1997,7(3):175-191.
[22]黄艳青,王桂堂,孙 军,等. 黄颡鱼血清免疫球蛋白的纯化及分子量的初步测定[J]. 水生生物学报,2003,27(6):654-656.
[23]林天龙,陈 强,龚 晖,等. 欧洲鳗免疫球蛋白单克隆抗体的制备与特性[J]. 水产学报,2001,25(6):532-537.
[24]张小萍,魏 静,邱 艳. 南方鲇免疫球蛋白单克隆抗体的制备及特性[J]. 水生生物学报,2012,36(3):379-384.
[25]王 凡,林天龙,潘厚军,等. 鳜免疫球蛋白单克隆抗体的制备及特性[J]. 水产学报,2006,30(2):285-288.
[26]van der Heijden M H,Rooijakkers J B,Booms G H,et al. Production,characterisation and applicability of monoclonal antibodies to European eel (AnguillaanguillaL.,1758) immunoglobulin[J]. Veterinary Immunology and Immunopathology,1995,45(1/2):151-164.

