施用微生物菌肥“宁盾”对辣椒根围细菌多样性及土壤酶活性的影响
杨 威, 闫海霞, 张贝贝, 张温馨, 郭坚华, 罗玉明
(1.淮阴师范学院生命科学学院/江苏省环洪泽湖生态农业生物技术重点实验室,江苏淮安 223300;2.江苏省淮安市农业技术推广中心,江苏淮安 223300; 3.南京农业大学植物保护学院,江苏南京 210095)
淮安红椒产自我国地理南北分界线特定的江苏省淮安市辖区内,已有近30年的发展历史,先后荣获“国家地理标志证明商标”“江苏省名牌农产品”等殊荣。近年来,淮安红椒生产呈现出快速发展的态势,截至2010年,淮安市大棚红椒种植面积达1.4万hm2,占全市设施蔬菜面积的36.2%。全市年产红椒45万t以上,年销售收入超过23亿元[1-2]。在快速发展的同时,淮安红椒在种植过程中也存在一系列问题。如规模经营比例较小、无公害标准化生产技术难以推广以及滥用农药现象较多,产品质量存在安全隐患。其中,特别是在病虫害的防治过程中,化学农药的大量使用,对食品安全,品牌效应的提升等产生了严重的阻碍。其中,在淮安红椒的生产过程中,尤以疫病的发生最为严重。辣椒疫病是由辣椒疫霉(PhytophthoracapsiciLeon)引起的一种毁灭性病害,一般田间发病率为5%~65%,平均发病率达24.4%,发病严重的可减产40%~70%,甚至绝收[3]。对辣椒疫病的防治方法主要包括种植抗病品种、农业防治、化学防治、生物防治。抗病品种使用较少,最常使用的防治方法是化学防治,主要药剂包括甲霜灵、代森锰锌、甲霜·锰锌、氧化亚铜可湿性粉剂等(http://www.chinapesticide.gov.cn)。
对于辣椒疫病的生物防治在国内外均有较多的研究。Segarra等比较了生防制剂棘孢木霉T34和土菌灵在辣椒疫病防治中的效果,发现T34菌株的防治效果达71%,而土菌灵只有在与病原菌同时接种时才能起到防治作用[4]。Sopheareth等在2013年报道,伯克霍尔德式菌(Burkholderiacepacia)MPC-7制剂能够显著防治辣椒疫病,平均防效达60%,同时该生防菌能够显著促进植物的生长及生物量的增加[5]。刘永亮等通过平板对峙法筛选得到1株金色毛壳菌HTC,对辣椒疫病的防治效果高于70%[6]。欧雄常等应用红树内生细菌解淀粉芽孢杆菌(Bacillusamyloliquefaciens)RS261菌株在辣椒植株根部定殖防治辣椒疫病,6 d时的防治效果高于80%,并增强了植株的防御酶活性[7-8]。人们还发现,生防菌能够产生生物膜来阻挡辣椒疫霉的侵染。如约氏黄杆菌GSE09能够在植物体表面产生生物膜,同时产生一些吲哚类化合物、酵母促生物、表面活性剂等物质来防治辣椒疫霉[9]。这些生防菌生物膜和代谢产物在辣椒根围形成了一定的屏障,改变了根围微生态环境,但根围微生态改变的意义尚未引起足够的重视。
微生物菌肥“宁盾”是由笔者所在项目组前期与南京农业大学联合开发研制,于2013年取得生物肥料正式登记证[微生物肥(2013)准字(1096)号]。在前期工作中,“宁盾”在防治辣椒土传病害中取得了较好的效果[10-11],在研究中发现“宁盾”的使用对田间病害的防治效果可以持续到下一茬作物,下一茬种植过程中即便不再施药,辣椒仍然生长良好,病害发生较轻。因此,本试验旨在检测“宁盾”在防治辣椒土传病害过程中,对辣椒根围细菌多样性及主要土壤酶活性和土壤养分的影响,以期为该微生物菌肥的进一步应用提供理论依据。
1 材料与方法
1.1 试验设计及土壤样品采集
本研究地点设在江苏省淮安市农业技术推广中心蔬菜园区,在辣椒移栽时利用微生物菌剂“宁盾”进行灌根处理,并分别在移栽1、2、3个月后采集辣椒根围土壤进行检测。以未使用微生物菌剂的辣椒作为对照组,处理组和对照组试验小区随机分布,每个处理3次重复,每个小区面积为3 m×2 m。处理组包含4个辣椒品种,分别为红优4号(TH)、马六(TM)、好农50(TA)、苏椒5号(TS),对照组为红优4号(CH)。
整个土壤采集过程采用3点取样法,每个小区选取3株间距1 m的辣椒植株,首先将植株拔出,轻轻抖动以去除黏附在根部的大量土壤,再利用毛刷轻轻刷下紧贴在辣椒根部的土壤,3株辣椒土壤样品混合在一起,装入塑封袋放在冰盒中带回实验室。样品前期处理后研磨过2 mm筛,一部分进行土壤总DNA的提取、变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,简称PCR-DGGE)分析;另一部分置于阴凉通风处自然干燥至恒质量,用作土壤理化性质及酶活性检测;剩余的则置于 -20 ℃ 冰箱保存备用。
1.2 土壤样品DNA提取及DGGE分析
本研究利用FastDNA SPIN Kit for Soil试剂盒(MP Bio,USA)进行土壤样品总DNA的提取,提取方法参照试剂盒试验说明。以样品基因组DNA为模板,采用细菌通用引物 GC-338F 和518R扩增样品16S rDNA高变区序列,引物信息如表1 所示。

表1 土壤样品16S rDNA扩增引物信息
PCR扩增体系(50 μL):10× PCR buffer 5 μL、dNTP(2.5 mmol/L)3.2 μL、rTaq(5 U/μL)0.4 μL、GC-338F(20 μmol/L)1 μL、518R(20 μmol/L)1 μL、模板DNA 50 ng、补充ddH2O至50 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性 1 min,55 ℃复性45 s,72 ℃延伸1 min,30个循环;最终 72 ℃ 延伸10 min。PCR产物采用OMEGA公司DNA Gel Extraction Kit试剂盒纯化回收。DGGE梯度胶根据Heuer等的方法[12]制备。DGGE在DCode突变检测系统(Bio-Rad)中完成。用25 μL PCR浓缩产物进行DGGE,采用变性梯度为30%~60%、浓度为8%的丙烯酰胺凝胶[100%浓度定义为 7 mol/L 尿素和40%的去离子甲酰胺]在1×TAE电泳缓冲液中、130 V电压、60 ℃下电泳7 h。电泳后用银染10~15 min,扫描并拍照。比对不同处理组和对照组之间差异性条带,切胶回收、测序比对。测序结果采用DNAstar和Cluster软件进行序列分析,下载最相似的菌株序列作为系统发育树的参考序列。然后采用MEGA软件、Neighbor-Joining法构建系统发育树,自展数为1 000。主成分分析在CANOCO 4.5软件中进行。
细菌多样性指数是研究群落物种数和个体数以及均匀度的综合指标。根据电泳图谱中样品条带数目及每个条带的强度(灰度),对各样品中细菌香农指数、均匀度、丰富度等指标进行分析。DGGE图谱采用Quantity one软件对每个样品的电泳条带数目、条带密度进行数字化分析。
1.3 土壤酶活性及理化性质测定
土壤酶活性测定包括脲酶、磷酸酶、蔗糖酶、过氧化氢酶等的测定,具体操作参考关松荫的方法[13]。土壤理化性质测定包括速效氮、速效磷、速效钾、有机质等含量的测定,具体操作参考鲁如坤的方法[14]。试验数据采用Excel处理后作图,用SPSS 16.0对各处理之间的差异性进行分析。
2 结果与分析
2.1 辣椒根围细菌DGGE指纹图谱分析
由表2可知,微生物菌肥“宁盾”处理组相对于对照组,辣椒根围微生物多样性呈现下降趋势,从香农指数、丰富度的结果来看,处理组除了TM组在第2个采样时间点高于对照组以外,其他所有处理组在3个采样时间点均低于对照组。说明在施用微生物菌肥后能够降低辣椒根围土壤微生物的多样性,使其中个别微生物成为优势种群。另外,由于本次试验采用的是基质栽培,因此,辣椒根围微生物多样性总体偏低。
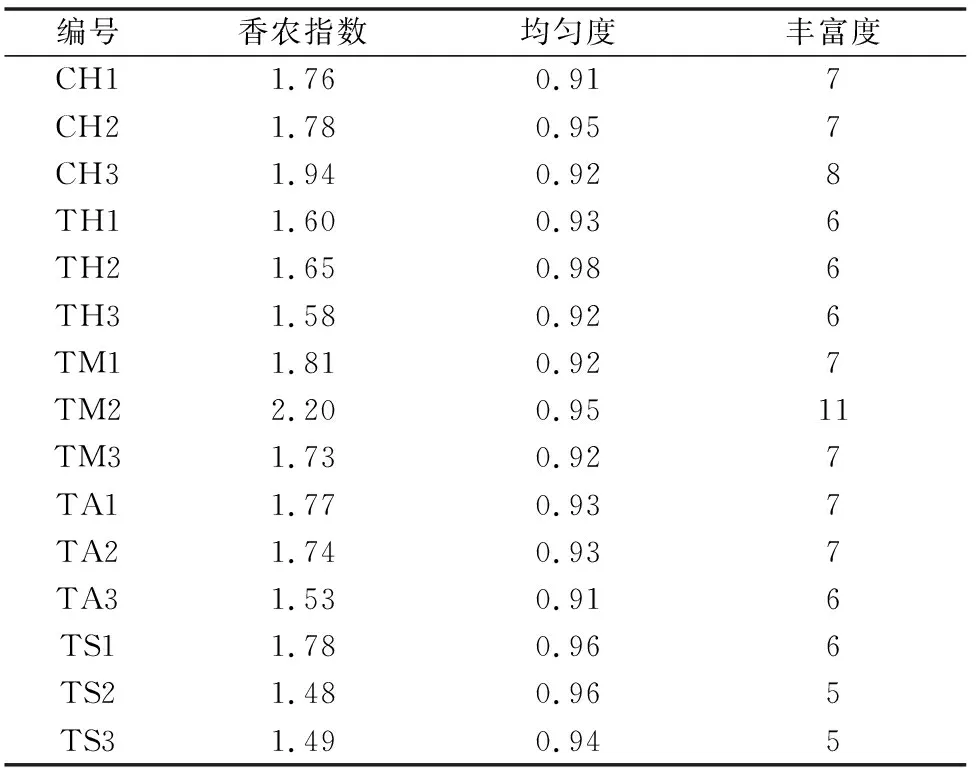
表2 基于DGGE图谱的土壤样品微生物多样性分析
2.2 DGGE图谱的主成分分析
为了使DGGE结果显现更加直观,本试验中将DGGE图谱进行量化,根据其灰度进行主成分分析。由图1可知,在施用微生物菌剂后短时间内,处理组4个品种和对照组辣椒根围土壤微生物多样性差异不明显,但随着种植时间的延长,处理组中TM、TA组与对照组之间逐渐开始显现差异性,而TH、TS组无明显变化,说明微生物菌剂的应用能够改变辣椒根围微生物的组成与密度。

2.3 DGGE测序条带的系统发育树构建
为明确施用微生物菌剂对辣椒根围微生物种类的影响,对DGGE指纹图谱中差异条带进行切胶测序比对。由图2可知,在处理组和对照组中有些微生物类群始终处于优势种群地位,如球形杆菌属(band6,Sphaerobactersp.)、Dyella属(band7,Dyellasp.)、链霉菌属(band32,Streptomycessp.)等。另外,使用微生物菌剂后辣椒根围新出现的微生物类群主要包括类香味菌属(band12,Myroidessp.)、芽孢杆菌属(band 36,Bacillussp.)、嗜冷芽孢杆菌属(band27,Psychrobacillussp.)、赤细菌属(band28,Erythrobactersp.)等,其中出现最多的为芽孢杆菌属,芽孢杆菌为微生物菌肥“宁盾”的主要成分。
2.4 土壤酶活性测定结果
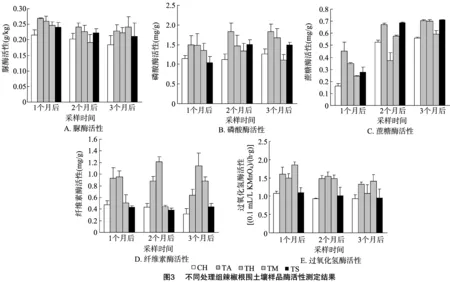
由图3可知,微生物菌肥处理后,在3个采样时间点,处理组的土壤酶活性相对对照组普遍升高。不同辣椒品种之间土壤酶活性变化差异不大。作为同一品种,红优4号经过微生物菌肥处理后在3个采样时间点除蔗糖酶外所有土壤酶活性均明显高于对照组,其中脲酶活性分别提高20%、12%、21%,磷酸酶活性分别提高29%、31%、33%,纤维素酶活性分别提高100%、180%、265%,过氧化氢酶活性分别提高40%、66%、16%。说明微生物菌肥使用后能够在一定时期内提高辣椒根围土壤酶活性。
2.5 土壤主要营养指标测定结果
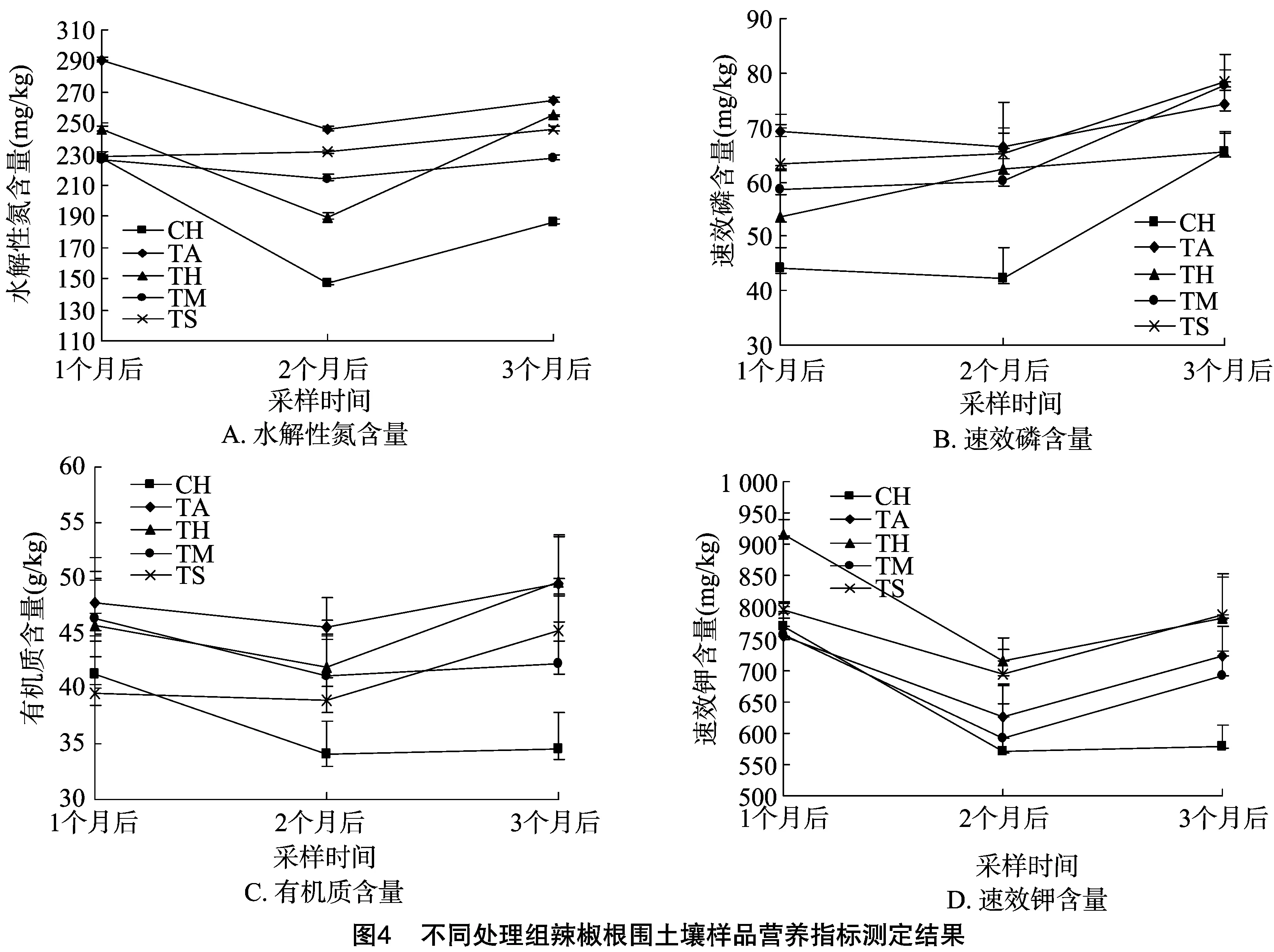
由图4可知,微生物菌肥处理组和对照组在3个采样时间点根围土壤中氮、磷、钾及有机质含量变化趋势基本一致,均呈先降后升的趋势。但微生物菌肥处理组在3个时间点的主要营养指标含量均高于对照组。不同辣椒品种之间,在微生物菌肥处理后3个时间点氮、磷、钾及有机质含量差异不大。在同一品种红优4号中,微生物菌肥处理组与对照组相比水解性氮含量分别提高8%、29%、37%,速效磷含量分别提高21%、48%、0,速效钾含量分别提高19%、26%、36%,有机质含量分别提高11%、23%、43%。除了处理3个月后时的速效磷含量之外,其他营养指标在3个时间点的提高幅度均呈现上升趋势。说明在微生物菌肥处理后,能够在更长时间内为寄主植物提供充足营养。
3 讨论与结论
微生物菌肥由于含有能够协助寄主植物抗病促生的活性有益菌,在施用后能够在植物根围有效定殖,且在较长时期内通过提高土壤酶活性、加速土壤中养分循环、抑制病害发生等方面发挥有益作用[15-16]。但对于微生物菌肥的使用方式、对不同土壤条件的适应性以及在不同品种寄主植物上的作用差异等还须要更深入地研究。
本研究通过PCR-DGGE分析方法研究了微生物菌肥“宁盾”在不同辣椒品种上使用后对于寄主根围细菌多样性的变化,并测定了相关土壤酶活性以及土壤主要养分含量的变化情况。发现在“宁盾”使用以后,其中主要成分芽孢杆菌能够在寄主根围土壤中稳定定殖,且随着生长期的延长,处理组与对照组在根围细菌多样性上开始逐渐呈现差异化。同时,与根围微生物活性相关的几种土壤酶活性在处理组中均高于对照组,包括脲酶、过氧化氢酶、蔗糖酶,纤维素酶、磷酸酶等。另外,从辣椒根围土壤中主要养分指标测定结果来看,处理组均明显高于对照组,且随着辣椒生长期的延长,主要营养指标在3个时间点的提高幅度基本呈上升趋势。说明在微生物菌肥处理后,能够在更长时间内为寄主植物提供充足营养。从辣椒品种来看,微生物菌肥使用后在不同辣椒品种之间的影响差异不明显。
:
[1]王立华,王锡明,吴洪斌. 淮安红椒产业现状及发展对策[J]. 长江蔬菜,2012(18):95-97.
[2]赵 平. 多途径打造“淮安红椒”品牌[J]. 江苏农村经济,2012(7):31-31.
[3]张政兵,郭海明. 辣椒疫病防治研究进展[J]. 农药研究与应用,2006,10(4):10-12.
[4]Segarra G,Aviles M,Casanova E,et al. Effectiveness of biological control ofPhytophthoracapsiciin pepper byTrichodermaasperellumstrain T34[J]. Phytopathologia Mediterranea,2013,52(1):77-83.

[5]Sopheareth M,Chan S,Naing K W,et al. Biocontrol of late blight (Phytophthoracapsici) disease and growth promotion of pepper byBurkholderiacepaciaMPC-7[J]. The Plant Pathology Journal,2013,29(1):67-76.
[6]刘永亮,尹成林,田叶韩,等. 拮抗真菌HTC的鉴定及其对辣椒疫病的生物防治潜力[J]. 植物保护学报,2013,40(5):437-444.
[7]欧雄常,柳 凤,詹儒林,等. 拮抗辣椒疫病菌的红树内生细菌筛选及 RS261 菌株鉴定[J]. 微生物学通报,2009,36(2):175-180.
[8]柳 凤,欧雄常,何 红,等. 红树内生细菌RS261菌株防治辣椒疫病的初步研究[J]. 植物病理学报,2009,39(3):333-336.
[9]Sang M K,Kim K D. The volatile-producingFlavobacteriumjohnsoniaestrain GSE09 shows biocontrol activity againstPhytophthoracapsiciin pepper[J]. Journal of Applied Microbiology,2012,113(2):383-398.
[10]Liu H X,Li S M,Luo Y M,et al. Biological control ofRalstoniawilt,Phytophthorablight,Meloidogyneroot-knot on bell pepper by the combination ofBacillussubtilisAR12,BacillussubtilisSM21 andChryseobacteriumsp. R89[J]. European Journal of Plant Pathology,2014,139(1):107-116.
[11]Zhou D M,Wang K P,Liu H X,et al. Field evaluation of different application methods of the mixture ofBacilluscereusstrain AR156 andBacillussubtilisstrain SM21 on pepper growth and disease resistance[J]. Biocontrol Science and Technology,2014,24(12):1451-1468.
[12]Heuer H,Wieland G,Schönfeld J,et al. Bacterial community profiling using DGGE or TGGE analysis[J]. Environmental Molecular Microbiology:Protocols and Applications,2001,9:177-190.
[13]关松荫. 土壤酶及其研究法[M]. 北京:农业出版社,1986.
[14]鲁如坤. 土壤农化分析法[M]. 北京:农业科学出版社,2000.
[15]乔蓬蕾,张艳云,谢全喜,等. 微生物菌肥修复作物连作障碍的机理[J]. 农村经济与科技,2015,26(3):8-9,7.
[16]胡 可,王 琳,秦俊梅,等. 菌肥与有机无机肥配施对石灰性土壤生化作用强度和微生物数量的影响[J]. 河南农业科学,2015,44(10):76-80.

