群体感应分子法尼醇与白念珠菌和宿主相互作用机制研究进展
方阳欣, 唐建国
白念珠菌(Candida albicans)是人类中定植于消化道、泌尿生殖道和皮肤黏膜上最常见的机会性致病真菌之一[1]。一旦机体免疫功能减退,白念珠菌会大量繁殖并改变形态结构,侵入机体引起疾病。白念珠菌的双相性转换,尤其是由酵母相向菌丝相的转换,在其致病性中发挥着关键作用[2]。除了许多环境因素,如温度、二氧化碳浓度以及酸碱度等可触发白念珠菌的形态转换,白念珠菌自身产生的群体感应分子(quorum sensing molecule)也可调控菌体的形态[1,3]。法尼醇(farnesol)是第1个在白念珠菌中发现的群体感应分子,其功能有调控白念珠菌的双相性相互转换(morphology)、影响生物膜(biofilm)的生成和调节宿主免疫等[4-6]。因此,本文就法尼醇与白念珠菌、宿主免疫的相互关系作一综述。
1 法尼醇影响白念珠菌双相性互相转换
法尼醇是在白念珠菌中第1个被发现可调节菌丝生长的群体感应分子。大量研究表明,在菌株密度<106cfu/mL,白念珠菌主要向菌丝形式发展,反之在密度≥106cfu/mL,则主要以酵母为生长方式,这种现象受法尼醇控制[3]。法尼醇主要抑制酵母相向菌丝相的转换,不改变已生成菌丝的细胞生长率,然而对其在菌丝相转换为酵母相的过程中以及维持菌丝的生长中所产生的影响知之甚少。此外,法尼醇产生作用的过程中存在剂量、介质和时间依赖性,与剂量成正相关,与时间成负相关[7]。目前,有研究发现法尼醇在琼脂包埋和液体介质的条件下促进菌丝相向芽孢相的转换,尤其是处理芽孢6 h后形成的菌丝,并且与温度成负相关,但是诱导该转换发生的速度慢于菌丝的萌发[8],该过程的发生所涉及的分子机制尚未明确。
法尼醇抑制白念珠菌的双相性转换涉及一系列的因子,如Tup1、Nrg1、Ras1、Cyr1、Efg1、Cek1和Chk1。Tup1是一种转录抑制因子,与转录遏制子Ssn6 或Tcc1一起抑制基因的表达[9]。Kebaara等[10]研究发现Tup1和转录调节因子,即DNA结合蛋白Nrg1和Rfg1共同抑制菌丝特异性基因(HWP1和RBT1)的表达,法尼醇增加TUP1mRNA表达以及蛋白质的合成。Lu等[11]研究发现菌丝形成可通过Sok1激酶介导Nrg1蛋白质降解,法尼醇主要通过抑制SOK1的表达进而抑制Nrg1蛋白质的降解,该过程主要通过抑制由N端规则E3泛素连接酶Ubr1介导的转录抑制因子Cup9的降解所产生(图1)。

图1 法尼醇调控白念珠菌菌丝形成转录因子
法尼醇可调控白念珠菌酵母和菌丝丝状生长中涉及信号通路中的关键酶[12]。酵母至丝状形式的转化可经许多途径激活,包括Ras/cAMP依赖性途径,CEK1促分裂原活化蛋白激酶(MAPK)途径和Chk1双组分信号转导途径[13]。法尼醇抑制Ras1-Cyr1(Cdc35)-cAMP-PKA-Efg1信号通路,由此抑制芽孢和菌丝的转换、生物膜的形成和应激反应基因,如表达过氧化氢酶的CTA1[14-16]。白念珠菌Ras1定位于质膜,在GTP结合模式时和Cyr1相互作用,增加cAMP的生成从而促进酵母相转化为菌丝相,法尼醇可直接抑制Cyr1和改变Ras1蛋白质中与法尼醇和法尼基相似性结构。由此得出,法尼醇可干扰Ras1翻译后修饰或法尼基化的Ras1与膜的相互作用[14]。研究表明法尼醇在生物相关浓度下不改变Ras1质膜定位,但是抑制了由细胞质中的Ras1突变体靶向介导的菌丝诱导[17]。目前有研究发现完整的Ras1在菌丝中含量更高,并且裂解的Ras1抑制菌丝生长,Ras1的裂解受Ras1-cAMP通路所抑制,两者之间存在一个正反馈环路,法尼醇抑制Cyr1的活性,从而使裂解的Ras1增多,抑制菌丝的生成[18]。有研究证明法尼醇对于该条信号通路中的cAMP的磷酸二酯酶Pde1和Pde2无影响,升高cAMP反应性转录因子CTA1和HSP12mRNA的含量水平,减少HWP1mRNA的含量,同时这一抑制过程可以被二丁酰基-cAMP(db-cAMP)所逆转[16]。Czf1白念珠菌锌指转录调节因子可以诱导白念珠菌的菌丝生长,CZF1的表达受Ras1-cAMP激活的转录因子Efg1调节,此外,Czf1和Efg1对于白念珠菌的双相性转换具有相互拮抗作用[19]。Langford等[20]研究发现Czf1是法尼醇发挥作用的一个重要下游效应因子,并且与Efg1一起参与白念珠菌中的法尼醇介导细胞死亡的控制,但是CZF1mRNA水平不受法尼醇的调节,同时发现PKA的亚型Tpk1受法尼醇的调节,进而抑制菌丝生长。cAMP-PKA信号通路还可下调主要的菌丝形成抑制因子NRG1以及转录抑制因子TUP1的表达,增加菌丝的生成。细胞周期蛋白可以调控白念珠菌的双相性生长,G1期的细胞周期蛋白依赖性激酶(CDK)和G2期CDK分别产生细胞的极性生长和各向同性生长[21]。Hgc1是G1细胞周期蛋白相关蛋白,并与CDK CaCdc28共沉淀。有研究发现在菌丝形成的诱导条件下HGC1高度表达,只在细胞周期G1期发挥作用,即促进细胞的极性生长,法尼醇则抑制HGC1的表达,即抑制菌丝的生长,菌丝诱导信号通过cAMP-PKA途径和其下游转录因子Efg1激活HGC1表达,在酵母细胞中,HGC1被Tup1-Nrg1阻遏物复合物抑制,然而,有丝分裂原活化蛋白激酶(MAPK)途径和其效应转录因子Cph1不参与[22]。Carlisle等[23]证明HGC1在菌丝诱导后立即被激活,而Ume6不参与HGC1表达的初始激活,维持HGC1的表达必不可少。Banerjee等[24]研究发现Efg1和Sun4在Ume6诱导白念珠菌某些丝特异性转录物的能力中起重要作用。此外,Cek1MAPK介导的通路影响白念珠菌菌丝的产生,该条通路中主要由Hst7MAPKK、跨膜蛋白Sho1及其下游信号分子组成[25-26]。MAP激酶通过调节一般氨基酸通透酶(GAP1)表达影响菌丝的生长,该过程可以被法尼醇所抑制[27]。研究证明法尼醇还可通过降低HST7和CPH1 mRNA的表达水平来抑制MAP激酶的活性。然而,MAP激酶不影响ALS家族、HYR1和HWP1这些菌丝特异性mRNAs的表达[28]。法尼醇还可抑制Cek1磷酸化,这一过程依赖于Sho1跨膜蛋白而不依赖于Chk1途径(图2)[25]。
2 法尼醇抑制白念珠菌生物膜的形成
生物被膜定义为一种由互利共生的微生物复合体组成,体内外均可形成表面关联的、封闭在自身产生的保护性胞外基质中的高度结构化群落,具有保护菌体、抵抗物理和化学不利因素、协同菌体代谢以及参与菌落的基因表达调控等特性[29]。
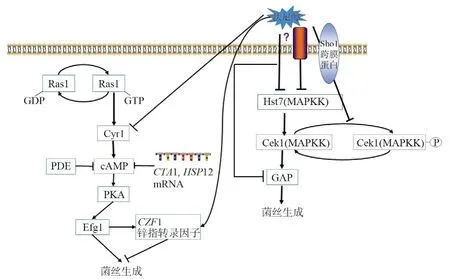
图2 法尼醇调控白念珠菌菌丝生成信号通路
白念珠菌成熟的生物膜是由细胞外基质包围的酵母、菌丝和假菌体组成的结构化群落,其形成的特征主要分为6个阶段,分别是酵母细胞的初始黏附(0~2 h);萌发和微集落形成(2~4 h);细丝化,即白念珠菌的双相性转换,从芽殖酵母形式到丝状真菌形式的转变,中间过程是细丝、假菌丝直至形成菌丝(4~6 h);单层发展(6~8 h);与相邻酵母形成的菌丝编织形成网络结构,增殖(8~24 h);三维空间结构的形成和成熟(24~48 h)[1]。法尼醇是抑制白念珠菌生物膜形成的主要因素之一。研究指出法尼醇抑制生物膜的形成具有剂量依赖性,但是法尼醇只在白念珠菌菌丝形成之前发挥作用,下调编码菌丝特有的细胞壁HWP1的表达[30]。Cao等[31]研究发现法尼醇通过调节多种基因的表达,从而达到抑制生物膜形成的目的,如菌丝形成基因、细胞膜形成基因、维持细胞壁相关作用的基因、铁转运基因、编码热休克蛋白的数种基因以及细胞疏水性基因和生物膜形成后高表达的耐药性基因。近年来有研究表明,从食用地衣分离的膳食类黄酮槲皮素可以作为致敏剂提高氟康唑抗白念珠菌的效力,并且这种致敏作用依赖于槲皮素产生的法尼醇效应[32]。很多体外研究数据表明,氟康唑和法尼醇具有协同抗生物膜形成的作用,生物膜的结构变化取决于两者的联合效应,其最大联合效应取决于法尼醇的浓度[33],而Bozo等[34]研究发现基于用局部抑制浓度指数评价,氟康唑和法尼醇的协同作用只存在于SC5314菌株,其余的无论是对于氟康唑敏感或者抵抗的菌株,两者的协同作用均未明确。
3 法尼醇与宿主免疫系统的相互作用
法尼醇是白念珠菌自分泌的形态调节剂,抑制白念珠菌转换至菌丝致病相,但是它在哺乳动物体内成为白念珠菌致病性的一种毒力因子,增加白念珠菌的播散性。Navarathna等[35]第1次发现通过敲除菌株内编码将法尼基焦磷酸转化为法尼醇磷酸酶的DPP3基因,从而减少白念珠菌自身产生法尼醇,并将该菌株接种至小鼠体内,菌株引起的小鼠死亡率明显降低。他们通过口服、腹腔注射等方式给予法尼醇至小鼠体内,发现法尼醇会加速感染白念珠菌小鼠的死亡,并证明该现象可能与增加白念珠菌在肾脏的定植有关。
在抵御系统性白念珠菌病的过程中,宿主体内早期的固有免疫发挥着重要作用,单核细胞和巨噬细胞通过吞噬作用和氧化或者非氧化机制破坏白念珠菌的菌丝和酵母。在适应性免疫应答过程中,巨噬细胞、T细胞及其分泌的细胞因子限制白念珠菌在宿主体内进行播散。Navarathna等[36]发现法尼醇以腹腔内注射的方式给予感染白念珠菌的小鼠,抑制辅助性T1(Th1)细胞产生干扰素(IFN)-γ和白细胞介素(IL)-12,减少巨噬细胞产生IL-12 p40和p70,增加Th2细胞产生IL-5,而肿瘤坏死因子α(TNF-α)无变化。在细胞水平的实验中证明[37],法尼醇主要诱导巨噬细胞内的氧化应激反应,使得胞内DNA片段断裂,可能参与细胞的凋亡从而抑制巨噬细胞的吞噬等抗白念珠菌感染的功能,该氧化应激反应可以被普罗考布和维生素E等抗氧化剂阻断。近年来,有研究发现法尼醇可刺激巨噬细胞的随意趋化性运动并且增加宿主体内巨噬细胞的腹膜浸润[38],然而白念珠菌被巨噬细胞吞噬3~6 h后,通过形成穿透巨噬细胞质膜的菌丝杀死巨噬细胞,从而产生免疫逃逸[39]。至于其他固有免疫细胞,Leonhardt等[39]研究发现法尼醇通过以下方面影响细胞的功能,从而减少机体对于白念珠菌的吞噬以及清除,①法尼醇增加单核细胞(CD86和HLA-DR)和中性粒细胞(CD66b和CD11b)表面的活化标志物的表达,并促进氧化应激暴发和促炎细胞因子[TNF-α、巨噬细胞炎症蛋白1α(MIP-1α)]的释放,但是该作用并不增加细胞摄取或杀死白念珠菌。②高浓度法尼醇阻断单核细胞分化为未成熟的树突状细胞(iDC),尤其降低几种对细胞成熟和抗原呈递有重要作用的标志物如CD1a、CD83、CD86和CD80的表达。③法尼醇影响树突状细胞多种炎性因子的释放、限制细胞的迁移和阻止细胞进行抗原呈递,从而限制Th1细胞的免疫应答,这些过程可能均由于iDC对于粒细胞-巨噬细胞集落刺激因子(GM-CSF)的低水平应答并表现出单核细胞的特性。
4 小结与展望
法尼醇调控白念珠菌的形态转换,有助于深入了解白念珠菌的信号传递。近10年深入研究了法尼醇作用于白念珠菌形态转换相关信号通路中的下游关键分子,但是法尼醇作用的上游信号分子和具体胞膜或者质膜受体及其他结合部位尚需进一步明确。法尼醇在宿主体内可能成为白念珠菌的一种致病因子,其对于宿主免疫细胞的氧化应激和诱导凋亡作用机制尚未明确,有待进一步在体内外研究法尼醇与免疫细胞相互作用及其具体机制。研究证实法尼醇的同分异构体在抑制白念珠菌双相性的转换及生物膜的形成等作用中,虽然效力很低但不会成为致病因子,那么深入研究法尼醇的同分异构体将有望开发新型抗白念珠菌的药物或者辅助用药,减少耐药白念珠菌的产生。
[1] RAMAGE G, VANDEWALLE K, WICKES BL, et al.Characteristics of biofilm formation byCandida albicans[J].Rev Iberoam Micol, 2001, 18(4): 163-170.
[2] YAPAR N. Epidemiology and risk factors for invasive candidiasis[J]. Ther Clin Risk Management, 2014, 10(default): 95.
[3] HORNBY JM, JENSEN E C, LISEC AD, et al. Quorum sensing in the dimorphic fungusCandida albicansis mediated by farnesol [J]. Appl Environ Microbiol, 2001, 67(7): 2982-2992.
[4] ALBUQUERQUE P, CASADEVALL A. Quorum sensing in fungi – a review [J]. Med Mycol, 2012, 50(4): 337-345.
[5] WONGSUK T, PUMEESAT P, LUPLERTLOP N. Fungal quorum sensing molecules: role in fungal morphogenesis and pathogenicity [J]. J Basic Microbiol, 2016, 56(5): 440-447.
[6] ALLISON DL, WILLEMS HM, JAYATILAKE JA, et al.Candida-bacteria interactions: their impact on human disease [J].Microbiol Spectr, 2016, 4(3).
[7] MOSEL DD, DUMITRU R, HORNBY JM, et al. Farnesol concentrations required to block germ tube formation inCandida albicansin the presence and absence of serum [J]. Appl Environ Microbiol, 2005, 71(8): 4938-4940.
[8] LINDSAY AK, DEVEAU A, PIISPANEN AE, et al. Farnesol and cyclic AMP signaling effects on the hypha-to-yeast transition inCandida albicans[J]. Eukaryot Cell, 2012, 11(10): 1219-1225.
[9] KANEKO A, UMEYAMA T, UTENA-ABE Y, et al. Tcc1p,a novel protein containing the tetratricopeptide repeat motif,interacts with Tup1p to regulate morphological transition and virulence inCandida albicans[J]. Eukaryotic Cell, 2006, 5(11): 1894-1905.
[10] KEBAARA BW, LANGFORD ML, NAVARATHNA DH,et al.Candida albicansTup1 is involved in farnesol-mediated inhibition of filamentous-growth induction [J]. Eukaryot Cell,2008, 7(6): 980-987.
[11] LU Y, SU C, UNOJE O, et al. Quorum sensing controls hyphal initiation inCandida albicansthrough Ubr1-mediated protein degradation [J]. Proc Natl Acad Sci USA, 2014, 111(5):1975-1980.
[12] POLKE M, SPRENGER M, SCHERLACH K, et al. A functional link between hyphal maintenance and quorum sensing inCandida albicans[J]. Mol Microbiol, 2017, 103(4): 595-617.
[13] KRUPPA M, KROM BP, CHAUHAN N, et al. The twocomponent signal transduction protein Chk1p regulates quorum sensing inCandida albicans[J]. Eukaryot Cell, 2004, 3(4):1062-1065.
[14] HALL RA, TURNER KJ, CHALOUPKA J, et al. The quorumsensing molecules farnesol/homoserine lactone and dodecanol operate via distinct modes of action inCandida albicans[J].Eukaryot Cell, 2011, 10(8): 1034-1042.
[15] DEVEAU A, PIISPANEN AE, JACKSON AA, et al. Farnesol induces hydrogen peroxide resistance inCandida albicansyeast by inhibiting the ras-cyclic AMP signaling pathway [J].Eukaryotic Cell, 2010, 9(4): 569-577.
[16] DAVIS-HANNA A, PIISPANEN AE, STATEVA LI, et al.Farnesol and dodecanol effects on theCandida albicansRas1-cAMP signalling pathway and the regulation of morphogenesis[J]. Mol Microbiol, 2008, 67(1): 47-62.
[17] PIISPANEN AE, BONNEFOI O, CARDEN S, et al. Roles of Ras1 membrane localization duringCandida albicanshyphal growth and farnesol response [J]. Eukaryot Cell, 2011, 10(11):1473-1484.
[18] PIISPANEN AE, GRAHL N, HOLLOMON JM, et al.Regulated proteolysis ofCandida albicansRas1 is involved in morphogenesis and quorum sensing regulation [J]. Mol Microbiol, 2013, 89(1): 166-178.
[19] ZORDAN RE, GALGOCZY DJ, JOHNSON AD. Epigenetic properties of white-opaque switching inCandida albicansare based on a self-sustaining transcriptional feedback loop [J]. Proc Natl Acad Sci USA, 2006, 103(34): 12807-12812.
[20] LANGFORD ML, HARGARTEN JC, PATEFIELD KD, et al.Candida albicansCzf1 and Efg1 coordinate the response to farnesol during quorum sensing, white-opaque thermal dimorphism, and cell death [J]. Eukaryot Cell, 2013, 12(9):1281-1292.
[21] MOSELEY JB, NURSE P. Cdk1 and cell morphology :connections and directions [J]. Current Opini Cell Biol, 2009,21(1): 82-88.
[22] ZHENG X, WANG Y, WANG Y. Hgc1, a novel hypha-specific G1 cyclin-related protein regulatesCandida albicanshyphal morphogenesis [J]. EMBO J, 2004, 23(8): 1845-1856.
[23] CARLISLE PL, KADOSH D.Candida albicansUme6, a filament-specific transcriptional regulator, directs hyphal growth via a pathway involving Hgc1 cyclin-related protein [J].Eukaryotic Cell, 2010, 9(9): 1320-1328.
[24] BANERJEE M, UPPULURI P, ZHAO XR, et al. Expression of UME6, a key regulator ofCandida albicanshyphal development, enhances biofilm formation via Hgc1- and Sun41-dependent mechanisms [J]. Eukaryot Cell, 2013, 12(2): 224-232.
[25] ROMÁN E, ALONSO-MONGE R, GONG Q, et al. The Cek1 MAPK is a short-lived protein regulated by quorum sensing in the fungal pathogenCandida albicans[J]. FEMS Yeast Res,2009, 9(6): 942-955.
[26] BROWN AJ, BUDGE S, KALORITI D, et al. Stress adaptation in a pathogenic fungus [J]. J Exp Biol, 2014, 217(Pt 1): 144.
[27] BISWAS S, ROY M, DATTA A. N-acetylglucosamine-inducible CaGAP1 encodes a general amino acid permease which coordinates external nitrogen source response and morphogenesis inCandida albicans[J]. Microbiology, 2003, 149(Pt 9):2597-2608.
[28] SATO T, WATANABE T, MIKAMI T, et al. Farnesol, a morphogenetic autoregulatory substance in the dimorphic fungusCandida albicans, inhibits hyphae growth through suppression of a mitogen-activated protein kinase cascade [J]. Biol Pharm Bull, 2004, 27(5): 751-752.
[29] DEVEAU A, HOGAN DA. Linking quorum sensing regulation and biofilm formation byCandida albicans[J]. Methods Mol Biol, 2011, 692 :219-633.
[30] RAMAGE G, SAVILLE SP, WICKES BL, et al. Inhibition ofCandida albicansbiofilm formation by farnesol, a quorumsensing molecule [J]. Appl Environ Microbiol, 2002, 68(11):5459-5463.
[31] CAO YY, CAO YB, XU Z, et al. cDNA microarray analysis of differential gene expression inCandida albicansbiofilm exposed to farnesol [J]. Antimicrob Agents Chemother, 2005, 49(2):584-589.
[32] SINGH BN, UPRETI DK, SINGH BR, et al. Quercetin sensitizes fluconazole-resistantCandida albicansto induce apoptotic cell death by modulating quorum sensing [J].Antimicrob Agents Chemother, 2015, 59(4): 2153-2168.
[33] KATRAGKOU A, MCCARTHY M, ALEXANDER EL,et al.In vitrointeractions between farnesol and fluconazole,amphotericin B or micafungin againstCandida albicansbiofilms[J]. J Antimicrob Chemother, 2015, 70(2): 470-478.
[34] BOZO A, DOMAN M, MAJOROS L, et al. Thein vitroandin vivoefficacy of fluconazole in combination with farnesol againstCandida albicansisolates using a murine vulvovaginitis model[J]. J Microbiol, 2016, 54(11): 753-760.
[35] NAVARATHNA DH, HORNBY JM, KRISHNAN N, et al.Effect of farnesol on a mouse model of systemic candidiasis,determined by use of a DPP3 knockout mutant ofCandida albicans[J]. Infect Immun, 2007, 75(4): 1609-1618.
[36] NAVARATHNA DH, NICKERSON KW, DUHAMEL GE, et al. Exogenous farnesol interferes with the normal progression of cytokine expression during candidiasis in a mouse model [J].Infect Immun, 2007, 75(8): 4006-4011.
[37] ABE S, TSUNASHIMA R, IIJIMA R, et al. Suppression of anti-Candidaactivity of macrophages by a quorum-sensing molecule, farnesol, through induction of oxidative stress [J].Microbiol Immunol, 2009, 53(6): 323-330.
[38] HARGARTEN JC, MOORE TC, PETRO TM, et al.Candida albicansquorum sensing molecules stimulate mouse macrophage migration [J]. Infect Immun, 2015, 83(10): 3857-3864.
[39] LEONHARDT I, SPIELBERG S, WEBER M, et al. The fungal quorum-sensing molecule farnesol activates innate immune cells but suppresses cellular adaptive immunity [J]. MBio, 2015, 6(2): e00143.

