慢性乙型肝炎病毒感染孕妇抗病毒停药时间对产后肝功能及母婴传播的影响
尹迎辉 , 董明亮, 石 梅, 王 玫
对于HBsAg和HBeAg双阳性母亲所生新生儿,如不采取阻断措施,将有85%~95%被乙型肝炎病毒(HBV)感染,联合应用乙肝疫苗和免疫球蛋白,母婴阻断成功率达到90%,再联合妊娠中晚期核苷(酸)类抗病毒药物降低分娩期HBV DNA水平,使母婴阻断成功率几乎达到100%[1]。目前,对于慢性HBV感染孕妇开始抗病毒治疗的时间研究较多,对于产后停用抗病毒药的时间尚不甚明确,自分娩后至产后12周各异。现回顾性分析HBV感染的免疫耐受期孕妇的病例资料,研究产后不同停药时间对肝功能和母婴传播的影响,旨在探讨更为安全合理的停用抗病毒药物的孕周。
1 材料与方法
1.1 资料来源
收集2013年1月1日-2016年6月1日在我院妇产科产检、住院分娩,且完成产后1年随访的孕期应用核苷(酸)类抗病毒治疗的慢性HBV感染孕妇共343例。纳入标准:慢性HBV感染孕妇;HBsAg阳性;既往未曾抗病毒治疗;孕前丙氨酸转氨酶(ALT)及天冬氨酸转氨酶(AST)≤40 U/L;HBV DNA≥106IU/mL。排除标准:肝硬化或肝癌;合并人类免疫缺陷病毒(HIV)、丙型肝炎病毒(HCV)、梅毒、TORCH、甲型肝炎、戊型肝炎等其他肝炎病毒感染。本研究根据产后停用抗病毒药的时间,产后立即停药者为P0组,产后6周停药者为P6w组。
1.2 研究方法
孕妇孕24周检测血清HBV DNA ≥106IU/mL,根据DNA序列测定或HBV基因突变(YMDD)检测结果无变异者给予替比夫定(telbivudine)600 mg/d,有变异者给予替诺福韦(tenofovir)300 mg/d。新生儿出生后12 h内不同部位注射乙型肝炎疫苗10 µg和乙肝免疫球蛋白100 IU,生后1和6个月注射第2和第3针乙肝疫苗。婴儿7~12个月时检查HBsAg及HBV DNA,若HBsAg阳性或HBV DNA阳性则定义为HBV母婴传播。
1.3 观察指标
孕妇孕期及产后ALT异常发生率、产后ALT峰值及峰值发生时间和母婴传播情况。
1.4 检测方法
HBV DNA采用实时荧光定量PCR系统检测(罗氏公司LC-480PCR仪),检测下限为40 IU/ mL;血清学标志物HBsAg等检测采用化学放光法(美国Abbott公司);肝脏生物化学指标检测用日本OLYMPUS生物化学检测仪,试剂为英国道朗公司产品。
1.5 统计学方法
采用SPSS 24.0软件进行统计分析。患者的年龄、ALT峰值、ALT峰值发生时间为计量资料且呈正态分布,以x±s表示,两组的比较采用两独立样本t检验,其余资料为计数资料,统计分析采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基本资料
343例应用核苷(酸)类抗病毒治疗的慢性HBV感染孕妇,其中P0组159例,P6w组184例。两组在年龄、产次、分娩方式、基因型及不同抗病毒药之间差异无统计学意义(P>0.05)。见表1。
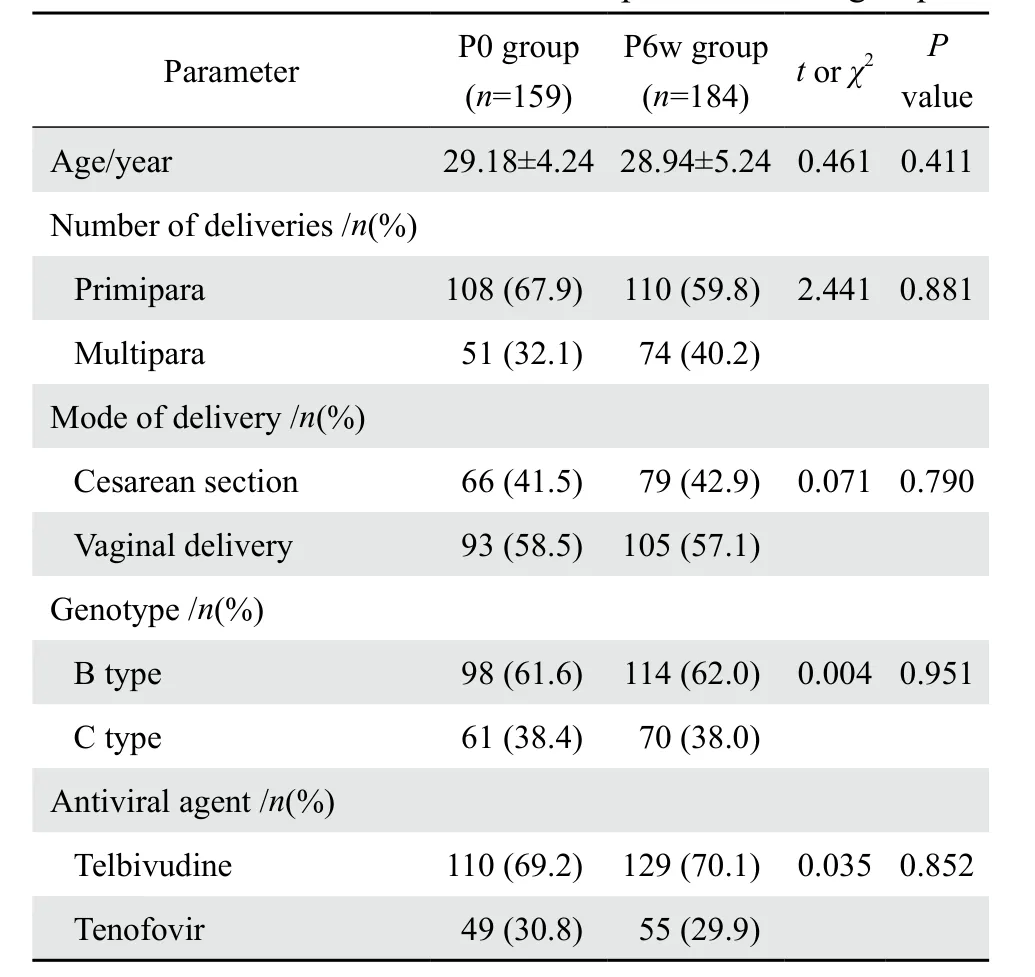
表1 两组一般情况Table 1 Patient characteristics compared between groups
2.2 两组患者停药时间对产后ALT的影响
2.2.1 孕期抗病毒患者停药时间对产后ALT的影响 不考虑孕期肝功能的情况下,P0组和P6w组患者产后ALT异常发生率分别为30.2%和20.7%,差异有统计学意义(χ2=4.129,P=0.046),两组ALT峰值分别为(151.6±169.1) U/L和(123.8±105.7)U/L, 差异有统计学意义(t=2.217,P=0.013),两组峰值发生时间分别为(46±14) d和(47±17)d,差异无统计学意义(t=0.587,P=0.302)。见表2。
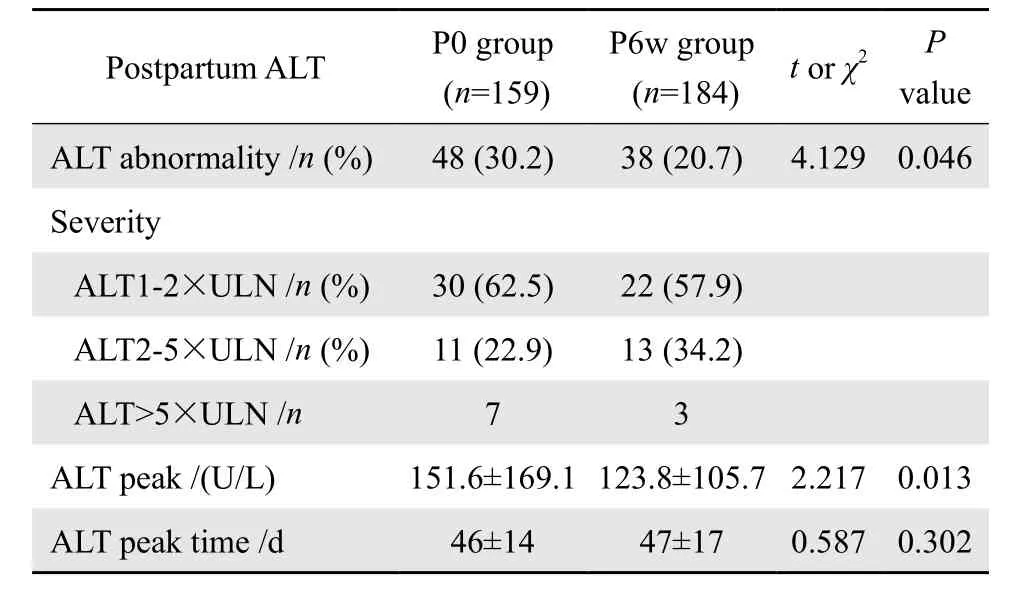
表2 343例孕期抗病毒患者停药时间对产后ALT的影响Table 2 Effect of the time of withdrawing antiviral therapy after delivery on the prevalence of postpartum ALT abnormality in 343 pregnant women
2.2.2 孕期肝功能升高患者抗病毒药停药时间对产后ALT的影响 孕期肝功能异常患者,P0组和P6w组患者产后ALT异常发生率分别为88.0%和39.4%,差异有统计学意义(χ2=14.043,P=0.001),两组ALT峰值分别为(223.4±173.9)U/L和(167.7±106.8)U/L,差异有统计学意义(t=1.505,P=0.042),两组峰值发生时间分别为(42±15)d和(45±14)d,差异无统计学意义(t=0.784,P=0.242)。见表3。
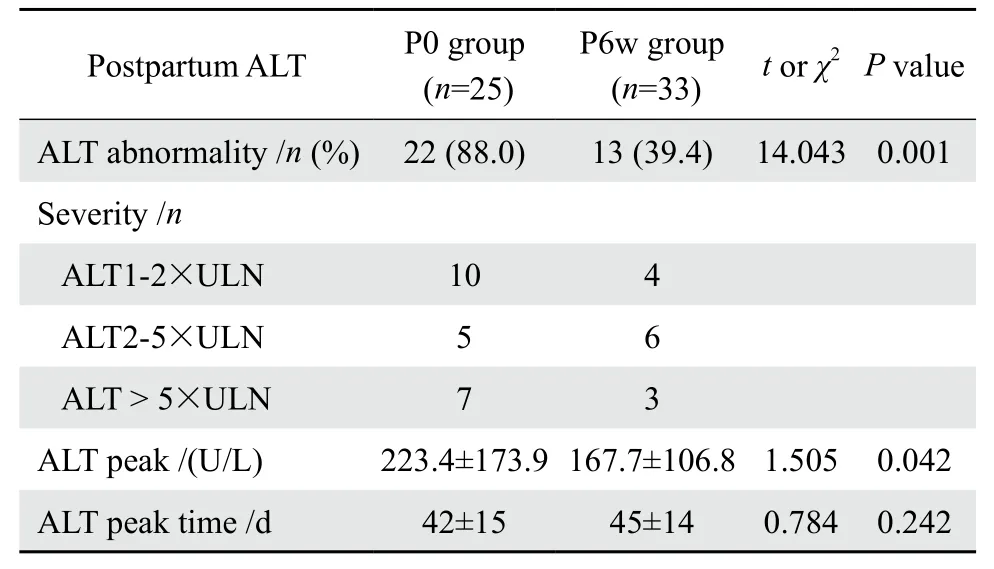
表3 58例孕期肝功能升高患者抗病毒停药时间对产后ALT的影响Table 3 Effect of the time of withdrawing antiviral therapy after delivery on the prevalence of postpartum ALT abnormality in 58 patients with abnormal liver function during pregnancy
2.2.3 孕期肝功能正常患者抗病毒药停药时间对产后ALT的影响 孕期肝功能正常患者,P0组和P6w组患者产后ALT异常发生率分别为19.4%和16.6%,差异无统计学意义(χ2=0.392,P=0.531),两组ALT峰值分别为(81.4±83.9)U/L和(72.7±91.8)U/L,差异无统计学意义(t=0.831,P=0.202),两组峰值发生时间分别为(49±14)d和(51±12)d,差异无统计学意义(t=1.298,P=0.112)。见表4。

表4 285例孕期肝功能正常患者抗病毒停药时间对产后ALT的影响Table 4 Effect of the time of withdrawing antiviral therapy after delivery on the prevalence of postpartum ALT abnormality in 285 patients with normal liver function during pregnancy
2.3 停药期间对母婴传播阻断成功率的影响
P0组和P6w组母婴传播阻断成功率均为100%。
3 讨论
目前,国内外相关指南[2-3]已达成共识,对于血清HBV DNA水平较高(>105~106IU/mL)的孕妇推荐于妊娠中晚期应用核苷(酸)类抗病毒药物,从而提高新生儿母婴传播阻断成功率。然而对于产后何时停用抗病毒药,是产后立即停药,还是于产后1个月、3个月或更长时间停药,迄今为止尚无一致意见。
本研究表明,孕期肝功能异常是产后肝功能异常的独立影响因素,而产后停药早晚对产后肝功能无影响。Nguyen 等[4]研究表明,延长抗病毒治疗不能阻止产后肝功能异常发生率,且不能增加HBeAg血清学转换率。既往研究报道[5-7],过早停用替比夫定可能增加产后转氨酶升高风险,但这些研究均未排除孕期转氨酶升高孕妇。已有研究表明,孕期转氨酶升高者产后更容易发生转氨酶升高,而与停用抗病毒药早晚无明显相关。排除孕期转氨酶升高的慢性乙型肝炎患者,产后发生肝功能异常的HBV感染者多数仅轻中度升高,且有其自身规律,不受孕期应用抗病毒药或产后停用抗病毒药早晚影响,而与产后劳累、内分泌变化和机体免疫状态等影响因素相关[8-9]。
产后停药早晚对母婴传播阻断的影响,既往研究显示,免疫耐受期孕期抗病毒治疗,降低分娩期HBV DNA水平,再联合乙肝疫苗和乙肝免疫球蛋白主被动免疫,使母婴传播接近于零。然而产后停用抗病毒药1个月左右HBV DNA恢复用药前的高病毒载量,对于产后立即停药并母乳喂养母亲所生婴儿,如此时尚未产生抗体者,是否会增加母婴传播阻断失败率,目前国内外相关研究尚不多[7-8,10-12]。本研究显示,无论产后立即停药还是产后6周停药,母婴传播阻断成功率均达100%。但本研究样本量较小,尚需多中心、大样本、前瞻性研究进一步验证。
总而言之,对于慢性HBV感染免疫耐受期以母婴传播阻断为目的口服核苷(酸)类抗病毒药的孕妇,产后停药早晚对肝功能无显著影响,但是对于孕期转氨酶异常患者,产后宜继续药物治疗。产后立即停药并母乳喂养者不影响母婴传播阻断率,但尚需进一步研究。
[1] 郑徽, 崔富强, 龚晓红,等. 我国育龄期妇女乙型肝炎病毒表面抗原及e抗原流行现状分析[J]. 中国疫苗和免疫,2010,16(6): 496-499.
[2] European Association for the Study of the Liver. EASL 2017 Clinical practice guidelines on the management of hepatitis B virus infection[J]. J Hepato, 2017,67(2): 370-398.
[3] 王贵强, 王福生, 成军,等. 慢性乙型肝炎防治指南(2015年版)[J]. 中华实验和临床感染病杂志(电子版), 2015,9(5):570-589.
[4] NGUYEN V, LEVY MT. Editorial: Anti-viral therapy for prevention of perinatal HBV transmission--extending therapy beyond birth and the risk of post-partum flare;authors' reply[J].Aliment Pharmacol Ther, 2014,40(1): 116.
[5] 庄虔莹, 刘敏, 付冬, 等. 孕期服用替比夫定进行乙型肝炎母婴阻断的产后肝功能观察[J]. 中华实验和临床感染病杂志(电子版), 2016,10(3): 337-341.
[6] ZHANG H, PAN CQ, PANG Q, et al. Telbivudine or lamivudine use in late pregnancy safely reduces perinatal transmission of hepatitis B virus in real-life practice[J].Hepatology,2014 ,60(2):468-476.
[7] CHEN HL, LEE CN, CHANG CH, et al. Efficacy of maternal tenofovir disoproxil fumarate in interrupting mother-to-infant transmission of hepatitis B virus[J]. Hepatology,2015, 62(2):375-386.
[8] LIU J, WANG J, JIN D, et al. Hepatic flare after telbivudine withdrawal and efficacy of postpartum antiviral therapy for pregnancies with chronic hepatitis B virus[J]. J Gastroenterol Hepatol,2017, 32(1): 177-183.
[9] CHANG CY, AZIZ N, POONGKUNRAN M, et al. Serum aminotransferase flares in pregnant and postpartum women with current or prior treatment for chronic hepatitis B[J]. J Clin Gastroenterol,2017,34(4):345-348 .
[10] HAN GR, JIANG HX, YUE X, et al. Efficacy and safety of telbivudine treatment: an open-label, prospective study in pregnant women for the prevention of perinatal transmission of hepatitis B virus infection[J]. J Viral Hepat, 2015,22(9):754-762.
[11] 魏宏, 庞秋梅. 妊娠期抗病毒治疗阻断HBV母婴传播研究进展[J]. 传染病信息, 2016, 29 (2): 73-76.
[12] 曹彦君, 易为, 刘敏, 等. 免疫耐受期HBV感染的孕妇产后肝功能变化[J]. 中华实验和临床感染病杂志(电子版),2013, 7 (3): 111-114.

