体脂含量与胃癌发生的孟德尔随机化研究
毛盈颖俞飞汪天培祁琪靳光付
1.浙江中医药大学公共卫生学院 杭州 310053 2.南京医科大学公共卫生学院
胃癌是发病率和死亡率较高的常见肿瘤,全球胃癌病例中约有42.5%发生在我国[1-2]。研究发现,胃癌的发生是遗传因素和环境因素共同作用的结果。幽门螺杆菌感染、吸烟、饮酒、食用腌制食物是公认的常见胃癌发生危险因素。在过去二十年里,大量流行病学证据提示肥胖与食管癌[3]、肝癌[4]、胰腺癌[5]、结直肠癌[6]等消化系统恶性肿瘤发生密切相关。然而就胃癌而言,这种关联是否真实存在尚有争议。一些大规模队列研究提示,肥胖与胃癌发生风险呈正相关[7-13],也有一些研究则认为两者不存在相关性[14-17]。然而,传统流行病学研究存在混杂偏倚,在进行因果推断时研究结果易受到各种混杂作用的干扰,使得病因推断结果不可信。例如,观察到的体脂含量与胃癌发生风险之间的关联可能是反向因果关系造成的偏倚,或是早期生活中饮食习惯等其他混杂因素暴露所致,这些偏倚在传统观察性流行病学研究设计中较难测量与控制。
孟德尔随机化(Mendelian randomization,MR)是采用遗传变异等工具变量作为测量环境、社会或行为因素的替代指标,对给定的暴露和结局(如体脂含量和胃癌发生)作出因果推断的方法[18]。由于受精卵形成过程中,等位基因遵循随机分配的原则,因此,理论上来说,从父母那里遗传了较多升高体脂含量的等位基因的人在出生时被随机分配到了“较高的体脂含量”。在MR研究设计中,基因型与疾病关联的效应估计不易受传统流行病学研究设计的混杂因素和反向因果关联的歪曲。MR研究与临床随机对照试验中的“意向治疗原则”有异曲同工之处,能够有效避免传统观察性研究中混杂因素和反向因果关系对关联效应的干扰[18]。
本研究采用病例对照设计,根据MR的方法,在7 004名中国汉族人群中,以全基因组关联研究(genome-wide association study,GWAS)Meta 分析[19]确定的10个体脂含量相关单核苷酸多态位点(single nucleotide polymorphism,SNP)作为工具变量,构建遗传评分,评估体脂含量与胃癌发生是否存在因果关联。
1 对象与方法
1.1 研究对象 研究对象的遗传变异数据来自南京/北京和美国国家癌症研究所(National Cancer Institute,NCI)胃癌全基因组研究[20-21]。南京/北京研究中,病例组为经组织病理学确诊的非贲门癌患者,对照组则来自当地居民体检中的健康人群[20]。NCI研究包括山西上消化道肿瘤遗传研究和河南林县营养干预试验两项独立研究[21]。所有研究对象均为中国汉族人群,均提供书面知情同意书,研究方案由相关机构审查委员会批准。
1.2 基因分型与填补 南京/北京研究采用了Affymetrix Genome-Wide Human SNP Array V.6.0芯片,NCI研究采用Illumina 660W-Quad芯片进行基因分型。采用PLINK软件(v1.07)进行质量控制,包括移除低应答率、过度杂合、性别错误或家庭关系模糊的样本。以1000 Genome Project基因型信息为参照,采用 IMPUTE2软件(v.2.2.2)进行基因型填补。采用EIGENSTRAT 3.0软件包进行主成分分析,评估南京/北京研究和NCI研究的人群结构。在后续分析中,进一步将分型率低于95%、最小等位基因频率(minor allele frequency,MAF)小于1%和对照人群中不符合哈-温遗传平衡定律(P<1×10-5)的 SNP剔除。
1.3 体脂含量相关遗传变异的选择 近期Lu等[19]进行的一项全基因组研究Meta分析发现了10个SNP与体脂含量在全基因组水平存在显著相关性(P<0.05),分别为:位于第 1号染色体的 rs543874,第2号染色体的rs2943652、rs6755502和rs6738627,第 13号染色体的 rs693839,第 16号染色体的rs4788099和rs1558902,第17号染色体的rs9906944,第18号染色体的rs6567160以及位于第19号染色体的rs6857。经连锁不平衡检验,这些遗传变异位点均来自相互独立的染色体片段(r2<0.01)。
1.4 统计学分析 采用PLINK v1.07以及Rv 3.3.0软件进行统计学分析。计量资料组间比较采用t检验、方差分析或非参数检验,计数资料组间比较采用卡方检验。采用卡方拟合优度检验分析对照组中各多态位点是否符合哈-温遗传平衡定律。采用加性遗传模型和多因素logistic回归模型分析体脂含量相关遗传变异与胃癌发生风险的关系。采用以下公式构建研究对象的体脂含量遗传风险评分(genetic risk score,GRS):其中,SNPi代表等位基因剂量(0、1、2分别表示与高体脂含量相关的效应等位基因的野生纯合、杂合和突变纯合型)。采用多因素logistic回归模型分析体脂含量GRS与胃癌发生的关联。进一步按年龄、性别、研究地域进行分层分析。亚组间异质性分析采用Cochran Q检验进行。以双侧α=0.05为统计学检验水准。
2 结果
2.1 体脂含量相关遗传变异与胃癌发生相关 本研究共包括胃癌病例2 631例,对照4 373例。全基因组关联研究Meta分析报道的10个体脂含量相关遗传变异位点在对照人群中的分布均符合哈-温遗传平衡定律。除rs2943652外,病例组中增加体脂含量的效应等位基因频率(effect allele frequency,EAF)均高于对照组。多因素logistic回归分析发现,在校正了年龄、性别、研究地域后,有2个遗传变异位点与胃癌发生风险之间存在统计学关联,分别是位于SEC16B 基因的 rs543874[比值比(odds ratio,OR)=1.108,95%可信区间(confidence interval,CI):1.018~1.206,P=0.017]和IFG2BP1基因的rs9906944(OR=1.265,95%CI:1.075~1.494,P=0.005)。见表1。
2.2 体脂含量GRS与胃癌发生风险相关 胃癌病例组与对照组的体脂含量GRS分布情况如图1所示。胃癌病例的GRS为(8.12±1.59)分,高于对照组的(7.94±1.60)分,差异有统计学意义(P=7.92×10-6)。在校正了年龄、性别和研究地域等因素后,多因素logistic回归分析发现,体脂含量GRS高的人群发生胃癌的风险较高。每增加一个升高体脂含量的等位基因,胃癌的发生风险增加4.1%(0.9%~7.4%,P=0.012)。见图2。

表1 体脂含量相关遗传变异与胃癌发生风险的相关基因位点Tab.1 Associations of single nucleotide polymorphisms predicting body fat percentage with gastric cancer risk
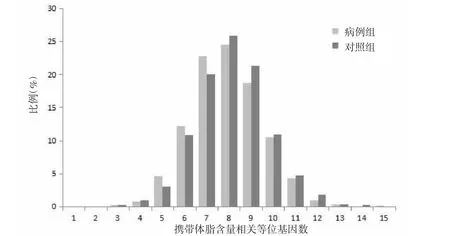
图1 胃癌病例组和对照组体脂含量GRS的分布情况Fig.1 Distributions of genetic risk score predicting body fat percentage among gastric cancer cases and controls
按对照组中体脂含量GRS分布的四分位数将体脂GRS分为四等分后发现,与GRS最低的四分位数人群(Q1)相比,位于最高四分位数的人群(Q4)发生胃癌的风险增加了 18.8%(2.5%~37.9%,P=0.022),其次为中间四分位的人群(Q3),增加了17.4%(0.4%~37.5%,P=0.045),关联效应具有一定的趋势性(趋势检验 P=0.003)。
进一步进行分层分析发现,在研究对象为男性的亚组中,体脂含量遗传评分与胃癌发生风险相关(OR=1.043,95%CI:1.006~1.082,P=0.022),在女性中则未观察到有统计学意义的关联(OR=1.029,95%CI:0.969~1.094,P=0.350),但关联效应值的大小接近且方向一致,差异无统计学意义(P异质性=0.710)。按年龄和地域进行分层分析发现,在小于60岁的研究对象(OR=1.051,95%CI:1.006~1.099,P=0.026)和南京的研究人群中(OR=1.082,95%CI:1.013~1.157,P=0.019),体脂含量GRS与胃癌发生风险相关。见表2。

图2 遗传变异位点与体脂含量及胃癌发生风险的关联Fig.2 Associations of genetic variants with body fat percentage and gastric cancer risk

表2 不同性别、年龄和研究地域人群中体脂含量遗传评分与胃癌发生的关联Tab.2 Subgroup analysis of associations between genetic risk score predicting body fat percentage and gastric cancer risk
3 讨论
既往有不少研究报道了肥胖与恶性肿瘤发生的关联,但结论不一。本研究采用了体脂含量相关遗传变异构建GRS,通过MR设计方法分析了体脂含量相关遗传变异及GRS与胃癌发生风险的关系。研究发现,体脂含量相关多态位点rs9906944和rs543874与胃癌发生风险相关。体脂含量GRS高的人群发生胃癌的风险较高,每增加一个升高体脂含量的等位基因,胃癌的发生风险增加4.1%。本研究首次报道了体脂含量与胃癌发生之间可能存在因果关联。
本研究新发现了两个体脂含量相关遗传变异位点rs9906944、rs543874与胃癌发生风险相关。其中,rs9906944位于IGF2BP1基因的内含子区域。有研究发现,rs9906944与身高、个体成熟相关,增加体脂含量的C等位基因与身高[22]、出牙时间相关[23]。IGF2BP1基因敲除小鼠则表现出胎儿期和出生后发育迟缓[24]。位于SEC16B基因的 rs543874与体重指数(body mass index,BMI)高低及儿童期肥胖发生风险相关,增加体脂含量的G等位基因与高BMI、高儿童期肥胖风险相关[25]。事实上,课题组前期采用MR方法分析发现,BMI与胃癌发生之间存在潜在的因果关联[26],这提示儿童期肥胖发生风险与胃癌的关联也值得进一步研究。
进一步对体脂含量GRS与性别因素进行分析发现,男性胃癌发生风险与体脂含量GRS有相关性,但在女性人群中未观察到有统计学意义的关联。既往研究提示,雌激素可能是导致胃癌发病率和死亡率性别差异的原因之一。例如,研究发现更年期延迟和生育力强的女性胃癌发生风险较低,而阻断雌激素活性的药物如他莫昔芬则与女性胃癌发生风险升高相关[27]。动物实验发现,雌激素治疗小鼠可减少幽门螺杆菌感染引起的胃癌发生,保护妇女免受肥胖相关慢性炎症的损伤[28]。然而在本研究中,女性体脂含量GRS与胃癌发生风险的关联效应估计值大小与男性人群接近,且方向一致,因此不能排除体脂含量与女性胃癌发生风险之间可能存在因果关联。由于本研究中女性人群比例相对较小,因此,统计效能不足可能是未在女性人群中观察到体脂含量与胃癌发生因果效应的原因,需要针对女性人群开展大样本研究进一步证实。同时,研究发现,在小于60岁的人群和南京地区的研究对象中,体脂含量GRS与胃癌发生之间存在统计学关联,提示不同年龄段和不同地域人群中体脂含量与胃癌发生的关联存在差异性,有待进一步大样本研究证实。此外,观察性研究提示肥胖与胃贲门癌的发生相关,而与非贲门癌的证据仍然不足[3]。本研究未能从NCI研究中获取具体的肿瘤部位信息,因此无法按胃癌解剖部位进行分层分析。而南京/北京研究中的病例均为非贲门癌患者,在这部分人群中,体脂含量GRS与非贲门癌发生风险相关。
虽然本研究提示体脂含量与胃癌发生存在潜在的因果关联,但体脂含量增多引起胃癌发生风险升高的生物学机制尚不明确。目前有几种可能的解释:由于肥胖是一种伴随着肿瘤坏死因子-α、白细胞介素-6和C反应蛋白等促炎因子水平升高的低慢性炎症状态,这种低慢性炎症可能与肿瘤的发生发展相关[29]。同时,脂肪组织的累积会导致胰岛素和胰岛素生长因子1信号通路调控紊乱,增加激素的分泌,上调瘦素、脂联素等脂肪因子的表达水平,进一步抑制细胞凋亡、促进癌细胞的生长[29]。此外,肥胖可能导致机体的腹内压升高、导致胃食管反流,进而发展到Barrett食管等癌前病变[29]。尽管这些解释在生物学上有一定的可能性和合理性,仍需体内外功能研究证据来进一步阐明肥胖与胃癌发生之间的生物学机制。
本研究存在一定的局限性。MR研究设计要求对基因-疾病、基因-中间表型的关系有确切的认识,从而尽可能避免出现基因水平或垂直多效性引起的混杂偏倚。但由于基因功能复杂,可能作用于未知的代谢通路或产生未知的生物学功能,控制这类混杂因素的难度较大。此外,虽然本研究的总体样本量较大,但其中女性人群的比例较少,因此在效应估计值较小的情况下,针对女性人群的亚组分析的统计效能欠佳。
综上所述,本研究发现体脂含量相关遗传变异及GRS与胃癌发生风险相关,提示高体脂含量与胃癌发生之间可能存在因果关联,但体脂含量对不同性别、不同部位的胃癌发生的影响仍需进一步大样本研究来阐明。
致谢:感谢所有参加南京/北京和美国NCI胃癌全基因组研究的课题组成员及研究对象。
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methodsand major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-386.
[2]Chen W,Zheng R,Baade P D,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3]Turati F,Tramacere I,La Vecchia C,et al.A metaanalysis of body mass index and esophageal and gastric cardia adenocarcinoma[J].Ann Oncol,2013,24(3):609-617.
[4]Chen Y,Wang X,Wang J,et al.Excess body weight and the risk of primary liver cancer:an updated metaanalysis of prospective studies[J].Eur J Cancer,2012,48(14):2137-2145.
[5]Aune D,Greenwood D C,Chan D S,et al.Body mass index,abdominal fatness and pancreatic cancer risk:a systematic review and non-linear dose-response meta-analysis of prospective studies[J].Ann Oncol,2012,23(4):843-852.
[6]Schlesinger S,Lieb W,Koch M,et al.Body weight gain and risk of colorectal cancer:a systematic review and meta-analysis of observational studies[J].Obes Rev,2015,16(7):607-619.
[7]Bhaskaran K,Douglas I,Forbes H,et al.Body-mass index and risk of 22 specific cancers:a population-based cohort study of 5.24 million UK adults[J].Lancet,2014,384(9945):755-765.
[8]Camargo M C,Freedman N D,Hollenbeck A R,et al.Height,weight,and body mass index associations with gastric cancer subsites[J].Gastric Cancer,2014,17(3):463-468.
[9]Song X,Pukkala E,Dyba T,et al.Body mass index and cancer incidence:the FINRISK study[J].Eur J Epidemiol,2014,29(7):477-487.
[10]Lindkvist B,Almquist M,Bjorge T,et al.Prospective cohort study of metabolic risk factors and gastric adenocarcinoma risk in the Metabolic Syndrome and Cancer Project(Me-Can)[J].Cancer Causes Control,2013,24(1):107-116.
[11]Kim H J,Kim N,Kim H Y,et al.Relationship between body mass index and the risk of early gastric cancer and dysplasia regardless of Helicobacter pylori infection[J].Gastric Cancer,2015,18(4):762-773.
[12]Levi Z,Kark J D,Twig G,et al.Body mass index at adolescence and risk of noncardia gastric cancer in a cohort of 1.79 million men and women[J].Cancer,2018,124(2):356-363.
[13]Song M,Choi J Y,Yang J J,et al.Obesity at adolescence and gastric cancer risk[J].Cancer Causes Control,2015,26(2):247-256.
[14]Steffen A,Huerta J M,Weiderpass E,et al.General and abdominal obesity and risk of esophageal and gastric adenocarcinoma in the European Prospective Investigation into Cancer and Nutrition[J].Int J Cancer,2015,137(3):646-657.
[15]Levi Z,Kark J D,Shamiss A,et al.Body mass index and socioeconomic status measured in adolescence,country of origin,and the incidence of gastroesophageal adenocarcinoma in a cohort of 1 million men[J].Cancer,2013,119(23):4086-4093.
[16]Kim T J,Lee H,Min Y W,et al.Diabetic biomarkers and the risk of proximal or distal gastric cancer[J].J Gastroenterol Hepatol,2016,31(10):1705-1710.
[17]Lin X J,Wang C P,Liu X D,et al.Body mass index and risk of gastric cancer:a meta-analysis[J].Jpn J Clin Oncol,2014,44(9):783-791.
[18]Swanson S A,Tiemeier H,Ikram M A,et al.Nature as a Trialist:Deconstructing the analogy between Mendelian randomization and randomized trials[J].Epidemiology,2017,28(5):653-659.
[19]Lu Y,Day F R,Gustafsson S,et al.New loci for body fat percentage reveal link between adiposity and cardiometabolic disease risk[J].Nat Commun,2016,7:10495.
[20]Shi Y,Hu Z,Wu C,et al.A genome-wide association study identifies new susceptibility loci for non-cardia gastric cancer at 3q13.31 and 5p13.1[J].Nat Genet,2011,43(12):1215-1218.
[21]Abnet C C,Freedman N D,Hu N,et al.A shared susceptibility locus in PLCE1 at 10q23 for gastric adenocarcinoma and esophageal squamous cell carcinoma[J].Nat Genet,2010,42(9):764-767.
[22]Berryman D E,Glad C A,List E O,et al.The GH/IGF-1 axis in obesity:pathophysiology and therapeutic considerations[J].Nat Rev Endocrinol,2013,9(6):346-356.
[23]Pillas D,Hoggart C J,Evans D M,et al.Genome-wide association study reveals multiple loci associated with primary tooth development during infancy[J].PLoS Genet,2010,6(2):e1000856.
[24]Bell J L,Wachter K,Muhleck B,et al.Insulin-like growth factor 2 mRNA-binding proteins(IGF2BPs):posttranscriptional drivers of cancer progression[J].Cell Mol Life Sci,2013,70(15):2657-2675.
[25]Hong K W,Oh B.Recapitulation of genome-wide association studies on body mass index in the Korean population[J].Int J Obes,2012,36(8):1127-1130.
[26]Mao Y,Yan C,Lu Q,et al.Genetically predicted high body mass index is associated with increased gastric cancer risk[J].Eur J Hum Genet,2017,25(9):1061-1066.
[27]Camargo M C,Goto Y,Zabaleta J,et al.Sex hormones,hormonal interventions,and gastric cancer risk:a metaanalysis[J].Cancer Epidemiol Biomarkers Prev,2012,21(1):20-38.
[28]Sheh A,Ge Z,Parry N M,et al.17beta-estradiol and tamoxifen prevent gastric cancer by modulating leukocyte recruitment and oncogenic pathways in Helicobacter pylori-infected INS-GAS male mice[J].Cancer Prev Res,2011,4(9):1426-1435.
[29]Aleman J O,Eusebi L H,Ricciardiello L,et al.Mechanisms of obesity-induced gastrointestinal neoplasia[J].Gastroenterology,2014,146(2):357-373.

