二维反相液相色谱制备五味子中的木脂素
朱靖博, 李文玉, 肖 伟, 丁 燕*, 黄文哲, 屠鹏飞,3, 王永华,4
(1. 大连工业大学食品学院, 辽宁 大连 116034; 2. 江苏康缘药业股份有限公司, 江苏 连云港 222001;3. 北京大学, 北京 100871; 4. 西北农林科技大学, 陕西 杨凌 712100)
色谱技术为中药成分分析及分离制备提供了行之有效的方法,在线与离线的中药成分二维液相色谱分析显著地提高了中药化学成分分析和识别的效率[1-5],如Ji等[6]运用离线二维亲水-反相液相色谱分离鉴定出银杏中的125种化学成分。在中药成分制备领域,袁云等[7]利用离线二维反相液相色谱-超临界流体色谱的方法分离制备瓜蒌子有效成分,结果证明此方法具有良好的正交性。贾有梅等[8]运用二维亲水-反相制备液相色谱分离纯化络石藤中的化学成分,最终得到14个高纯度化合物,且具有良好的正交性。Yang等[9]以离线二维超临界流体色谱-反相液相色谱分离制备了牛蒡子化学成分,得到了12个高纯度化合物。传统的色谱分离方法对于复杂的中药化学体系存在色谱分辨率低、峰容量低、样品峰重叠等一系列问题,难以实现中药成分高通量、系统性的分离制备。而二维色谱的分离制备因为其良好的正交性、更高的峰容量、较高的分辨率和高通量等特点,具有广阔的应用前景。到目前为止,专业的二维色谱分离装置的研制及系统性分离方法的研究尚未见报道,常规的二维液相色谱在分离制备过程中上样量少、获得的有效部位的物质量少、重复性差、成分的系统性获得效果差及在线操作手段复杂,这些因素仍然制约着中药有效成分的系统性认知、活性成分研究及新药创制。
中药五味子(Schisandrachinensis(Turcz.) Baill.)具有收敛固涩,益气生津,补肾宁心的功效,用于治疗久咳虚喘,梦遗滑精,津伤口渴,短气脉虚,内热消渴,心悸失眠等症[10,11]。现代研究表明,木脂素类化合物是五味子的主要活性成分[12],五味子中分离鉴定出的木脂素类化合物已有两百多种。
本文在中药化学成分系统分离策略及设备研究[13]的基础上,以五味子木脂素提取物为对象,以实验室自主研发的基于分离-富集模式的二维反相色谱仪-制备色谱工厂(preparative chromatography platform, PCP)为手段,通过色谱专家系统模拟优化分离条件,建立了可重复获得有效部位、高通量、系统性分离五味子木脂素类化合物的方法。
1 实验部分
1.1 仪器、试剂与材料
分析型仪器:UltiMate 3000高效液相色谱仪(配有Ultimate 3000泵、UltiMate 3000自动进样器、UltiMate 3000光二极管阵列检测器),美国Dionex公司。分析色谱柱为C18(250 mm×4.6 mm, 5 μm),大连博迈科技发展有限公司。
制备型仪器:2D-1000型制备色谱工厂,大连博迈科技发展有限公司。PCP为自主研发的基于分离-富集模式的集分离方法开发、在线分离-富集于一体的天然药物二维制备色谱仪,装置由3台BP1000制备型高压恒流泵、主分离柱C18(250 mm×30 mm, 10 μm)、18个一级富集柱C18(80 mm×30 mm, 10 μm)、9个二级富集柱C18(80 mm×30 mm, 10 μm)组成,两级分离间以2位8通阀相连,实现成分的分离、富集、解吸附与流路切换,分离柱后连接UV1000紫外-可见光检测器和ZB1000梯度混合器,并配有Clarity色谱工作站。
第一维和第二维分离模式的分离-富集原理如图1所示。该装置的第一维分离可以将复杂的天然产物分离成18个可重复获得的组分或有效部位,第二维分离使其进一步分离,得到单体化合物,全部的分离工作在计算机控制下,极大地提高了中药等天然药物系统性分离制备的效率,为中药、植物药、海洋药物有效部位、成分的制备分离、活性筛选提供了高效、可靠的平台。
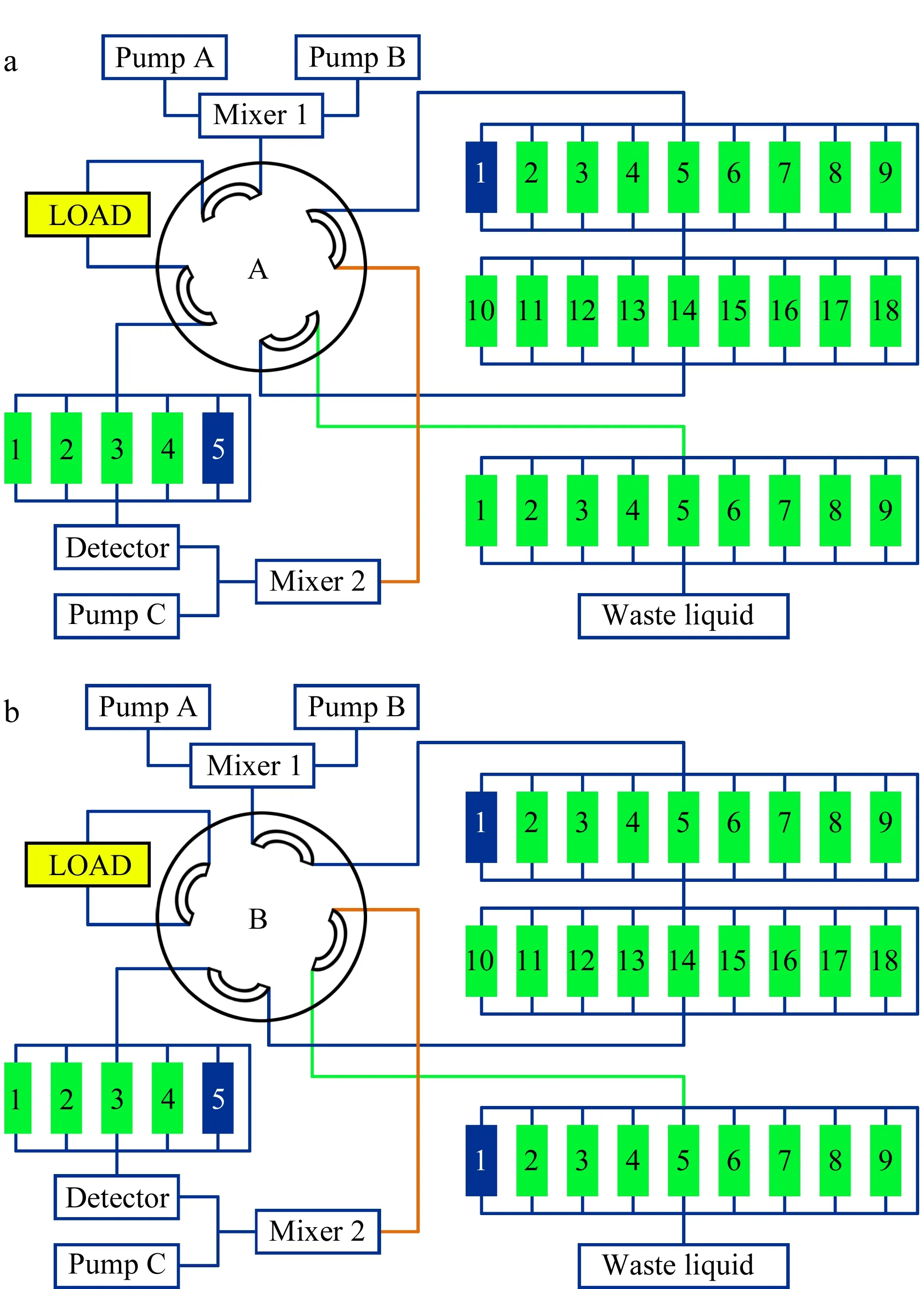
图 1 PCP(a)第一和(b)第二维分离模式图Fig. 1 (a) First- and (b) second-dimensional separation pattern diagram of preparative chromatography platform (PCP) Separation column 1 of the first- and the second-dimensional chromatography: C18 (250 mm×4.6 mm, 5 μm), separation column 2-5 of the first- and the second-dimensional chromatography: C18 (250 mm×30 mm, 10 μm); enriching column 1-18 of the first-dimensional chromatography and enriching column 1-9 of the second-dimensional chromatography: C18 (80 mm×30 mm, 10 μm); pump A and B: gradient elution pump; pump C: diluent solution of enrichment; LOAD valve: two position six-way valve.
甲醇、乙腈(均为色谱级),石油醚、乙酸乙酯(均为工业级),均购于天津大茂化学试剂厂;去离子水为实验室自制。
200~300目柱色谱硅胶购于青岛海洋化工厂分厂;五味子木脂素提取物,购于湖北梦阳药业股份有限公司;五味子木脂素标准品:五味子醇甲、戈米辛D、戈米辛A、五味子甲素、戈米辛N、五味子丙素(纯度均≥98%),购于上海源叶生物科技有限公司。
1.2 样品前处理
称取500 g五味子木脂素提取物拌入1 kg 200~300目硅胶,在60 cm×20 cm的硅胶柱上用石油醚-乙酸乙酯(1∶1, v/v)进行真空色谱分离,收集后得到五味子木脂素富集样品作为分离对象。
1.3 系统性分离方法的构建与应用
1.3.1第一、二维制备色谱条件的优化
将PCP切换到方法开发模式,以第一、二维色谱分离柱1: C18(250 mm×4.6 mm, 5 μm)作为方法开发柱,在4个梯度洗脱条件下,对五味子木脂素富集样品进行HPLC分析,获得样品的色谱分离信息,根据4个色谱图,选定要分离的对象,将其保留时间、峰高,依次对应制成表格,导入XTool软件,模拟优化分离条件。对优化的分离条件进行验证分离,并线性放大,将其转化为第一维分离条件。
将五味子样品配制成质量浓度为80 mg/mL的样品,PCP切换至一维分离模式,采用构建的分离条件,选用C18色谱柱(250 mm×30 mm, 10 μm)进行第一维分离,根据保留时间、分离度等参数,确定木脂素部位分离的时间程序。固定色谱柱、流动相、流速、检测波长,应用确定的第一维分离条件及分离的时间程序,打开辅助泵C,对五味子提取物进行第一维分离和部位富集,重复进样3次,将富集后的组分用甲醇从富集柱上洗脱下来,浓缩蒸干,并测定样品质量。采用同样方法,模拟和优化第一维分离后每个部位的第二维分离条件。
1.3.2PCP线性放大及重现性验证实验
选择分析色谱柱C18(250 mm×4.6 mm, 5 μm)和制备柱C18(250 mm×30 mm, 10 μm),将分析级的样品浓度与流速采用线性放大的方法应用于PCP,考察制备级上样量与流速大小,上样量与流速按照公式(1)和(2)确定:
(1)
(2)
其中M为样品量;V为流速;L为色谱柱长度;r为色谱柱内径;a表示分析柱;p表示制备柱。线性放大到PCP,并以PCP中柱压、分离度和样品溶解度等为指标,调整上样浓度及流速,得到第一维色谱条件。
政府是消除贫困的主体,具有强大的政治优势和资源动员能力,是我国扶贫攻坚取得成功的关键。通过“当地政府主导、人民银行牵头、金融机构参与”的组织形式,建立多部门联动机制,实现资源联结,弥补单靠政府或仅依靠金融机构实施金融精准扶贫的弊端,解决易地扶贫搬迁后续扶持金融服务工作的政策保障、资源整合、信贷支持、精准匹配以及风险分担等问题。
将上述得到的第一维色谱条件应用于PCP,在一维分离模式下进行分离制备,添加辅助泵C,手动进样3次,将第一维分离组分富集到富集柱上。将PCP切换至二维分离模式,依次将每个第一维富集柱作为上样柱,对其进行第二维分离。并将上述所有步骤重复进行3次,用HPLC分别检测这3次分离后的样品成分,根据其保留时间、峰高、峰面积等指标检验PCP对于五味子木脂素的分离是否具有重现性。
1.3.3五味子木脂素的系统性分离制备
选择水(A)和甲醇(B)为流动相,检测波长为254 nm,将PCP切换至一维分离模式,每次进样体积为2 mL,采用构建的第一维分离条件和时间程序进行分离,分离后的样品组分分别吸附到1~10号富集柱上,重复进样3次;将PCP切换至二维分离模式,将富集柱作为上样柱,采用构建的第二维分离条件,分别将富集柱上的样品进行第二维分离;重复第一、二维分离步骤,用HPLC分析第二维分离后的样品,纯度大于95%的样品用NMR鉴定其化学结构,并进一步用标准品对各化合物做定性分析。
2 结果与讨论
2.1 五味子木脂素的第一、二维制备色谱条件优化
4个洗脱条件(1) 0~50 min, 15%B~95%B; (2) 0~40 min, 30%B~100%B; (3) 0~70 min, 20%B~100%B; (4) 0~60 min, 40%B~95%B下的HPLC色谱图如图2所示。在4个洗脱条件下选定30个色谱峰,将保留时间、峰高制成表格,导入Xtool软件,软件模拟预测的洗脱条件为:0~5 min, 60%B~65%B; 5~25 min, 65%B~70%B; 25~35 min, 70%B~85%B; 35~40 min, 85%B~100%B,预测图如图3a所示,应用预测的梯度条件得到的实际色谱图如图3b所示。
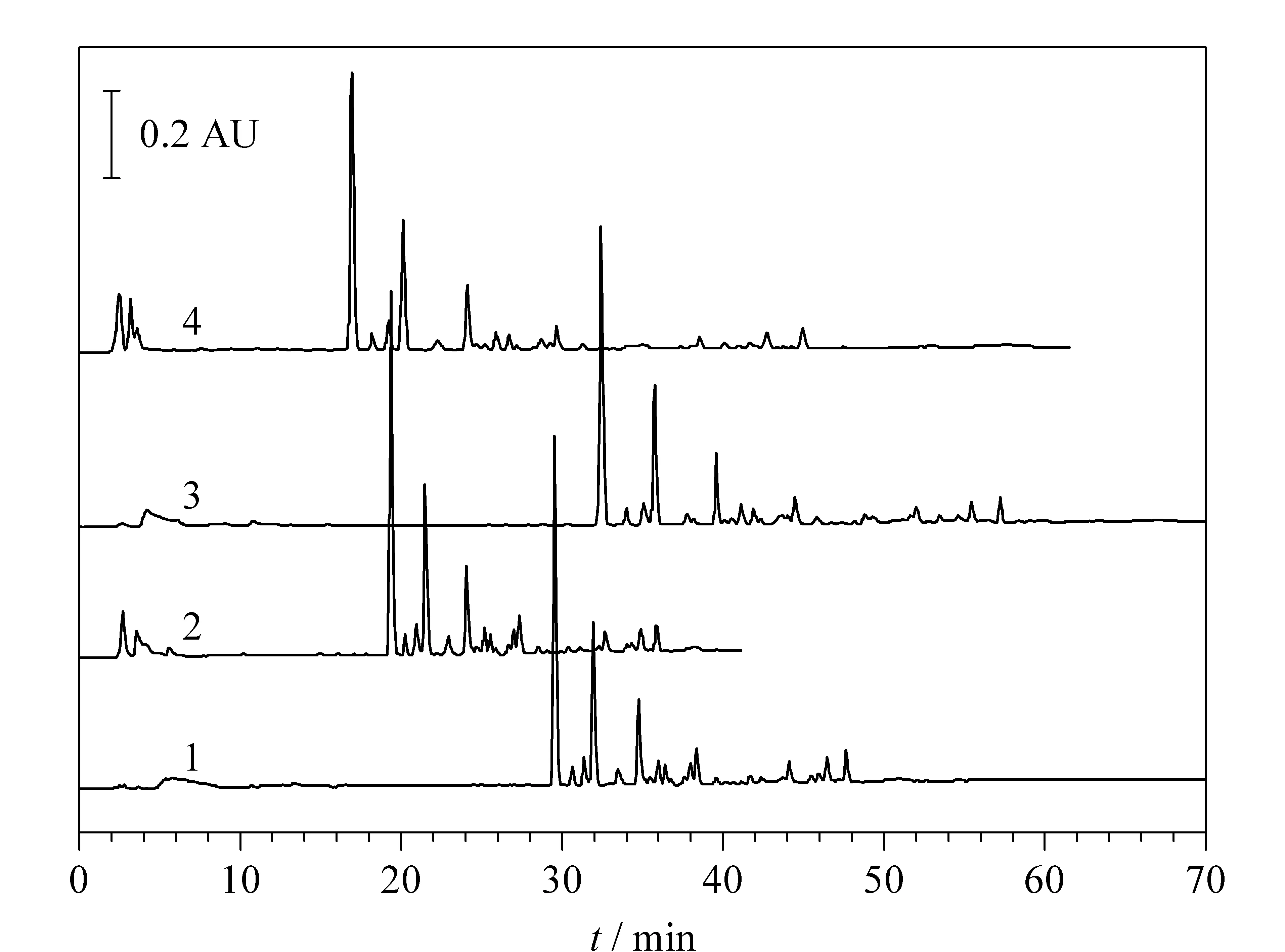
图 2 五味子提取物在4个洗脱条件下的色谱图Fig. 2 Chromatograms of the extracts of Schisandra chinensis under four elution conditions Mobile phases: (A) water; (B) methanol. Gradient elution conditions: (1) 0-50 min, 15%B-95%B; (2) 0-40 min, 30%B-100%B; (3) 0-70 min, 20%B-100%B; (4) 0-60 min, 40%B-95%B.
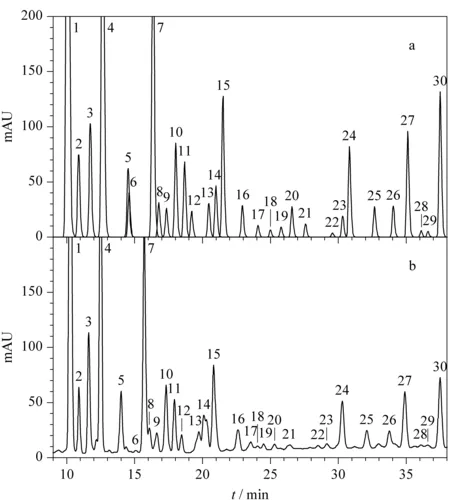
图 3 (a)XTool软件模拟色谱图和(b)模拟条件下的色谱图Fig. 3 Chromatograms (a)simulated by XTool software and (b) under simulated conditions
从图3中可以看出,软件模拟与实际的色谱图在色谱保留时间上基本一致。由于五味子木脂素在制备过程中进样量加大,需要进一步优化梯度条件。HPLC洗脱条件应用于PCP优化后得到的第一维制备的梯度条件为:0~5 min, 60%B~65%B; 5~25 min, 65%B~70%B; 25~35 min, 70%B~85%B; 35~40 min, 85%B~85%B; 40~50 min, 85%B~90%B; 50~60 min, 90%B~95%B; 60~62 min, 95%B~100%B。根据保留时间及分离度将五味子木脂素分为9个简单组分,其中由于1号色谱峰前面有一段洗脱梯度,PCP不能跳跃富集,所以将1号色谱峰前面的洗脱时间设定在1号富集柱上,同时获得第一维分离制备的时间程序:1号柱0~20 min; 2号柱20~28 min; 3号柱28~32 min; 4号柱32~38 min; 5号柱38~42 min; 6号柱42~45 min; 7号柱45~47 min; 8号柱47~50 min; 9号柱50~54 min; 10号柱54~58 min。
2.2 线性放大及重现性结果
上样量根据公式(1)进行线性放大。HPLC样品分析时的质量浓度为2 mg/mL,线性放大后的上样质量浓度为80 mg/mL;流速根据公式(2)进行放大,HPLC流动相流速为0.5 mL/min,得到制备级流速为21 mL/min。
应用第一维色谱条件,将五味子样品进行第一维分离。根据色谱峰的分离度,将第一维分离结果分为9个简单组分,重复第一维分离3次,得到的色谱图如图4所示。保留时间及其他色谱峰信息基本相同。

图 4 五味子提取物3次第一维分离的色谱图Fig. 4 First dimensional separation chromatograms of Schisandra chinensis extracts separated for three times Peak Nos. are the same as in Fig. 3.
重复3次第一维分离后,选择第1、4、7、10、14、15、24、26、27和30号一共10个色谱峰,分别测得相对保留时间的RSD值,如表1所示,RSD均小于3%,证明PCP分离五味子木脂素具有重现性。
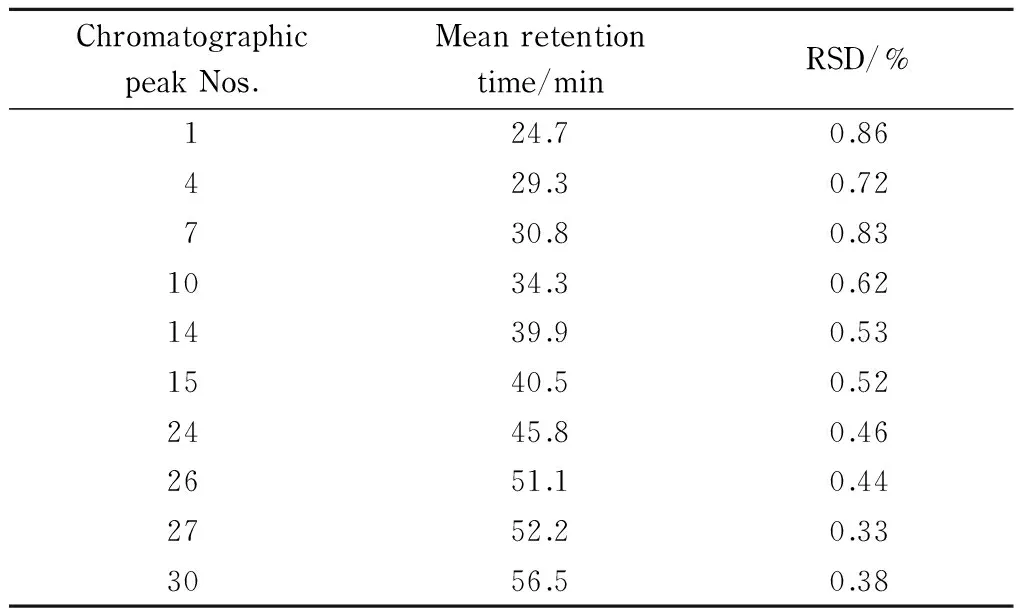
表 1 重现性实验结果(n=3)
2.3 五味子木脂素PCP分离制备结果
2.3.1五味子木脂素的第一维分离制备结果
应用第一维色谱条件对五味子样品进行第一维分离,制备色谱图如图5所示,重复进样3次,每次进样2 mL,第一维分离将五味子提取物分成9个简单组分,HPLC分析后如图6所示。测定9个第一维分离的样品质量分别为:152.9、174.3、43.5、10.7、9.5、9.2、1.3、2.6和3.6 mg,求得第一维分离样品的得率分别为31.85%、36.31%、9.06%、2.23%、1.98%、1.92%、0.27%、0.54%和0.75%。
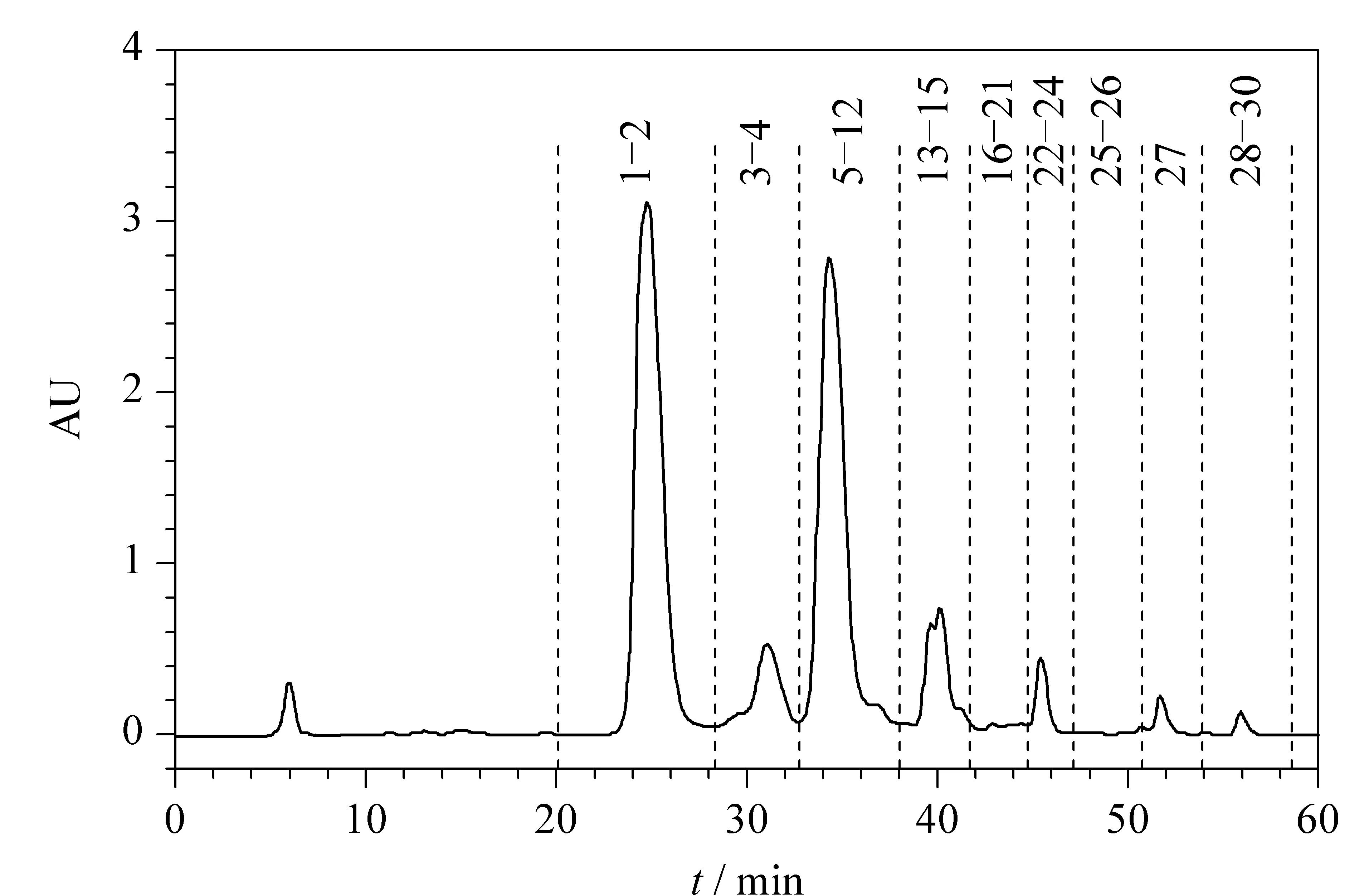
图 5 五味子提取物的PCP第一维分离图谱Fig. 5 First dimensional separation chromatogram of Schisandra chinensis extracts by PCPPeak Nos. are the same as in Fig. 3.
2.3.2五味子木脂素二维分离制备结果
9个一维分离组分进行二维分离后得到20个组分,如图7所示,其中有10个化合物纯度达到90%以上,6个化合物纯度达95%以上。使用13C-NMR和1H-NMR对这6个高纯度化合物进行结构鉴定,并进一步用标准品进行定性分析,通过保留时间和紫外光谱分析确定其结构,如图8所示。
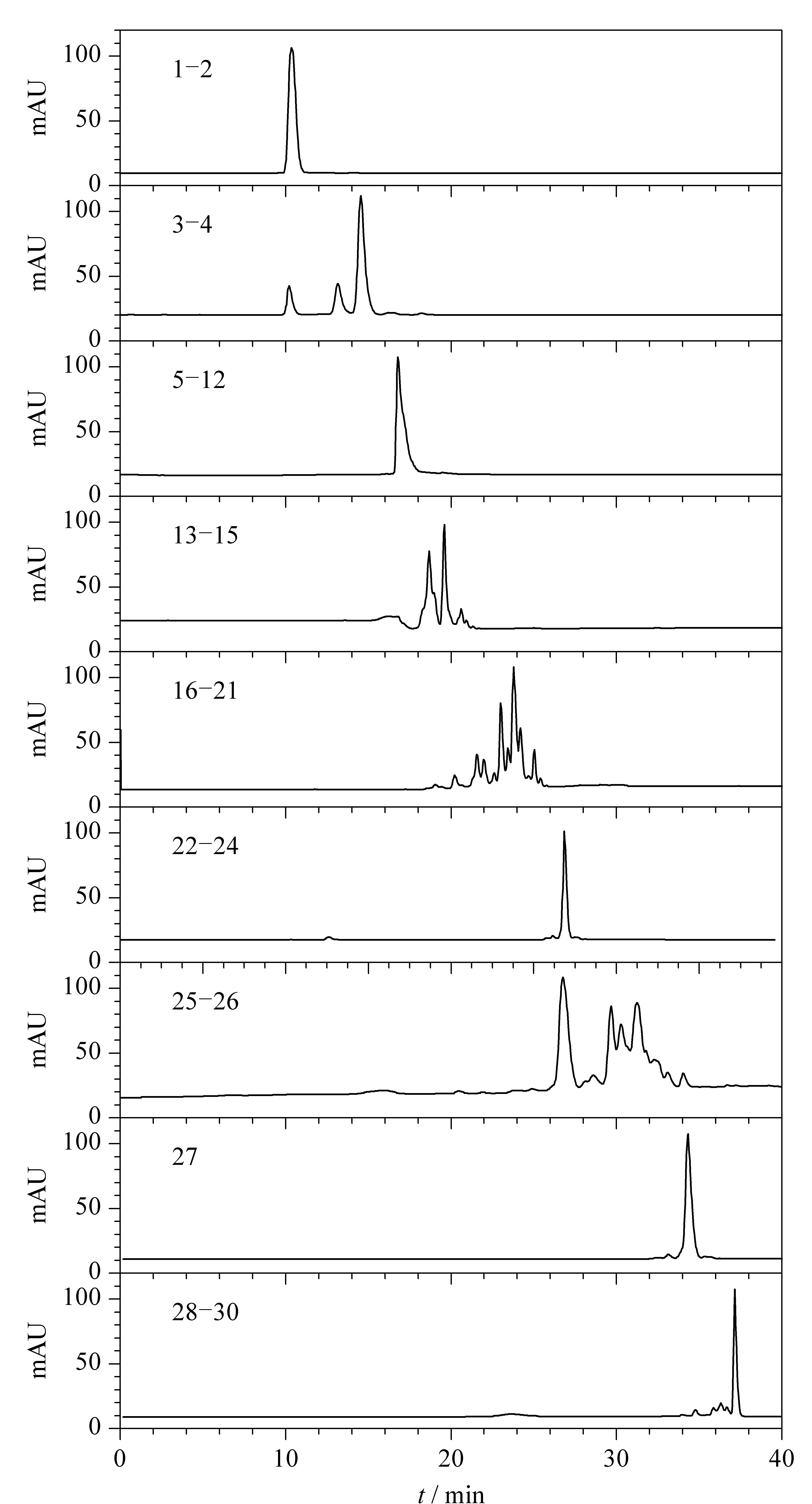
图 6 五味子提取物的9个第一维分离样品HPLC色谱图Fig. 6 HPLC chromatograms of nine samples of Schisandra chinensis extracts after the first dimensional separation Peak Nos. are the same as in Fig. 3.
2.4 五味子木脂素单体化合物的结构鉴定
化合物Ⅰ:淡黄色膏体(20 mg),1H-NMR(400 MHz, CD3OD):δ0.83(d,J=8 Hz, 3H, CH3-17), 1.24(s, 3H, CH3-18), 2.57(d,J=16 Hz, 1H, CHH-6), 2.17(d,J=4 Hz, 1H, CHH-6), 2.38(dd,J=12, 8 Hz, 1H, CHH-9), 2.85(dd,J=8, 4 Hz, 1H, CHH-9), 3.85(s, 6H, 2×OCH3-1, 14), 3.89(s, 6H, 2×OCH3-2, 13), 3.92(s, 6H, 2×OCH3-3, 12), 6.76(s, 1H, PhH-4), 6.71(s, 1H, PhH-11)。碳谱数据见表2,与文献对照[14],二者基本一致,确定化合物Ⅰ为五味子醇甲(schisandrol A),结构如图9所示。
化合物Ⅱ:无色针状结晶(15 mg),1H-NMR(400 MHz, CD3OD):δ1.07(d,J=8 Hz, 3H, CH3-17), 1.09(d,J=8 Hz, 3H, CH3-24), 1.19(s, 3H, CH3-18), 1.22(s, 3H, CH3-23), 1.73~1.77(m, 1H, CH3CH-8), 1.70(s, 1H, OH-7), 1.91(dd,J=12, 8 Hz, 1H, CHH-9), 2.21(dd,J=12, 8 Hz, 1H, CHH-9), 3.19(s, 1H, OH-20), 3.67(s, 3H, OCH3-1), 3.82(s, 3H, OCH3-2), 3.94(s, 3H, OCH3-3), 5.83(s, 1H, H-6), 5.92(d,J=8 Hz, 2H, OCH2O), 6.56(s, 1H, PhH-11), 6.95(s, 1H, PhH-4)。碳谱数据见表2,与文献对照[15,16],二者基本一致,确定化合物Ⅱ为戈米辛D(gomisin D),结构如图9所示。
化合物Ⅲ:无色针状结晶(15 mg),1H-NMR(400 MHz, CD3OD):δ0.82(d,J=8 Hz, 3H,CH3-17), 1.23(s, 3H, CH3-18), 1.75~1.83(m, 1H, CH3CH-8), 2.32(dd,J=12, 8 Hz, 1H, CHH-9), 2.57(dd,J=12, 8 Hz, 1H, CHH-9), 2.41(d,J=8 Hz, 1H, CHH-6), 2.80(d,J=8 Hz, 1H, CHH-6), 3.45(s, 3H, OCH3-1), 3.86(s, 3H, OCH3-2), 3.92(s, 6H, 2×OCH3-3, 14), 5.95(s, 2H, OCH2O), 6.54(s, 1H, PhH-11), 6.76(s, 1H, PhH-4)。碳谱数据见表2,与文献对照[17],二者基本一致,确定化合物Ⅲ为戈米辛A(gomisin A),结构如图9所示。

图 7 五味子提取物的20个第二维分离样品HPLC色谱图Fig. 7 HPLC chromatograms of 20 samples from Schisandra chinensis extracts after the second dimensional separation Peak Nos. are the same as in Fig. 3.

图 8 五味子提取物二维分离得到的单体和标准品的色谱图及紫外光谱图Fig. 8 Chromatograms and UV spectra of the standards and monomers from Schisandra chinensis extracts after the first and the second dimensional separations

PositionδⅠⅡⅢⅣⅤⅥ1151.27151.10151.23151.22151.63141.162140.20142.01140.10140.08139.92134.873152.05151.62151.87153.07151.34147.764110.76112.91111.22107.52110.88105.615133.55131.68133.03139.46134.35132.53640.8986.6140.8235.0338.5638.39772.1871.4071.9940.9333.5933.66841.2343.7941.1433.7640.8440.83934.2735.6134.1838.6734.9434.8010134.83137.93133.69134.28137.72137.9811110.96102.49105.72110.93102.62102.5112151.91148.56148.01151.79148.94148.8413140.12138.04135.18139.73134.77134.5214151.14138.40141.07151.07140.85140.9215123.21121.30122.35123.35121.28121.1416123.44122.71123.49122.27123.34122.301714.9617.8214.8811.5721.5011.471828.3328.6928.6920.6112.9020.59O-CH3C-355.0555.2455.1155.1655.15C-1255.1555.20C-1459.6158.5959.6058.5658.54C-159.6659.8559.6059.6059.5758.54C-259.9759.9560.0360.0460.06C-1360.0260.04O-CH2-O101.03100.83100.7100.67100.71C=O176.282075.332138.722273.192325.292410.05
In CD3OD, 100 MHz.

图 9 五味子木脂素单体化合物的结构图Fig. 9 Structure diagram of monomers from Schisandra chinensis extracts Ⅰ. schisandrol A; Ⅱ. gomisin D; Ⅲ. gomisin A; Ⅳ. schizandrin A; Ⅴ. gomisin N; Ⅵ. schisandrin C.
化合物Ⅳ:无色针状结晶(11 mg),1H-NMR(400 MHz, CD3OD):δ0.76(d,J=4 Hz, 3H, CH3-17), 1.03(d,J=8 Hz, 3H, CH3-18), 1.84~1.95(m, 1H, CH3CH-8), 1.76~1.81(m, 1H, CH3CH-7), 2.25(dd, 1H,J=12, 8 Hz, CHH-9), 1.91(dd, 1H,J=12, 8 Hz, CHH-9), 2.47~2.50(m, 2H, CH2-6), 6.71(s, 2H, PhH-4, 11)。碳谱数据见表2,与文献对照[14,18],二者基本一致,确定化合物Ⅳ为五味子甲素(schizandrin A),结构如图9所示。
化合物Ⅴ:白色粉末(13 mg),1H-NMR(400 MHz, CD3OD):δ0.74(d,J=8 Hz, 3H, CH3-17), 1.00(d,J=8 Hz, 3H, CH3-18), 1.73~1.82(m, 1H, CH-8), 1.90~1.94(m, 1H, CH-7), 2.41(dd,J=12, 8 Hz, 1H, CHH-6), 2.61(dd,J=12, 8 Hz, 1H, CHH-6), 2.04~2.10(m, 1H, CHH-9), 2.20(dd,J=12, 8 Hz, 1H, CHH-9), 3.48(s, 3H, OCH3-1), 3.76(s, 3H, OCH3-2), 3.86(s, 3H, OCH3-3), 3.89(s, 3H, OCH3-14), 5.95(s, 2H, OCH2O), 6.52(s, 1H, PhH-11), 6.69(s, 1H, PhH-4)。碳谱数据见表2,与文献对照[18],二者一致,确定化合物Ⅴ为戈米辛N(gomisin N),结构如图9所示。
化合物Ⅵ:无色针状结晶(17 mg),1H-NMR(400 MHz, CD3OD):δ0.73(d,J=8 Hz, 3H, CH3-17), 0.98(d,J=8 Hz, 3H, CH3-18), 1.71~1.80(m, 2H, CH-8), 1.84~1.90(m, 2H, CH-7), 1.99(d,J=12 Hz, 1H, CHH-9), 2.23(d,J=8 Hz, 1H, CHH-9), 2.40(dd,J=8, 4 Hz, 1H, CHH-6), 2.54(dd,J=8, 8 Hz, 1H, CHH-6), 3.76(s, 6H, 2×OCH3), 5.95(s, 4H, 2×OCH2O), 6.49(s, 2H, PhH-4, 11)。碳谱数据见表2,与文献对照[18],二者一致,确定化合物Ⅵ为五味子丙素(schisandrin C),结构如图9所示。
3 结论
本研究以五味子为研究对象,XTool软件模拟筛选色谱条件,应用反相二维色谱对五味子化学成分进行系统分离,构建了一套系统的五味子木脂素分离制备方法,并重复得到6个五味子木脂素单体化合物五味子醇甲、戈米辛D、戈米辛A、五味子甲素、戈米辛N、五味子丙素,同时运用核磁共振数据对化合物进行结构鉴定。
本文所用方法简单、省时省力、污染少,对于五味子及其他中药复杂成分的分离、中药新药开发、药理活性的研究具有重要意义,为进一步对多维色谱分离中药成分的研究提供重要的依据。
:
[1] Tang T, Zhang W B, Li T, et al. Chinese Journal of Analytical Chemistry, 2007, 35(12): 1767
唐涛, 张维冰, 李彤, 等. 分析化学, 2007, 35(12): 1767
[2] Shen B J, Qin K M, Liu Q D, et al. Scientia Sinica Chimica, 2013, 43(11): 1480
沈保家, 秦昆明, 刘启迪, 等. 中国科学: 化学, 2013, 43(11): 1480
[3] Gao W, Song H P, Yang H, et al. Chinese Journal of Chromatography, 2017, 35(1): 121
高雯, 宋慧鹏, 杨华, 等. 色谱, 2017, 35(1): 121
[4] Chen X G, Kong L, Sheng L H, et al. Chinese Journal of Chromatography, 2005, 23(1): 46
陈学国, 孔亮, 盛亮洪, 等. 色谱, 2005, 23(1): 46
[5] Gao H, Wen X S, Ma X J, et al. Chinese Journal of Pharmaceutical Analysis, 2007, 27(4): 616
高辉, 温学森, 马小军, 等. 药物分析杂志, 2007, 27(4): 616
[6] Ji S, He D D, Wang T Y, et al. J Pharmaceut Biomed, 2017, 146(30): 68
[7] Yuan Y, Xin H X, Peng Z Y, et al. Chinese Journal of Chromatography, 2017, 35(7): 683
袁云, 辛华夏, 彭子悦, 等. 色谱, 2017, 35(7): 683
[8] Jia Y M, Cai J F, Xin H X, et al. Chinese Journal of Chromatography, 2017, 35(6): 650
贾有梅, 蔡剑锋, 辛华夏, 等. 色谱, 2017, 35(6): 650
[9] Yang B, Xin H, Wang F, et al. J Sep Sci, 2017, 40(16): 3231
[10] Dai X G, Song L. Information on Traditional Chinese Medicine, 2017, 34(5): 121
代晓光, 宋琳. 中医药信息, 2017, 34(5): 121
[11] Xu C X, Liu M, Chen D L, et al. Chinese Traditional Patent Medicine, 2017, 39(3): 547
胥春霞, 刘嫚, 陈东林, 等. 中成药, 2017, 39(3): 547
[12] Szopa A, Ekiert R, Ekiert H. Phytochem Rev, 2017, 16(2): 195
[13] Li Y J. [MS Dissertation]. Dalian: Dalian Polytechnic University, 2016
李怡佳. [硕士学位论文], 大连: 大连工业大学, 2016
[14] Ikeya Y, Taguchi H, Sasaki H, et al. Phytochemistry, 1988, 27(2): 569
[15] Ikeya Y, Taguchi H, Yosioka I, et al. Chem Pharm Bull, 1979, 27(6): 1395
[16] Chen H Y, Zhou C X, Yao W, et al. Chinese Journal of Magnetic Resonance, 2005, 22(1): 43
陈海永, 周长新, 姚巍, 等. 波谱学杂志, 2005, 22(1): 43
[17] An R B, Oh S H, Jeong G S, et al. Nat Prod Sci, 2006, 12(3): 134
[18] Seo S M, Lee H J, Park Y K, et al. Nat Prod Sci, 2004, 10(3): 104

