MTHFR C667T等位点基因多态性与CHD发病的关系
胡晨鸣,吴瑜
(1佛山市中医院,广东佛山528000;2广东省中医院)
冠心病(CHD)是一种常见的心血管疾病,主要是指冠状动脉粥样硬化斑块形成或血管痉挛引起管腔阻塞或狭窄,并导致缺血缺氧性的心脏疾病,其发病率和病死率均较高,现已成为威胁人类健康的主要疾病之一[1,2]。CHD的具体发病机制目前尚不完全清楚,一般认为与炎症反应有关,而高水平血浆同型半胱氨酸(Hcy)也是CHD发病的独立危险因子,其可导致血管平滑肌增生、内皮细胞损伤以及血栓形成的发生,进而导致血管粥样硬化的发生[3,4]。亚甲基四氢叶酸还原酶(MTHFR)参与了Hcy的再甲基化过程,而其基因多态性可能与高Hcy血症、CHD等的发生有一定的关系[5,6]。本研究对CHD患者和健康志愿者的MTHFR C667T等位点的基因多态性进行了检测分析,拟探讨MTHFR C667T等位点的多态性与CHD发病的关系。
1 资料与方法
1.1 临床资料 选取2016年1月~2017年9月佛山市中医院确诊的CHD患者94例(CHD组),其中男56例、女38例,年龄51~81(65.0±10.2)岁,体质量指数(BMI)(23.9±2.5)kg/m2。另选取健康志愿者94例作为对照组,其中男52例、女42例,年龄45~78(63.0±12.9)岁,BMI(23.5±2.4)kg/m2。两组年龄、性别、BMI比较差异均无统计学意义(P均>0.05)。纳入标准:①CHD患者的诊断标准依据《CHD诊治指南》2014年版中的标准;②患者经冠脉造影检查,至少有一支冠脉的狭窄程度≥50%;③对照组来源于本院门诊健康体检结果正常的自愿者;④本研究获得研究对象的知情同意、医学伦理委员会的批准。排除标准:①伴有凝血功能疾病、贫血;②伴有肿瘤疾病;③心肌病、新瓣膜病、先心病、重度心衰;④重症感染患者;⑤合并严重创伤的患者;⑥近3个月内具有脑血管病史。所有受试者均已签署知情同意书。
1.2 MTHFR C667T等位基因频率及基因型检测 采用RT-PCR法。所有受试者均于清晨空腹抽取外周静脉血约5 mL,采用DNA提取试剂盒(北京天根生化科技科技有限公司)提取DNA,具体步骤严格按照试剂盒说明书进行操作。将DNA片段在聚合酶的作用下进行扩增,引物如下:上游5′-TGAAGGAGAGGGTGTCTGCGGGA-3′,下游5′-AGGACGAGAAGGTGAGAGTG-3′;扩增条件如下:95 ℃ 5 min后以95 ℃ 15 s进行变性,60 ℃ 60 s进行退火,72 ℃ 5 min 30 s进行延伸,此为1个循环,共进行40个循环。取5 μL扩增产物采用琼脂糖凝胶电泳进行分析,并取10 μL采用HinfI限制性内切酶进行酶切,酶切体系如下:PCR 产物10 μL,HinfI限制性内切酶0.5 μL,内切酶缓冲液2 μL和去离子水7.5 μL,置于37 ℃ 水浴中切2 h ,然后利用凝胶成像系统判断基因型。取部分PCR产物纯化,采用上海百傲生物技术有限公司提供的基因芯片检测MTHFR C667T的基因频率、基因型,按说明书进行操作。对比两组的MTHFR C667T等位基因频率及基因型。
1.3 血压、血生化及血脂检测 受试者均采集空腹静脉血,采用全自动生化分析仪(日本日立公司)测定载脂蛋白A(apoA)、载脂蛋白B(apoB)等生化指标,采用标准酶法测定血清胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)等血脂指标,具体检测步骤严格按照说明书进行操作。所有受试者均于清晨采用电子血压计测量收缩压(SBP)和舒张压(DBP),共测量两次,取平均值作为血压数值。对比两组的SBP、DBP、血清胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、载脂蛋白A(apoA)、载脂蛋白B(apoB)。
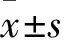
2 结果
2.1 两组MTHFR C667T基因型、等位基因频率比较 CHD组患者的MTHFR C667T的CT基因型构成比高于对照组(P<0.05),CC基因型构成比低于对照组(P<0.05);CHD组和对照组的MTHFR C667T位点等位基因C、T频率差异均无统计学意义(P均>0.05)。见表1。

表1 两组MTHFR C667T基因型、等位基因频率比较
注:与对照组比较,*P<0.05。
2.2 两组血压、血生化指标比较 两组SBP、DBP及apoB水平差异均无统计学意义(P均>0.05);CHD组的TC、TG、HDL-C、LDL-C、apoA与对照组比较,差异均有统计学意义(P均<0.05)。见表2。
2.3 CHD发病的危险因素分析 经多因素Logistic回归分析示TC、TG、LDL-C水平升高、基因型为CT、LDL-C、apoA水平降低是人群发生CHD的独立危险因素(P均<0.05)。见表3。
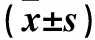
表2 两组血压、血生化指标比较
注:与对照组比较,*P<0.05。
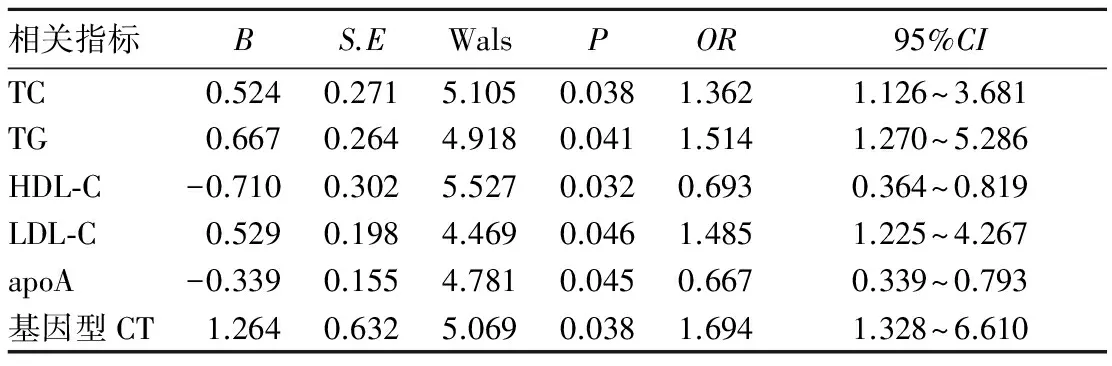
表3 CHD发病的危险因素分析
3 讨论
CHD是一种常见的心血管疾病,具有发病率高和病死率高等特点,现已成为威胁人民健康的主要疾病之一[7]。我国大约有2亿CHD患者,且患病人数正逐年升高,其发病原因有很多,如高龄、高脂、高胆固醇、高血压、糖尿病、吸烟、超重、肥胖等,但具体发病机制目前尚不完全清楚[8]。随着对CHD研究的不断深入,一些新型的CHD高危因素也在逐渐被发掘,其中高Hcy被认为是CHD的独立危险因素之一[9]。目前已有多项研究表明[10,11],Hcy与CHD的发生和发展有着密切的关系,其可能会引起血管动脉粥样硬化病变。MTHFR的主要作用是在叶酸代谢通路中将5,10-亚甲基四氢叶酸转化为具有生物学功能的5-甲基四氢叶酸,而5-甲基四氢叶酸可以进一步进入甲基传递通路,通过Hcy的重新甲基化过程间接为DNA甲基化和蛋白质甲基化提供甲基,并且使血液中的Hcy水平保持在一个较低的水平。多项研究表明[12],MTHFR基因的缺陷对孕妇人群会引起神经管缺陷、先天性心脏病、唇腭裂、妊娠期高血压疾病,自发性流产。也有研究表明,MTHFR基因多态性与肺癌、胃癌、大肠癌等肿瘤疾病以及高血压、CHD、脑梗塞、脑溢血等心血管疾病也有着密切的关系。
基因多态性是一种广泛存在的生物现象,它可以造成基因结构和功能上的不同,而目前针对CHD的病因研究也已经深入到基因水平。多项研究也表明,MTHFR C667T等位基因突变可导致酶的不稳定型突变,导致Hcy的甲基化受阻,进而使体内出现高水平的Hcy,其中CT基因型是引起酶活性降低的主要机制,这与本研究的研究结果基本一致。本研究发现,CHD组患者的MTHFR C667T的CT基因型占比92.55%显著的高于对照组的76.60%;CHD组和对照组的MTHFR C667T位点等位基因C、T频率差异无统计学意义,提示MTHFR C667T位点基因中CT型基因型可能是CHD患者遗传易感性基因标志之一,其可能与CHD的发生和发展有一定的关系。
CHD的发病因素有很多,高血压、高血脂、高血糖等都与其发生和发展有着密切的关系。本研究发现,CHD组和对照组的年龄、性别、BMI、SBP、DBP及apoB水平差异无统计学意义,而CHD组的TC、TG、HDL-C、LDL-C、apoA与对照组比较差异具有统计学意义。进一步做多因素Logistic回归分析发现,TC、TG、LDL-C水平升高、基因型为CT、LDL-C、apoA水平降低是人群发生CHD的独立危险因素,这与文献的研究结果基本一致。范小历等[13]研究表明,MTHFR C667T等位点多态性突变是CHD的一个危险因素,中国汉族人MTHFR C667T基因多态性与CHD有关,T等位基因携带者易发生CHD。但Rothenbache等[14]却认为,MTHFR基因多态性与血浆Hcy水平和CHD无关。目前对于MTHFR基因多态性与心脑血管疾病的关系仍无统一的结论。本研究通过研究分析认为,MTHFR C667T等位点的基因多态性与CHD的发生和发展有一定的关系,其是人群发生CHD的独立危险因素之一。但本研究限于研究样本的不足,对于MTHFR C667T等位点的基因多态性与CHD发生发展的关系和机制仍需做进一步的深入研究。
参考文献:
[1] Oldridge N. Exercise-based cardiac rehabilitation in patients with coronary heart disease: meta-analysis outcomes revisited.[J]. Future Cardiol, 2016, 8(5):729-751.
[2] Ference BA, Majeed F, Penumetcha R, et al. Effect of Naturally random allocation to lower low-density lipoprotein cholesterol on the risk of coronary heart disease mediated by polymorphisms in NPC1L1, HMGCR, or Both: A 2× 2 factorial mendelian randomization study[J]. J Am Coll Cardiol, 2015, 65(15):1552-1561.
[3] 刘凤杰, 何国平, 钱志宏,等.急性心肌梗死患者PAPP-A基因IVS6+95多态性与血清PAPP-A水平的相关性[J].江苏大学学报(医学版), 2011, 21(1):50-54.
[4] 赵鹏,王玮玮,宋执敬.血浆同型半胱氨酸水平与冠心病患者冠脉病变程度的相关性研究[J].河北医药, 2016, 38(11):1611-1613.
[5] Soriano FR, Soriano C, Estornell J, et al. 229 Non invasive diagnosis of coronary artery disease in patients with heart failure and systolic dysfunction of uncertain etiology, using gadolinium cardiovascular magnetic resonance[J]. Eur J Heart Fail Sup, 2015,3(S1):53.
[6] Nishihama K, Yamada Y, Matsuo H, et al. Association of gene polymorphisms with myocardial infarction in individuals witll or without conventional coronary risk factors[J]. Int J Mol Med, 2007,19(1):129-141.
[7] 宇丽艳,丰小星,顾岩,等.冠心病患者PCI术后康复时机对患者心功能影响[J].现代仪器与医疗,2017,23(4):128-130.
[8] 吴凡,张蔷,杜鑫,等.妊娠相关蛋白A对老年急性冠状动脉综合征患者的预后价值[J].中华老年心脑血管病杂志, 2015,17(11):1151-1154.
[9] 赵伟林,杨帆,员丽培,等.血清同型半胱氨酸及脂蛋白(a)与冠心病的相关性研究[J].中国循证心血管医学杂志,2015,7(2):229-231.
[10] 郑冠群,盛晓东,周建龙,等.高敏C反应蛋白、同型半胱氨酸、白细胞介素2和脂蛋白相关磷脂酶A2与冠心病的相关性研究[J].中国心血管杂志,2016,21(3):218-222.
[11] 吕雪,徐金义,李涛,等.河南汉族人群MTHFR基因多态性及同型半胱氨酸与冠心病关系研究[J].中华实用诊断与治疗杂志, 2015, 29(6):603-604.
[12] Park S, Youn JC, Shin DJ, et a1. Genetic polymorphism in the pregnancyassociated plasma protein-A associated with acute myocardial infarction[J]. Coron Artery Dis,2007,18(6):417-422.
[13] 范小历,游云鹏,潘士勇,等.MTHFR基因多态性及同型半胱氨酸与老年冠心病的相关性[J].东南国防医药,2012,14(4):320-321.
[14] Rothenbacher D, Fischer HG, Hoffmeister A, et al. Homocysteine and methylenetetrahydrofolate reductase genotype: association with risk of coronary heart disease and relation to inflammatory, hemostatic, and lipid parameters[J]. Atherosclerosis,2002,162(1):193-200.

